CTAB反胶束体系合成己酸乙酯及气相色谱法检测
2020-06-12
(威海海洋职业学院,山东 威海 264300)
己酸乙酯作为浓香型白酒的主要风味物质,广泛应用于酿酒行业[1].目前一般采用对甲苯磺酸或硫酸等化学法合成己酸乙酯[2].但化学法会产生很多缺点,比如有毒物质残留、副反应多、后处理复杂、白酒质量差等.而生物合成法合成短链酯已成为研究热点[3-6].生物合成法有两种:一种是微生物合成法,即利用反应液中微生物细胞内的酶进行催化合成,其缺点是操作繁琐、代谢产物复杂、产量小,无法满足企业实际生产的需要;另一种是酶合成法,优点是酶因不溶于有机溶剂可反复使用、酶催化反应条件温和、副产物少.近年来,利用酶合成己酸乙酯迅速发展.1991年荷兰某公司就推出了生物酯产品,批次生产规模相当可观[7].国内关于脂肪酶催化合成酯也有相关报道,例如张艳等人用脂肪酶在非水相中催化合成己酸乙酯,最终用滴定法通过测定正己酸消耗量计算产物的产率达90%以上[8].脂肪酶催化合成己酸乙酯多使用有机介质,如正己烷或正庚烷溶剂[9],酶催化己酸和无水乙醇合成己酸乙酯的无溶剂体系,产品后期处理更简单,环境污染较小,但因为反应体系的极性较高,易造成酶蛋白变性而降低催化活性.[1]近年来,反胶束酶催化反应成为新的研究热点,反胶束是一种微乳液,其表面活性剂分子组成的膜将油水相隔开,模拟酶的天然环境,从而有利于保持酶的活性和稳定性[10].因此利用反胶束酶催化合成己酸乙酯的方法简便、快捷、高效,会给企业带来新的发展.
己酸乙酯作为一些白酒的重要特征指标,它含量的高低在某种程度上标志着酒质量的好坏[11].目前检测己酸乙酯的方法主要是酸碱滴定法测定转化率.酸碱滴定法检测误差太大,步骤繁冗,检测速度慢,且反胶束体系环境复杂,不利于检测;同时,由于己酸为弱酸,尽管使用浓度极低的标准氢氧化钠滴定,分析样品中己酸含量很少且相差不明显,导致滴定分析数据稳定性不好[12].而气相色谱检测法分离效率高,样品用量少,检测灵敏度高,选择性好,可分离、分析恒沸混合物,沸点相近的物质.试验以阳离子表面活性剂CTAB构建反胶束体系催化合成己酸乙酯,建立气相色谱外标法检测己酸乙酯的产量,为实际生产中己酸乙酯的检测提供依据.
1 材料与方法
1.1 材料与试剂
脂肪酶;己酸乙酯(色谱纯);正己酸(分析纯);三氯甲烷(分析纯);正丁醇(分析纯);异辛烷(分析纯);十六烷基三甲基溴化铵(CTAB,分析纯);正己醇(化学纯);聚乙烯醇;磷酸(分析纯);橄榄油(化学纯);考马斯亮兰G250(分析纯);无水乙醇、磷酸二氢钠(NaH2PO4·2H2O)、磷酸氢二钠(Na2HPO4·12H2O)等均为分析纯.
1.2 仪器与设备
SP6800 A气相色谱仪(山东省南瑞虹化工仪器有限公司),CHA-S恒温振荡器(金坛市新航仪器厂),78-1型磁力搅拌器(江苏常州国华仪器厂),DS-1高速组织捣碎机(上海标本模型厂),98-1-B型电子调温电热套(天津泰斯特仪器有限公司),DHP-9002型电热恒温培养箱(上海益恒实验仪器有限公司),HH-8恒温水浴锅(金坛市新航仪器厂),TGL-16G台式高速离心机(上海安亭飞鸽有限公司).
1.3 试验方法
1.3.1 脂肪酶CTAB反胶束体系的制备
以异辛烷:正己醇:酶溶液(体积比)为43∶6∶1配制反胶束体系,加入100 mmol/L的CTAB,用磁力搅拌器充分搅拌混合,形成透明均一的澄清体系.
1.3.2 CTAB反胶束体系中脂肪酶催化反应单因素反应及正交试验
反应条件:向上述反胶束体系中先加入己酸,再加入乙醇,置于恒温振荡器上,反应温度35℃,反应时间为24 h,摇床转速选为150 r/min[13].
单因素及正交试验:首先进行反应温度、乙醇和己酸的物质的量比、酶浓度、己酸浓度的单因素试验,然后进行四因素三水平正交试验.反应结束测定己酸的转化率,并得出最佳试验条件.
1.3.3 己酸转化率的测定:NaOH滴定法.
移取1 mL反应液于50 mL锥形瓶中,加入10 mL 95%的酒精终止反应,再滴加两滴酚酞指示剂,用NaOH溶液滴定至微红色,15 s不褪色为止,记下消耗的NaOH溶液体积V0.同时,取未反应的混合液进行空白试验,测得消耗的NaOH溶液体积V.

1.3.4 气相色谱检测方法的建立
1.3.4.1 气相色谱分析条件
SE-30毛细管柱(15m×0.25mm,0.25 μm);检测器(采用GC-2010FID氢焰检测器)温度,180℃;汽化室温度,140℃;柱温,120℃;载气,氮气(纯度99.99%);分流比:不分流.
1.3.4.2 定量、定性方法
峰面积外标法定量,出峰时间定性[14].
1.3.4.3 标准曲线的绘制及线性范围的确定[15]
对己酸乙酯色谱纯标样进样,进样量分别为0.1~1.0 μL.以峰面积为横坐标,己酸乙酯标样含量为纵坐标,绘制标准曲线.以峰面积(Y)为响应值,与己酸乙酯标样含量(X)进行回归,得到标准曲线回归方程[16].将供试品峰面积带入回归方程,计算己酸乙酯产物含量.
1.3.4.4 气相色谱检测方法的验证
精密度试验:用己酸乙酯色谱纯标样进样0.2 μL,连续进样8次[17].根据峰面积计算相对标准偏差.
回收率试验:用己酸乙酯色谱纯分别进样五组0.1、0.2、0.3、0.4、0.5、0.6 μL,每组进样3次做平行试验.以己酸乙酯标样理论值为参比值,计算回收率.
1.3.5 气相色谱检测
将已处理的转化液进样0.5 μL,再进样己酸乙酯标样(0.5 μL)和转化液(0.5 μL)的混合物,根据二者峰的变化定性确定转化液中己酸乙酯的峰的位置,通过标准曲线,已知峰面积,确定产物含量.
2 结果与分析
2.1 单因素试验结果
2.1.1 温度对己酸转化率的影响
添加质量浓度为0.003 g/L的脂肪酶,己酸浓度为0.3 mol/L,己酸和乙醇的物质的量比为1∶1,研究脂肪酶在不同温度条件下,摇床转速为150 r/min条件下24 h时反应.结果见图1.
由图1可知,随着温度升高,己酸乙酯的转化率先增加后下降,当温度为35℃时,转化率最高,可见,脂肪酶在此温度下活性最高,最有利于其催化反应,超过该温度,酶的活性下降,反应速度下降,产物产量下降.因此单因素温度结果为35℃.
2.1.2 己酸浓度对己酸转化率的影响
添加质量浓度0.003 g/L的脂肪酶,己酸和乙醇的物质的量比为1∶1,研究脂肪酶在不同己酸浓度,摇床转速为150 r/min条件下,35℃,24 h时反应.结果见图2.
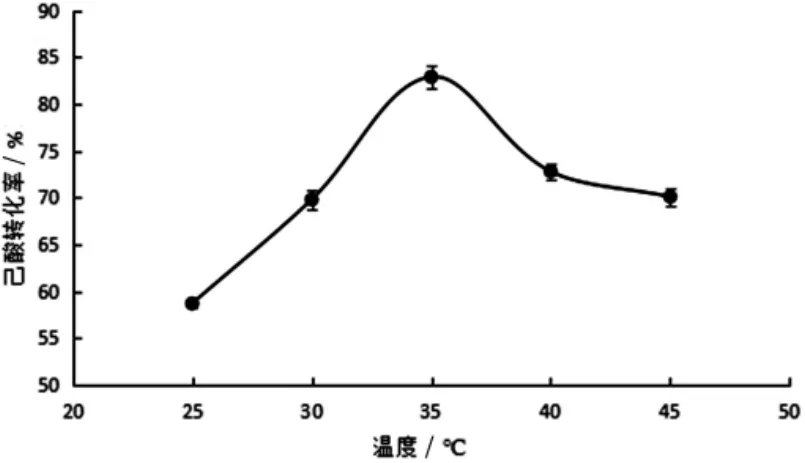
图1 温度对己酸乙酯转化率的影响

图2 己酸浓度对己酸转化率的影响
由图2可知,随着己酸浓度增加,己酸转化率先增加后降低,当己酸浓度为0.4 mol/L时,己酸转化率达到最高.分析可能的原因是,当己酸浓度较低时,随着浓度增加,反应速度增加,产物产量增加,当己酸浓度继续增加后,可能是由于浓度高抑制了脂肪酶的活性,导致反应速度降低,因而产物产量降低,即己酸转化率降低.因此单因素己酸浓度选择0.4 mol/L.
2.1.3 醇酸比对己酸转化率的影响
添加0.003 g/L的脂肪酶,己酸浓度为0.4 mol/L,研究脂肪酶在不同醇酸比(0.8∶1,0.9∶1,1∶1,1.1∶1,1.2∶1),摇床转速为150 r/min条件下,35℃,24 h时反应.结果见图3.
随着醇酸比的增加,己酸转化率呈现先升高后降低趋势.分析可知,反应初始由于乙醇浓度较低,体系中反应速度慢,因此己酸转化率较低,随着乙醇浓度的增加,反应速度加快,己酸转化率升高;当乙醇浓度继续增加,乙醇浓度过高,剩余的乙醇抑制反应,导致体系中反应速度减缓,因而己酸转化率随之降低.
2.1.4 酶浓度对己酸转化率的影响
醇酸比为1∶1.1,己酸浓度为0.4 mol/L,研究脂肪酶在不同浓度下,摇床转速为150 r/min条件下,35℃,24 h时反应.结果见图4.

图3 醇酸物质的量比对己酸转化率的影响

图4 酶浓度对己酸转化率的影响
由图4可知,随着酶浓度的增加,己酸转化率先增加后降低,在酶质量浓度为0.003 g/L时之前,反应速度增加,是由于反应底物充足,随着酶浓度增加,反应速度也增加,产物产量增加.随后,反应速度缓慢,分析可能由于酶相当于底物是充足的,反应速度降低.因此单因素酶质量浓度选择0.003 g/L.
2.2 正交试验优化结果
选取四因素三水平的正交试验表,确定每个因素的水平.然后按照正交试验表进行正交试验,每个条件做两个平行.反应结束后取样,终止反应测定己酸转化率.正交试验条件和结果如表1和表2所示.
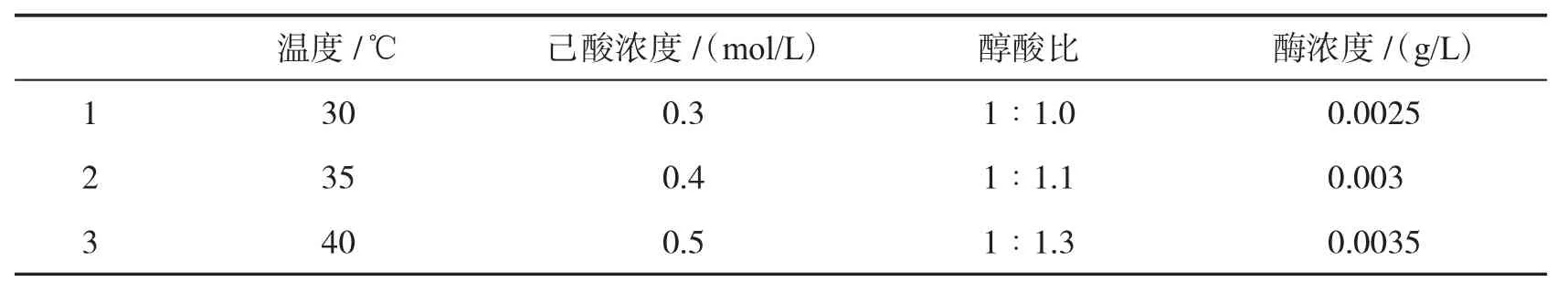
表1 正交试验因素水平表
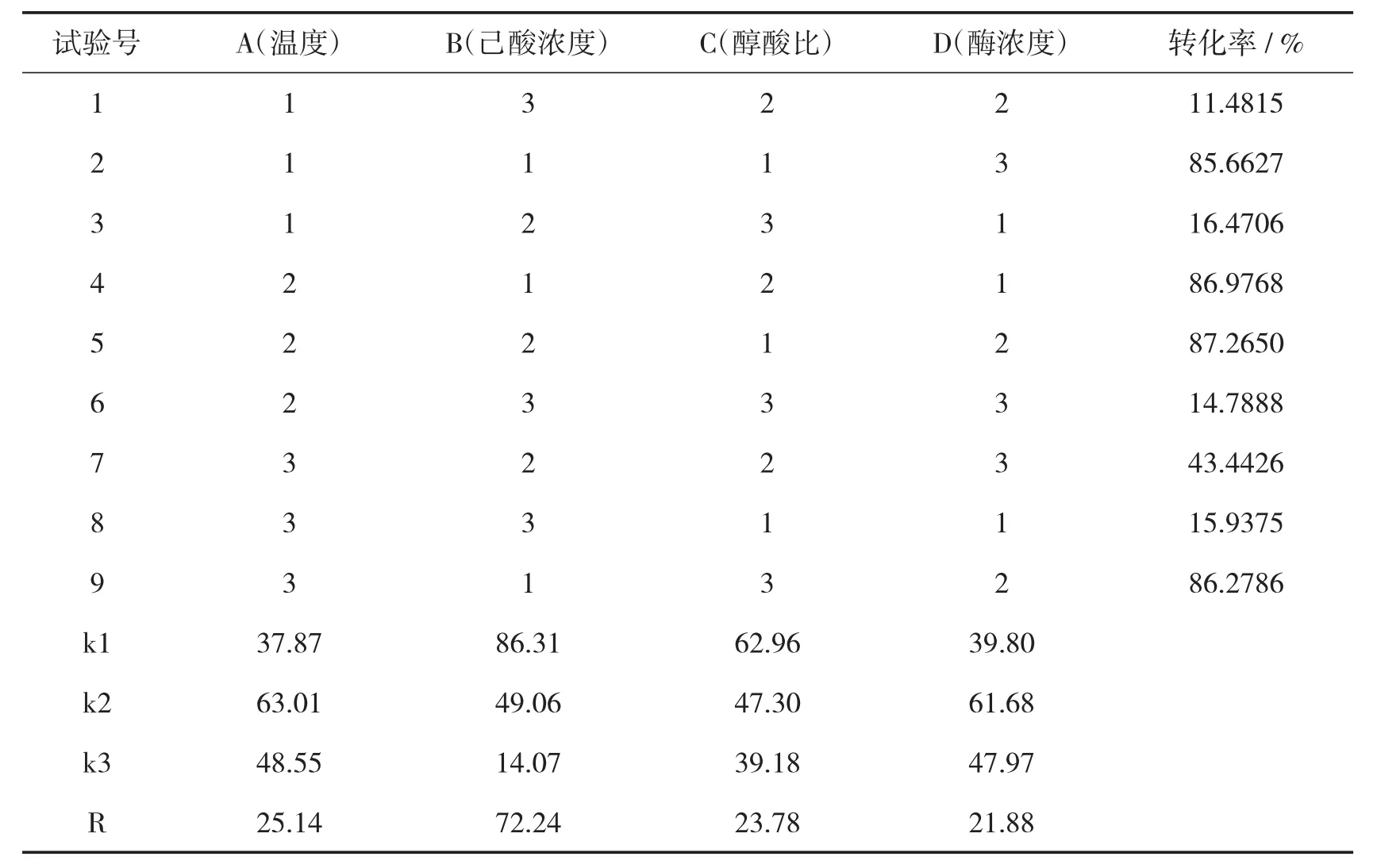
表2 L9(34)正交试验结果
用SPSS软件处理正交试验的结果,处理结果如表3所示.

表3 正交试验方差分析表
由正交试验结果可知,4个变量对己酸乙酯的转化率都有影响,分析表2可得,影响因素排序:B>A>C>D,即酸浓度>温度>醇酸比>酶浓度,分析表3可知,最佳反应条件为:A2B1C1D2,即反应温度为35℃,醇酸比为1∶1,酸浓度为0.03 mol/L,酶质量浓度为0.003 g/L.
按照反应的最佳条件,测定随着时间变化,己酸转化率变化,如图5所示.

图5 己酸转化率图
随着反应时间增加,己酸的转化率呈增大趋势,当在第16 h,己酸的转化率达到最大,之后处于稳定状态.因此本条件能够在短时间内使己酸达到较高的转化率.
陈利梅等[18]研究了反胶束中黑曲霉脂肪酶催化合成己酸乙酯,并得出最优条件和时间曲线.结果发现,随着反应时间的延长,反应转化率逐渐增加.但是随后略有降低.与本实验相似,可能是由于随着时间延长,酶的活力降低造成的.
2.3 己酸乙酯色谱峰的确定
试验选取己酸乙酯色谱纯进样,得出己酸乙酯色谱峰的位置,如图6所示,2~3 min之间的峰1即为己酸乙酯.

图6 气相色谱检测己酸乙酯标样谱图
2.4 标准曲线和线性范围的确定[19]
对系列浓度为0.1~1.0 μL的己酸乙酯标准溶液进行分析,以峰面积为横坐标,己酸乙酯标样含量为纵坐标,绘制标准曲线及其线性方程、相关系数,见图7.
试验表明,R2=0.990 9,说明在0.1~1.0 μL范围内呈良好的线性关系,该标准曲线可以用于定量分析.

图7 气相色谱检测己酸乙酯标样标准曲线
2.5 精密度试验[20]
试验选取己酸乙酯标样0.2 μL,在本试验选定的条件下,进行8次平行测定.精密度试验结果如表4所示,相对标准偏差2.98%.
结果表明该方法具有较好的重现性,是稳定可靠的,能满足检测要求.

表4 方法精密度试验结果 (n=8)
用己酸乙酯色谱纯分别进样五组0.1、0.2、0.3、0.4、0.5、0.6 μL,每组进样3次做平行试验.测定结果如表5所示.
经计算平均值和相对标准偏差,得出该方法回收率在87.47%~95.76%,能满足试验对准确性的要求.并且随着标准品进样量的增加,方法回收率会相应减小,可能是由于随着进样量的增加,标样中的杂质相应增加或标样被污染.
2.7 反应液中己酸乙酯峰定性,定量检测[22]
试验检测产物时,进样后所得谱图见图8.根据己酸乙酯的峰位置,图8中峰2为己酸乙酯,并由标准曲线和转化液中己酸乙酯的峰面积求出其含量.
试验表明,此方法可以较好的定性、定量测定转化液中的己酸乙酯的含量.

表5 方法回收率试验结果

图8 气相色谱检测转化液中的己酸乙酯谱图
3 结论
本试验利用猪胰酶对反胶束体系中己酸乙酯进行催化合成,采用正交试验得出最佳转化条件为:温度为35℃,酶质量浓度为0.003 g/L,己酸浓度为0.3 mol/L,醇酸比为1∶1.随后利用气相色谱法检测反胶束中合成的己酸乙酯,并对己酸乙酯标准物质从标准曲线、线性范围、回收率、精密度等方面进行了分析研究.试验表明,己酸乙酯标样含量在0.1~1.0 μL范围内呈良好线性关系,相关系数为0.990 9,相对标准偏差为2.98%,回收率在87.47%~95.76%范围之间.结果表明该方法快速、简便、灵敏,能够达到检测要求.试验结果表明,该方法用于反胶束体系中脂肪酶催化合成己酸乙酯的定性和定量分析,结果比较满意,能达到转化液中己酸乙酯的实验室检测要求.
