血清6型流行性出血病病毒在我国云南的首次分离与鉴定
2020-01-17杨振兴寇美玲李占鸿廖德芳朱建波李华春
杨振兴,寇美玲,李占鸿,廖德芳,肖 雷,朱建波,高 林,李华春,杨 恒
(云南省畜牧兽医科学院云南省热带亚热带动物病毒病重点实验室,云南昆明650224)
流行性出血病(Epizootic haemorrhagic disease,EHD)是由EHD 病毒(EHDV)感染反刍动物引起的一种虫媒病毒病。EHDV 通过库蠓叮咬反刍动物进行传播,可感染包括黄牛、水牛、绵羊、山羊、鹿以及美洲羊驼在内的多种反刍动物[1]。该病对鹿和牛的危害最为严重,临床症状主要表现为发热、口腔溃烂出血、呼吸道疾病和组织器官坏死,妊娠期母牛出现早产、流产,奶牛产奶量急剧减少[2-3]。EHD主要流行于北纬49 度至南纬35 度之间的热带、亚热带及温带地区,疫病的暴发给畜牧业带来严重的经济损失,阻碍了畜产品的正常国际贸易,世界动物卫生组织(OIE)将该病列为法定报告的动物疫病[4]。
EHDV 为呼肠孤病毒科(Reoviridae)环状病毒属(Orbivirus)成员,基因组约 20 kb,由 10 个节段(Seg-1~Seg-10)双链RNA 组成,可编码7 种结构蛋白(VP1~VP7)和 4 种非结构蛋白(NS1、NS2、NS3、NS3a)[5]。病毒的外层衣壳蛋白VP2 由基因节段Seg-2 编码,Seg-2/VP2 序列具有高度的遗传多样性。VP2 蛋白主要介导病毒对细胞表面受体的特异性吸附,参与病毒粒子从感染细胞中的释放,诱导感染动物产生EHDV 特异性中和抗体,决定着病毒的血清型[6]。病毒内层衣壳蛋白VP3 由基因节段Seg-3编码,尽管VP3 高度保守,但其编码基因Seg-3 在不同地域分离的病毒株间却存在一定差异,可据此将EHDV 分为东方(Eastern)型与西方(Western)型两种地域型(Topotype)以及多种地域亚型(Sub-topotype)[7]。
目前世界范围共发现9 种血清型EHDV(EHDV-1、EHDV-2、EHDV-4~EHDV-10)。早期分离的EHDV-3型(NIG/1967-1 株)通过 Seg-2 基因测序,确认为EHDV-1 型,EHDV-9 型于2013 年从南非羊驼中分离(GenBank 中尚无该病毒株的序列报道),EHDV-10 型首次在日本发现[8]。本研究团队前期在全国范围进行EHDV 的血清学调查,发现我国存在多种血清型EHDV:广西主要存在EHDV-5~EHDV-8 的流行,并分离到EHDV-5 型病毒株;广东有EHDV-1与EHDV-5 型的流行,分离到EHDV-1 型病毒株;内蒙古则存在EHDV-6 型的流行,但未分离到病毒;云南主要有EHDV-1、EHDV-5、EHDV-6、EHDV-7、EHDV-10 的流行,并分离到 EHDV-1、EHDV-5、EHDV-7 和EHDV-10 型病毒株[9-12]。值得注意的是,在我国的南方与北方地区均检测到EHDV-6 型特异性中和抗体,提示该血清型病毒在我国广泛流行。
EHDV-6 型呈世界范围分布:亚洲的日本,中东地区的土耳其、以色列与巴林,大洋洲的澳大利亚,北美洲的美国,非洲的南非、突尼斯、阿尔及利亚、摩洛哥,加勒比海的Martinique Island、Guadeloupe Island (法国海外省),印度洋西部的Reunion Island(法国海外省)均有EHDV-6 型的分离报道[13-14]。我国虽然在广西、内蒙古与云南的哨兵动物监测到EHDV-6 型的特异性中和抗体,但目前国内尚无EHDV-6 型的分离报道。本研究首次报道了EHDV-6 型在我国云南省的分离与鉴定,为我国开展EHDV 遗传特性、致病性和病原检测等方面奠定了研究基础。
1 材料与方法
1.1 主要实验材料 磁珠法病毒RNA 抽提试剂盒、新生牛血清和MEM 培养基均购自Thermo 公司;荧光定量试剂盒购自NEB 公司;病毒RNA/DNA 提取试剂盒、DNA 胶回收试剂盒、PrimeScritp 逆转录酶、ExTaqDNA 聚合酶、pMD19-T 载体、E.coliDH5α 感受态细胞均购自 TaKaRa 公司。BHK-21 细胞(仓鼠肾细胞)由本实验保存;EHDV-1、EHDV-2、EHDV-5~EHDV-8 型参考病毒由澳大利亚麦克阿瑟·伊丽莎白农业研究所提供;上述参考病毒的阳性血清,由本实验室采用纯化灭活处理后的各血清型EHDV 参考病毒免疫日本大耳兔制备,血清中和抗体效价分别为:1∶453(EHDV-1)、1∶320(EHDV-2)、1∶226 (EHDV-5)、1∶453(EHDV-6)、1∶320 (EHDV-7)和 1∶640 (EHDV-8)。
1.2 监控群的建立及血液样品的采集 根据本团队前期对牛羊虫媒病毒血清学调查结果,本研究在云南省师宗县(经度:E104°17',N24°36',海拔 940 m)设立牛羊虫媒病毒监控点,采用放养的方式设置EHDV 血清抗体和核酸检测均为阴性的10 头牛与5头山羊作为哨兵动物。每年5 月~12 月定期采集哨兵动物肝素钠、EDTA 抗凝血和全血样品于4 ℃冰盒保存,2012 年共采集上述样品1 078 份,由本实验室进行虫媒病毒的检测与病毒分离工作。
1.3 引物设计与合成 根据GenBank 中登录的EHDV 株序列(LC320035、LC320036),利用 Oligo 7.0 软件设计2 对引物分别用于扩增EHDV-6 型病毒Seg-2 与Seg-3 基因序列(表1),引物由上海捷瑞公司合成。
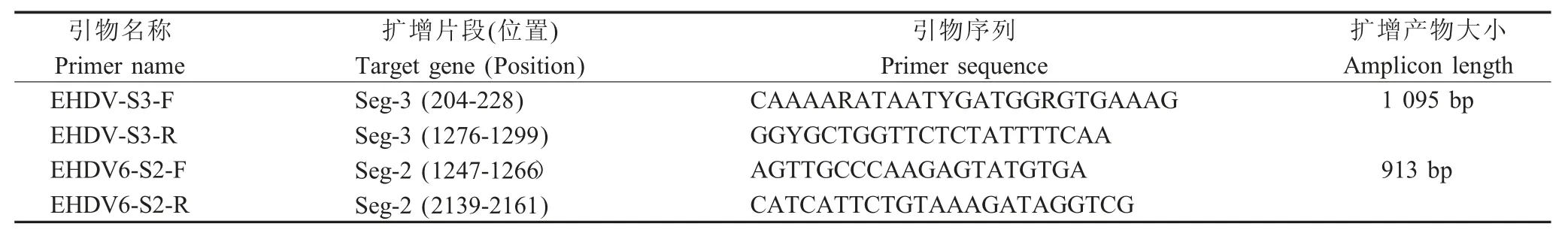
表1 EHDV-6 型Seg-2 与Seg-3 基因扩增引物信息Table 1 Primer information of Seg-2 and Seg-3 of EHDV-6
1.4 EHDV 抗体和核酸的检测 利用本实验室制备的EHDV 群特异性竞争ELISA (C-ELISA)抗体检测试剂盒[15],对监控点采集的哨兵动物血清样品进行EHDV 群特异性抗体检测;利用磁珠法病毒RNA 抽提试剂盒提取哨兵动物EDTA 抗凝血样品的核酸,采用本实验室建立的虫媒病毒高通量qRT-PCR 方法[16]检测EHDV 的核酸。
1.5 病毒的分离与鉴定 对qRT-PCR 检测为EHDV阳性的血液样本(Ct 值<38)进行病毒分离:取1 mL肝素钠抗凝血离心并收集红细胞(RBCs),洗涤RBCs 2 次,加入灭菌水震荡充分裂解RBCs 后接种于生长为单层的BHK-21 细胞,并连续盲传4 代以上,提取第4 代出现CPE 细胞的核酸,进行EHDV的群特异性qRT-PCR 检测[16]。
1.6 病毒粒子观察 将1.5 分离到的病毒接种BHK-21 细胞扩大培养,待其出现60 %~70 % CPE后刮下细胞,8 ℃3 500 r/min 离心30 min 弃上清,沉淀用PBS 悬浮后,超声波处理3 次,12 000 r/min离心2 min,取上清液滴加在覆有Formver 膜的铜网上,约3 min 后,将铜网放入2 %磷钨酸(pH7.2)中负染5 min,室温风干后经透射电镜观察病毒粒子结构特征。
1.7 哨兵动物血清中和抗体效价的测定 采用Karber 法测定分离病毒的TCID50,并进行血清中和试验:1.取2 号哨兵牛EHDV 抗体阳转前后共5 周(8 月 11 日、8 月 25 日、9 月 1 日、9 月 8 日和 9 月15 日)血清与分离病毒进行中和试验;2.取实验室制备的6 种血清型EHDV 阳性血清与分离病毒进行中和试验。试验方法如下:将血清10 倍倍比稀释后加入细胞培养板(50 μL/ 孔),加入 100 TICD50的病毒悬液(50 μL/孔),充分混匀后 37 ℃ 5 % CO2条件下孵育 1 h,加入 BHK-21 细胞悬液(100 μL/孔),37 ℃5 % CO2条件下培养7 d。逐日观察CPE,初步判定分离病毒的血清型(抗体效价<1:16 判定为阴性,1∶16≤抗体效价 <1∶45 判定为可疑,抗体效价≥1∶45 判定为阳性)。若待检病毒被某型阳性血清中和,则使用该血清型的标准参考病毒与分离到该病毒的动物血清再次进行中和试验,并计算血清中和抗体效价。
1.8 分离病毒Seg-2 与Seg-3 基因的PCR 扩增与序列分析 使用病毒RNA/DNA 提取试剂盒提取培养第4 代病毒的核酸,将其反转录为cDNA,以其为模板,使用(表1)中的引物分别进行EHDV Seg-2与Seg-3 基因的PCR 扩增。同时以BHK-21 细胞核酸为阴性对照,澳大利亚EHDV-6 型(HEDV-6/AUS,AM74508E)病毒株核酸为阳性对照, PCR 产物回收纯化后克隆至pMD19-T 载体,转化后,将PCR 鉴定结果为阳性的菌落经测序鉴定。使用MEGA 6.0软件[17]对测序结果经序列比对分析,并采用邻近法(Neighbor-joining,NJ)构建 Seg-2 与 Seg-3 基因的系统发育树。
1.9 哨兵牛的EHDV 抗体水平和病毒核酸检测取被EHDV 感染的2 号哨兵牛5 月~12 月每周采集的血液样本,分别提取核酸和分离血清后进行EHDV的群特异性 qRT-PCR 检测[16]和抗体 C-ELISA 检测[15],分析该病毒株在宿主动物体内的感染特性。
2 结 果
2.1 病毒分离鉴定结果 采用EHDV 群特异性qRT-PCR 和C-ELISA 对师宗监控点采集的哨兵动物血液和血清样品进行检测,结果显示8 月25 日采集的2 号哨兵牛血液的EHDV 核酸呈阳性和血清抗体阳转(血清抗体抑制率为65.27 %),表明该动物感染了EHDV。取其抗凝血接种BHK-21 细胞盲传4 代,细胞在接种3 d 后开始出现部分变圆并皱缩,6 d 后基本全部变圆脱落崩解。提取病变细胞核酸进行EHDV qRT-PCR 检测,结果显示EHDV 核酸拷贝数为2.67×108拷贝/μL,表明从2 号哨兵牛血液中分离出EHDV,并命名为YNSZ/V003/2012。
2.2 病毒形态的电镜观察结果 将经BHK-21 细胞扩大培养的病毒株YNSZ/V003/2012 处理后经透射电镜观察,结果显示病毒形态呈球形,无囊膜,直径60 nm~80 nm,可以清晰观察到病毒衣壳表面分布着大量纤维状突起,与文献报道的环状病毒属病毒形态特征一致(图1),表明分离的病毒粒子形态完整,并再一次证明分离到了EHDV。

图1 YNSZ/V003/2012 的透射电镜观察Fig.1 Negative staining electron microscopy observation of YNSZ/V003/2012 virions
2.3 哨兵动物血清中和抗体效价的测定结果 经Karber 法测定分离病毒YNSZ/V003/2012 株的TCID50为106.3/mL。取2 号哨兵牛EHDV 抗体阳转前后共5周的血清样本与分离的病毒进行血清中和试验,结果显示 8 月 11 日、8 月 25 日、9 月 1 日、9 月 8 日和 9 月 15 日其抗体效价分别为≤1∶7、1∶28、1∶80、1∶160 和 1∶226,表明哨兵牛产生了针对 YNSZ/V003/2012 株的特异性中和抗体,且抗体水平随着时间的推移逐步升高,因此可确认YNSZ/V003/2012 株感染了2 号哨兵牛。
取不同血清型的EHDV 阳性血清与100 TCID50的YNSZ/V003/2012 株病毒进行中和试验,结果显示EHDV-1、EHDV-2、EHDV-5、EHDV-7 与 EHDV-8型阳性血清对病毒均无中和作用,而EHDV-6 型阳性血清对病毒的中和效价为1:160 (表2),表明分离的病毒为EHDV-6 型。取2 号哨兵牛8 月11 日、9月 8 日和 9 月 15 日血清,以 100 TCID50的 EHDV-6/AUS 进行血清中和试验,结果显示该哨兵动物的血清对 EHDV-6/AUS 株的中和效价分别为≤1∶7、1∶113和1∶160,进一步表明2 号哨兵牛产生了针对EHDV-6型的特异性中和抗体。

表2 哨兵牛感染EHDV 血清型的中和试验结果Table 2 Serotype neutralization test results of the sentinel infected with EHDV
2.4 分离病毒Seg-2 与Seg-3 基因的PCR 扩增与序列分析结果 以分离病毒的cDNA 为模板,对病毒 Seg-2 和 Seg-3 基因进行 RT-PCR 扩增。结果显示,扩增出大小分别约为900 bp 和1 000 bp,与预期相符(图2)。经测序和BLAST 分析比对,表明正确克隆了YNSZ/V003/2012 病毒株的 Seg-2 与 Seg-3基因。
2.5 分离病毒Seg-2 序列与系统发生树分析结果分离病毒Seg-2 基因序列的系统发生树显示,病毒株YNSZ/V003/2012 与日本病毒株[3](LC320035_EHDV6_Japan_2015)的地域型同属东方型,并形成一个独立的进化分支(图3),其Seg-2 基因序列和VP2 氨基酸序列与日本病毒株的相似度分别为99.2%和99.4 %。病毒株YNSZ/V003/2012 与其它EHDV-6型东方型病毒株基因序列相似度在88.6 %~89.6 %之间,氨基酸序列相似度在92.7 %~93.8 %之间,表明YNSZ/V003/2012 株与日本EHDV-6 型病毒株的Seg-2/VP2 亲缘关系最近。
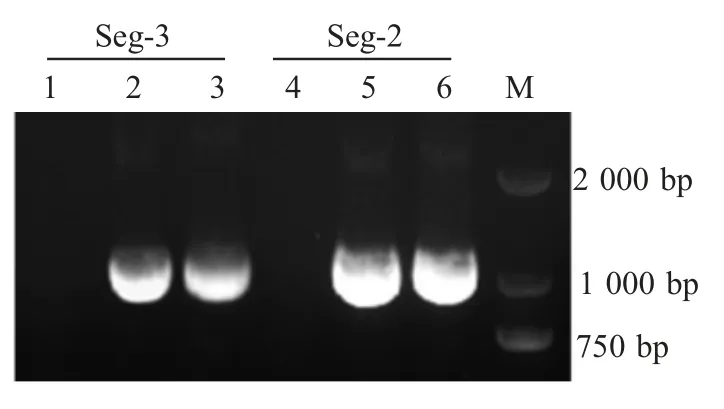
图2 YNSZ/V003/2012 株 Seg-2 与 Seg-3 基因的RT-PCR 扩增结果Fig.2 Amplication of Seg-2 and Seg-3 of YNSZ/V003/2012 isolate by RT-PCR
图3 YNSZ/V003/2012 病毒株Seg-2 基因系统发生树图Fig.3 Phylogenetic alnalysis of Seg-2 gene of YNSZ/V003/2012 isolate
2.6 分离病毒Seg-3 序列与系统发生树分析结果分离病毒Seg-3 序列的系统发生树显示,与Seg-2 系统发生树一致,病毒株YNSZ/V003/2012 与日本EHDV-6 病毒株的Seg-3 聚为一簇,二者Seg-3 基因与氨基酸序列相似度分别为98.9 %与99.8 %;与EHDV 其它东方型病毒株基因序列相度为92.2 %~96.2 %,氨基酸序列相似度为99.4 %~99.8 %;与EHDV 西方型病毒株的基因序列相似度为79.8 %~80.4 %,氨基酸序列相似度为96.2 %~96.7 % (图4)。上述结果进一步表明YNSZ/V003/2012 与日本EHDV-6 病毒株亲缘关系最近。

图4 YNSZ/V003/2012 株Seg-3 基因系统发生树图Fig.4 Phylogenetic analysis of Seg-3 gene of YNSZ/V003/2012 isolate
2.7 哨兵牛EHDV 抗体和核酸检测结果 为明确病毒株YNSZ/V003/2012 的感染特性,分别采用C-ELISA 和 qRT-PCR 方法对 2 号哨兵牛 5 月~12 月采集血液中的血清抗体与病毒核酸进行监测。C-ELISA 结果显示8 月25 日该哨兵牛EHDV 抗体阳转,血清抗体抑制率从感染病毒前一周(8 月11 日)的27.25 %升高至65.27 %,随后血清抗体抑制率继续升高,在9 月8 日达到82.8%,以后均维持在80%以上。qRT-PCR 检测结果显示,在动物血清抗体阳转的8 月25 日,血液样品中检测到EHDV 核酸,并且核酸含量最高(Ct 值最低为29.9),随后的7 周,血液中病毒含量持续减少(Ct 值逐渐升高),7 周后血液样品核酸Ct 值大于38 并判定为阴性(图5)。表明病毒株YNSZ/V003/2012 感染动物后病毒能够在短时间内快速复制增殖,随后动物体内抗体水平迅速升高,抑制病毒增殖的能力增强,病毒含量逐渐减少直至检测不到。
3 讨 论

图5 哨兵牛血清EHDV 抗体C-ELISA 和血液qRT-PCR检测结果Fig.5 The results of EHDV C-ELISA of serum and qRT-PCR of blood in sentinel cattle
本研究从云南师宗分离到一株牛源EHDV 株,命名为 YNSZ/V003/2012, 对其进行群特异性RT-PCR 检测,病毒粒子电镜观察,血清中和试验及Seg-2 与Seg-3 序列分析,确定分离到的病毒株为EHDV-6 型,为云南首次报道的EHDV-6 型病毒株。云南省属低纬度高原地区,地理位置特殊,地况地貌复杂,气候类型丰富多样,具有适合各类吸血节肢动物生存繁殖的环境条件,有利于虫媒病毒在媒介昆虫和动物宿主之间的传播循环,因此虫媒病毒种类众多[18-19]。本实验室在云南分离到了EHDV-1、EHDV-5、EHDV-7、EHDV-10 等血清型病毒株[12],但EHDV-6 型尚属首次分离,表明我国云南省流行EHDV 的多样性。EHDV-6 型病毒在以色列、土耳其和巴林等中东地区曾多次引起疫病暴发和流行[13],特别是2015 年其在日本牛群中引起了疫病的暴发[3],这提示我国很可能也面临EHDV-6 型引起的疫病威胁。因此为更好的保护我国畜牧业的健康发展,今后还需加强对我国EHDV-6 型的监测,进一步掌握该血清型病毒在我国的分布和遗传特征,为疫病的防控提供科学依据。
由于EHDV 不同血清型病毒株之间缺乏有效的交叉免疫保护,所以掌握某一地区流行EHDV 的血清型与遗传背景,分析病毒可能的来源,对EHD 防控措施具有重要的指导意义。通过对分离的YNSZ/V003/2012 病毒株Seg-2、Seg-3 序列比对和进化分析,显示不同血清型EHDV 分布在A~D 4 个群[6],目前世界范围内分离的EHDV-6 型病毒株均分布在B 群,并可分为东方型与西方型两种地域型。中国、日本、澳大利亚、美国与法国的海外行政区(瓜德罗普岛与马提尼克岛)分离的EHDV-6 型病毒株均属东方型。
该分离病毒株的Seg-2/VP2 和Seg-3/VP3 序列与日本EHDV-6 型病毒株的亲缘关系最近,基因与氨基酸序列相似度分别高达99.2 %/99.4 %和98.9 %/99.8 %,表明二者可能在进化上有着最近的共有祖先。云南和日本在地理位置上相距十分遥远,为什么我国云南省与日本分离的EHDV-6 型病毒株显示如此近的亲缘关系,尚待进一步研究。本研究在下一步的工作中将完成我国EHDV-6 型病毒株的全基因组测序工作,进而在全基因组层面分析中国与日本EHDV-6 型病毒株之间的关系。
本研究对 2 号哨兵牛 2012 年 5 月~12 月的EHDV-6 型感染情况进行了动态监测,将2 号哨兵牛全年的 EHDV 阳性核酸抗凝血(8 份)均接种BHK-21 细胞,但仅8 月25 日的血液样品分离到病毒。推测病毒株YNSZ/V003/2012 感染动物后,血清中抗体水平迅速升高,抗体与病毒结合抑制了血液中病毒对BHK-21 细胞的感染所致。该结果提示选择好病毒分离时间点对病毒的成功分离非常重要。对2 号哨兵牛血液中EHDV 核酸动态检测结果显示,YNSZ/V003/2012 病毒感染动物后,动物血液中的病毒核酸含量随时间推移快速降低,在感染7 周后已经完全检测不到EHDV 核酸,表明病毒在牛体内呈现一过性感染,也可能部分解释了该病毒株未能引起哨兵牛出现临床症状的原因。本研究结果为进一步开展YNSZ/V003/2012 病毒株的流行病学调查与致病性等提供了参考依据。
