利用CRISPR/Cas9技术构建OAS2敲除的PK-15细胞系及敲除OAS2对CSFV复制的影响
2020-01-17张越秀张华伟李连峰仇华吉
张越秀,张华伟,李连峰,仇华吉
(中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室,黑龙江哈尔滨150069)
猪瘟(Classical swine fever,CSF)是由 CSF 病毒(CSFV)引起的一种严重危害养猪业的烈性动物传染病。天然免疫系统是机体抵抗外来病原感染的第一道防线,其中干扰素(IFN)和干扰素刺激基因(ISGs)在宿主抗病毒防御中发挥关键作用[1]。CSFV 感染宿主后,激活I 型IFN (IFN-I)信号通路,引起下游ISGs 的转录表达,进而发挥抗CSFV 作用。
2'-5' 寡腺苷酸合成酶(OAS)家族成员是IFN 诱导产生的抗病毒蛋白,IFN-I 和IFN-Ⅱ均能够诱导机体产生OAS 家族蛋白。猪源OAS 家族包括3 个成员:OAS1、OAS2 和OASL。OAS 家族包含保守的2'-5' 寡腺苷酸(2-5A)合成酶合成域(OAS)单元,其中OAS2 含有2 个OAS 单元。OAS2 抑制猪繁殖与呼吸综合征病毒和日本脑炎病毒的复制[2-3];其抗病毒功能主要是利用ATP 催化合成2-5A,随后2-5A 激活核糖核酸内切酶(RNase L),活化的RNase L 降解胞内的病毒RNA 和细胞RNA,从而导致病毒感染过程中宿主细胞内蛋白的合成受到抑制,病毒的增殖随之受到抑制[4-5]。本实验室前期利用表达萤火虫荧光素酶的报告病毒感染过表达猪源ISGs 的PK-15 细胞系,筛选到猪源OAS 家族成员OAS1 和OASL,并且它们具有抗CSFV 的作用[6],后续研究中,本实验室进一步探究猪源同家族成员OAS2 对CSFV 复制的影响。
CRISPR(Clustered regularly interspaced short palindromic repeats)/Cas(CRISPR-associated)是一种由RNA指导Cas 核酸酶对靶向基因进行特定DNA 修饰的技术,即通过人工优化的具有引导作用的单链RNA(Guide RNA,gRNA)引导核酸酶Cas 蛋白在与 gRNA 配对的靶位点处剪切双链DNA,引起DNA 双链断裂,进而利用生物体内非同源末端修复机制或同源重组机制修复DNA,导致基因移码突变、替换或删除,致使基因功能丧失[7]。本研究利用CRISPR/Cas9 技术获得OAS2基因敲除的猪肾(PK-15)细胞系,并利用该敲除细胞系研究敲除OAS2 对CSFV 复制的影响,为进一步阐明OAS2 抗CSFV 复制的作用机理奠定基础。
1 材料与方法
1.1 主要实验材料 人胚肾细胞(HEK293T)、PK-15 细胞由本实验室购买并保存;大肠杆菌DH5α感受态细胞购自TaKaRa 公司;慢病毒载体Lenti-CRISPRv2 及辅助质粒 psPAX2、pMD2.G 购自 Addgene 公司;CSFV 石门(Shimen)株 AF092448.2、表达海参荧光素酶(Rluc)的重组报告猪瘟病毒rCSFV-Rluc 由本实验室保存。
限制性内切酶BsmBⅠ、T4 DNA 连接酶购自NEB 公司;TRIzol、AMV 反转录酶、RNA 抑制剂 RRI和 Premix ExTaqTMMix 购自 TaKaRa 公司;X-treme GENE HP DNA 转染试剂购自Roche 公司;质粒小量提取试剂盒、PCR 产物纯化试剂盒、胶回收试剂盒、DNA 提取试剂盒和质粒大提试剂盒购自天根生化科技(北京)有限公司;CCK-8 试剂盒购自Dojindo公司;双荧光素酶报告系统检测试剂盒购自Promega 公司;荧光素酶检测白板购自Corning 公司;BCA 法测定蛋白质浓度试剂盒购自Solarbio 公司;鼠源抗Flag 标签单克隆抗体(MAb)、鼠源抗β-actin MAb 和兔源抗 OAS2 多克隆抗体(PAb)购自Sigma-Aldrich 公司;FITC 标记的山羊抗兔和抗鼠IgG 均购自LI-COR Bioscience 公司;引物由吉林库美有限公司合成。
1.2 LentiCRISPRv2-sgRNA 敲除质粒的构建与鉴定 根据NCBIOAS2基因组(NO:595128)信息,标注外显子。将OAS2基因第1、第2 外显子(Exon)核苷酸序列输入sgRNA 在线设计网站(http://crispr.mit.edu),选择两条脱靶率最低的sgRNA 基因序列,分别命名为:sgRNA-E1 和sgRNA-E2。
按照LentiCRISPRv2 载体信息以及选定的sgRNA 基因序列,设计特异性引物(表1),通过程序性退火将 sgRNA 引物合成双链 DNA;载体 Lenti-CRISPRv2 经BsmBⅠ酶切后回收线性化的载体。用T4 DNA 连接酶将退火后的sgRNA 双链DNA 与线性化的LentiCRISPRv2 在室温连接30 min 获得重组质粒,分别命名为pLentiCRISPRv2-sgRNA-E1 (psgRNA-E1)和 pLentiCRISPRv2-sgRNA-E2 (psgRNA-E2),经测序鉴定正确后用于慢病毒包装。
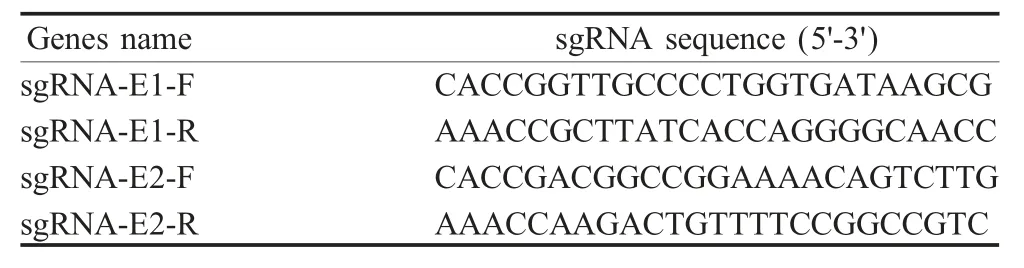
表1 靶向OAS2 基因的sgRNA 序列Table 1 The sequence of sgRNA targeting OAS2 gene
1.3 不同sgRNA 对OAS2基因切割效果的检测将HEK293T 细胞接种于6 孔细胞板中,待细胞汇合度达到80%时转染,分为4 个组:pFlag-OAS2+psgRNA-E1;pFlag-OAS2+psgRNA-E2;pFlag-OAS2+psgRNA-E1+psgRNA-E2 和 pFlag-OAS2+pLentiCRISPRv2(阴性对照)。转染36 h 后,裂解细胞收集蛋白样品,BCA 法测定蛋白浓度后,经SDS-PAGE 凝胶电泳检测Flag-OAS2 蛋白的表达。分别以鼠源抗Flag MAb (1∶1 000 倍)和鼠源抗 β-actin MAb (1∶1 000)为一抗,山羊抗鼠IgG-FITC (1∶10 000)为二抗,western blot 检测sgRNAs 对OAS2 基因的切割效率。同时,采用LI-CO Odyssey 红外影像扫描仪分析蛋白的灰度值。
1.4OAS2基因敲除的PK-15 细胞的制备及筛选将HEK293T 细胞接种于6 孔细胞板中,待细胞汇合度达到80 %时,将 psgRNA-E1、psgRNA-E2 (实验组)分别与辅助质粒 psPAX2 和 pMD2.G 按 2.1 μg、1.4 μg 和 0.7 μg 共转染,同时以 pLentiCRISPRv2(对照组)与辅助质粒psPAX2 和pMD2.G 按照相同方式其转染作为阴性对照。转染48 h 后收集慢病毒备用。将状态良好的PK-15 细胞传代接种于6 孔细胞板中,待细胞汇合度达到80 %时,将慢病毒以MOI 1 的剂量接种PK-15 细胞进行转导,36 h 后,用2.5 μg/mL 的嘌呤霉素(puro)进行压力筛选,经两轮puro 筛选,对照组细胞全部死亡后,将实验组细胞消化成单个细胞,经细胞计数后滴定单克隆,挑取单克隆细胞并扩大培养,细胞系传代后冻存备用。
1.5 PK-OAS2-KO 细胞株OAS2基因及其蛋白敲除的检测 收集单克隆细胞株,编号后按照DNA提取试剂盒说明书提取细胞的基因组DNA。依据sgRNA 靶向的OAS2基因组序列位点,根据其相应外显子两端的内含子基因序列设计特异性鉴定引物(表2),以此为引物,以提取的细胞基因组DNA 为模板,进行PCR 扩增。PCR 产物经测序及序列比对,检测所获单克隆细胞株OAS2基因的敲除效果。
表2 鉴定OAS2 基因敲除的引物序列Table 2 Primer sequence for detecting OAS2 gene knockout
将鉴定为OAS2基因敲除的单克隆细胞株(PK-OAS2-KO)和对照组细胞(PK-Cas9)接种于 6 孔细胞板中,待细胞贴壁后采用1 000 IU/mL IFN-α 刺激12 h,裂解细胞收集蛋白样品,同时设无IFN-α刺激对照。SDS-PAGE 凝胶电泳检测内源性OAS2蛋白的表达水平,以兔源抗OAS2 PAb (1∶500)和鼠源抗β-actin MAb (1∶1 000)为一抗,山羊抗鼠和山羊抗兔 FITC-IgG (1∶10 000)为二抗,western blot 检测OAS2 蛋白的敲除效果。同时以野生型PK-15 细胞做上述处理后作为对照。
1.6 敲除 OAS2 对 CSFV 复制的影响 将 PKOAS2-KO 和 PK-Cas9 细胞计数后,以 1×104个细胞/ 孔接种96 孔板,每种细胞设置5 个重复孔;待细胞汇合度达到80 %时,每孔加入10 μL CCK-8 溶液。37 ℃培养 2 h 后,测定 PK-OAS2-KO 和 PKCas9 细胞的OD450nm值,并计算PK-OAS2-KO 和PKCas9 的细胞活力。
将 MOI 0.01 的 rCSFV-Rluc 感染 PK-OAS2-KO和PK-Cas9 细胞,感染病毒24 h 后,弃掉细胞培养上清,每孔加入100 μL 1 Luc 裂解液,裂解 1 h,吸取细胞裂解产物于1.5 mL EP 管中,离心收集上清备用。荧光素酶检测白板每孔加入30 μL STOP Buffer (海肾荧光素酶检测底物),取30 μL 裂解上清液与底物混匀后,将白板放入多功能聚焦式荧光分析仪中读取荧光值,检测rCSFV-Rluc 的复制水平。
将 MOI 0.01 的 CSFV Shimen 株感染 PK-OAS2-KO 和PK-Cas9 细胞,感染病毒24 h 后,采用TRI-zol 法提取感染细胞的RNA,反转录为cDNA,然后利用本实验室构建的荧光定量PCR (qRT-PCR)方法定量检测细胞中CSFV 基因组拷贝数[8]。
1.7 数据处理 采用SPSS 20.0 软件对所有实验数据进行Student 氏t检验或方差分析。其中,***:p<0.001;**:p<0.01 为差异极显著;NS:p>0.05,没有统计学意义。
2 结 果
2.1 LentiCRISPRv2-sgRNA 敲除质粒的构建与鉴定 将退火获得的sgRNA 双链序列克隆至Lenti-CRISPRv2 载体,构建重组质粒psgRNA-E1 和psgRNA-E2。经测序鉴定表明正确构建了含有sgRNA 的重组质粒,构建模式见图1。
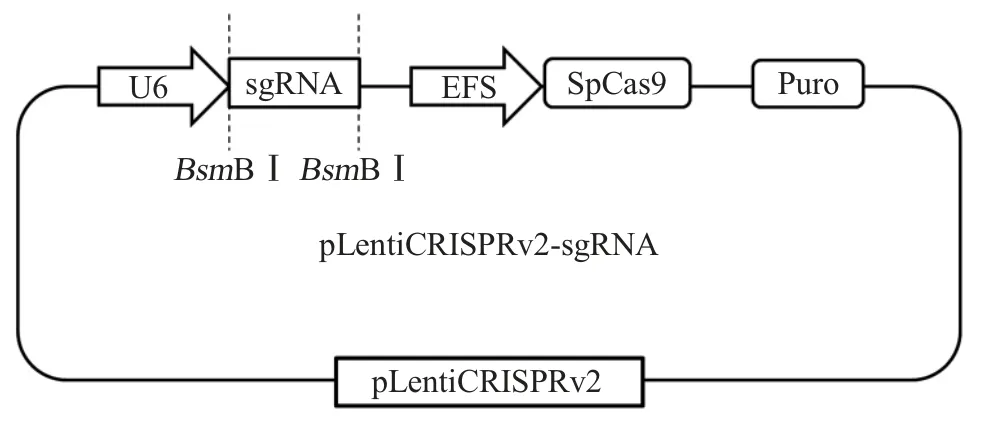
图1 pLentiCRISPRv2-sgRNA 的构建模式图Fig.1 Schematic diagram of the pLentiCRISPRv2-sgRNA
2.2 不同sgRNA 对OAS2基因敲除效果的检测结果 将 pLentiCRISPRv2-sgRNAs 与过表达 OAS2 的真核表达质粒pFlag-OAS2 共转染HEK293T 细胞,经western blot 检测Flag-OAS2 的表达水平并分析蛋白的灰度值。结果显示,sgRNA-E1 和sgRNA-E2 均能够有效地降低OAS2 蛋白表达(图2),表明设计的sgRNA 具有较高的敲除效率。
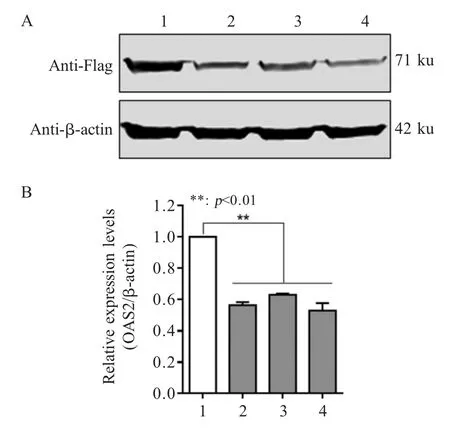
图2 sgRNA 敲除 OAS2 蛋白的 western blot 鉴定结果(A)和灰度值分析(B)Fig.2 Identification of OAS2 knockout efficiency by western blot(A) and grey value analysis (B)
2.3OAS2基因敲除细胞PK-OAS2-KO 的筛选与测序鉴定结果 将pLentiCRISPRv2-sgRNA 与辅助质粒psPAX2 和pMD2.G 共转染HEK293T 细胞获得的慢病毒感染PK-15 细胞,经Puro 加压筛选和有限稀释法最终获得18 株可能敲除OAS2基因的单克隆PK-15 细胞株,提取细胞的基因组DNA,扩增目的片段,测序结果显示得到1 株OAS2基因第2 外显子缺失突变的PK-15 细胞株PK-OAS2-KO。将测序结果比对显示,PK-OAS2-KO 细胞与野生型PK-15细胞相比,在第2 外显子位置有2 bp 碱基的缺失突变(图3),从基因水平表明 PK-OAS2-KO 细胞中OAS2基因发生移码突变。
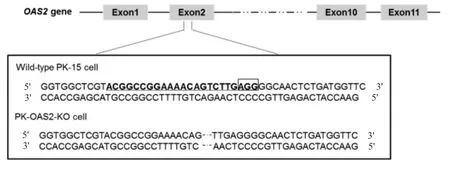
图3 PK-OAS2-KO 细胞中OAS2 基因缺失的测序鉴定结果Fig.3 Sequence identification of OAS2 gene in PK-OAS2-KO cells
2.4OAS2基因敲除细胞PK-OAS2-KO OAS2 蛋白敲除的鉴定结果 收集PK-OAS2-KO、PK-Cas9和PK-15 细胞的蛋白样品,经western blot 检测结果显示,PK-15 细胞中OAS2 蛋白表达丰度高,经IFN-α 刺激后,OAS2 蛋白表达量稍有提高,表明OAS2 是一种ISG 分子;与PK-Cas9 细胞相比,PKOAS2-KO 细胞有无 IFN-α 诱导,OAS2 蛋白均未表达(图4),表明OAS2基因的缺失突变导致OAS2 阅读框的紊乱,使PK-OAS2-KO 细胞不表达OAS2 蛋白。
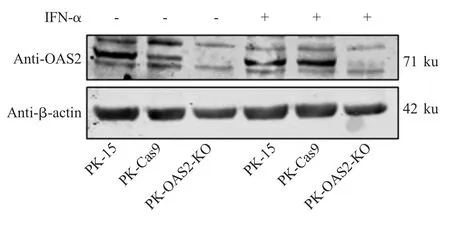
图4 PK-OAS2-KO 细胞中OAS2 蛋白表达水平的检测Fig.4 Detection of OAS2 expression in PK-OAS2-KO cells
2.5 敲除 OAS2 对 CSFV 复制影响的检测结果利用CCK-8 细胞活力检测试剂盒检测PK-OAS2-KO和PK-Cas9 细胞的活性,结果显示两种细胞具有相似的生长活力(图5A)。之后,分别通过荧光素酶活性检测试验和qRT-PCR 检测敲除OAS2 对CSFV 复制的影响,结果显示,与PK-Cas9 对照细胞相比,PK-OAS2-KO 细胞内的海肾荧光素酶活性(p<0.001)(图5B)和病毒基因拷贝数(p<0.01) (图5C)均显著增加,表明敲除OAS2 可促进CSFV 复制。
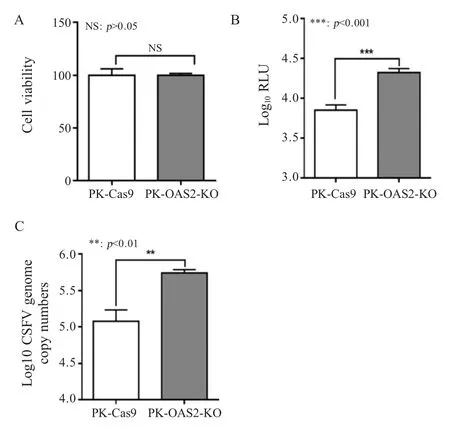
图5 敲除OAS2 对CSFV 复制影响的检测结果Fig.5 The impact of OAS2 knockout on the replication of CSFV
3 讨 论
本研究采用CRISPR/Cas9 系统,分别设计了靶向OAS2 基因第1 和第2 外显子的sgRNAs,将sgRNAs 序列插入LentiCRISPRv2 载体,获得重组质粒。将重组质粒与辅助质粒共转染HEK293T 细胞,获得携带sgRNA 的慢病毒,将重组慢病毒转导PK-15细胞,采用puro 筛选分离得到单克隆细胞株,经基因测序和western blot 鉴定,表明正确构建了敲除OAS2 基因的 PK-15 稳定细胞系。将 CSFV 感染PK-OAS2-KO 细胞系,结果表明敲除OAS2 促进CSFV 复制。本研究为构建CSFV 的其它基因敲除的PK-15 细胞系提供了参考,并为进一步阐明OAS2抗CSFV 的作用机理奠定基础。
猪源OAS 家族包括3 个成员:OAS1、OAS2 和OASL。前期实验已证实猪源OAS1 和OASL 均能够抑制CSFV 的复制[9],本实验显示敲除OAS2 促进CSFV 复制,表明猪源OAS 家族均能够抑制CSFV复制。其中,OASL 不是依赖于经典的OAS/RNase L 通路发挥抗病毒作用,而是通过促进MDA5 介导的 IFN 信号通路发挥抗 CSFV 作用[9];OAS1 和OAS2 抑制CSFV 复制的机制还不明确,有必要进一步探究其是否依赖于经典的OAS/RNase L 通路而发挥抗CSFV 作用。
CRISPR/Cas9 系统是一种高效、方便的基因编辑工具,具有操作简单、基因修饰率高、可遗传和实验成本低等优点[10]。与小RNA 干扰技术相比,CRISPR/Cas9 系统是在DNA 水平对OAS2 基因进行编辑,完全沉默了OAS2 的表达;与shRNA 相比,CRISPR/Cas9 系统克服了用慢病毒转导细胞引发的突变及不稳定表达的缺点。但是,由于受到sgRNA识别位点特异性及某些基因结构复杂性的限制,CRISPR/Cas9 系统还面临着脱靶的问题,在一定程度上限制了其在基因功能研究方面的应用[11],但随着CRISPR/Cas9 系统的不断优化以及新的Cas 系统的出现,其应用范围将更加广泛。
猜你喜欢
——一道江苏高考题的奥秘解读和拓展
