OmpD对肠炎沙门菌生物学特性影响的研究
2020-01-17张志强苏硕青杜万年李永慧刘勃兴吴同垒朱国强史秋梅
张志强 ,苏硕青,杜万年,李永慧,刘勃兴,吴同垒,朱国强,史秋梅*
(1.河北科技师范学院,河北秦皇岛066004;2.秦皇岛第二医院,河北昌黎066600;3.扬州大学,江苏扬州225009)
细菌生物被膜(Biofilm,BF)是细菌在生长过程中粘附于其表面形成的多成分聚集物,是由细菌分泌多糖基质、纤维蛋白、脂质蛋白、DNA 等将菌体包裹而形成的大量细菌聚集膜样物[1]。BF 作为有效的物理屏障,能够协助病原菌抵御药物和免疫系统杀伤,对细菌的生存十分重要。沙门菌在生长和感染过程中也能于多种附着物表面产生BF,这对于其在不利环境下生存乃至造成长期持续性感染具有重要的意义[2]。已有文献表明,BF 态沙门菌感染致病能力远高于游离态细菌[3]。影响细菌BF 的因素十分复杂,培养条件、定植区域、菌体密度等均可影响BF 形成[1]。有研究发现,外膜蛋白与细菌BF 密切相关,将某些外膜蛋白,如OmpR[4]、OmpP1[5]等缺失能够显著影响细菌BF 生成。
OmpD (又名NmpC)是沙门菌外膜孔蛋白,在所有孔蛋白中含量最多。有研究发现,细菌中OmpD的表达量受到细菌培养条件的影响,缺氧、pH 变化以及氧化应激条件均可引起该蛋白表达变化[6]。在鼠伤寒沙门菌的研究中发现,OmpD 还参与细菌对巨噬细胞和肠道上皮细胞的粘附和侵袭,在感染的起始阶段发挥重要作用[7]。此外,有研究发现OmpD 是沙门菌诱导体液免疫反应的关键分子,具有作为亚单位疫苗的潜力[8]。作为沙门菌表达量最多的孔蛋白,OmpD 与细菌BF 的相关性尚未见报道。本研究拟以沙门菌OmpD 蛋白作为研究对象,通过构建肠炎沙门菌ompD基因缺失株研究其生物学特性,探究OmpD 与沙门菌BF、耐药性以及致病力等的相关性,为沙门菌的致病机制的研究奠定基础。
1 材料与方法
1.1 菌株、质粒及主要试剂 质粒pKD3、pKD46、pCP20 由吉林农业大学康元环教授惠赠;人结肠癌上皮细胞Caco-2、肠炎沙门菌参考菌株C50336、质粒pBR322 由扬州大学朱国强教授惠赠。昆明鼠购北京维通利华实验动物技术有限公司。
细菌RNA 提取试剂盒、基因组清除试剂盒购自北京艾德莱生物科技有限公司;LATaqDNA 聚合酶、细菌基因组提取试剂盒、dNTP、限制性内切酶及T4 连接酶均购自TaKaRa 公司;刚果红、考马斯亮蓝、荧光增白剂和L- 阿拉伯糖购自Sigma 公司;琼脂糖DNA 回收试剂盒购自Tiangen 公司。
1.2 λ-Red 同源重组引物的设计 根据NCBI 中登录的肠炎沙门菌基因组序列(CP023475.1)设计引物(表1),P1/P2 用于扩增打靶片段,由两部分组成,5' 端加下划线的部分与待敲除基因序列同源,3' 端未加下划线部分与氯霉素抗性基因cat两侧序列互补,P3/P4 引物用于构建回补质粒;P5/P6 引物位于ompD基因开放阅读框外侧,用于缺失株的鉴定;P7/P8 为RT-qPCR 引物,位于ompD基因缺失片段内部,用于缺失株的鉴定。所有引物均由上海生工生物工程技术服务有限公司合成。
1.3 沙门菌ompD基因缺失株及回补菌株的构建参照文献[9],利用λ-Red 同源重组方法对ompD基因进行敲除,最终得到ompD基因缺失菌株C50336ΔompD,对该菌株利用PCR(P5/P6)和RT-qPCR(P7/P8)方法进行鉴定。
利用细菌基因组提取试剂盒提取C50336 菌株基因组,以基因组为模板,利用P3/P4 引物扩增ompD基因片段,将其克隆至pBR322 质粒,构建pBR322-ompD质粒,将其转化至C50336ΔompD菌株,构建回补菌株pBR322-ompD/C50336ΔompD,并进行PCR鉴定。
1.4 沙门菌生长特性检测 分别将菌株C50336、C50336ΔompD、 pBR322-ompD/C50336ΔompD接 种LB 液体培养基,37 ℃过夜培养,次日按1:50 转接新鲜LB 或M9 培养基,37 ℃同步振摇培养;每隔2 h 吸取菌液样品,测定其吸光度OD600nm值,绘制不同菌株的生长曲线。
1.5 肠炎沙门菌BF 形成能力检测 参照文献[3],分别采用试管法和96 孔微量法检测上述各菌株BF形成能力。为分析BF 成分,将各菌株接种至刚果红培养基(含刚果红40 μg/mL,考马斯亮蓝G250 20 μg/mL),30 ℃培养 48 h,通过观察菌落形态、颜色分析BF 成分;同时将各菌株接种含有荧光剂(荧光增白剂28 终浓度为200 μg/mL)的培养基,30 ℃培养48 h,在366 nm 紫外线下比较菌落荧光强弱,分析BF 纤维素的含量。
1.6 菌株耐药性检测 参照CLSI 试验标准,利用K-B 纸片法对上述肠炎沙门菌3 个菌株进行抗生素敏感性测试,质控菌株为大肠杆菌ATCC25922,统计各抗生素药敏纸片所形成的抑菌圈直径。参照CLSI 标准,测定肠炎沙门菌各菌株对多黏菌素B 的最小抑菌浓度(Minimal inhibit concentration,MIC)。
1.7 细菌粘附试验 参照文献[3],分别测定上述肠炎沙门菌3 个菌株对人结肠癌上皮细胞Caco-2 粘附能力。计算细菌粘附率(粘附细胞菌数/ 初始菌数×100 %)。试验均重复3 次,实验数据利用prism 5.0 软件进行统计学分析。
1.8 细菌致病力的检测 参照文献[3]方法,利用昆明鼠模型测定上述肠炎沙门菌各菌株对其的半数致死量(LD50),以评估各菌株对小鼠的致病力。
1.9 BF 和毒力基因的检测 参照文献[10],利用RT-qPCR 方法检测上述肠炎沙门菌3 个菌株BF 调控基因csgA、csgD、bcsA、ompR、adrA和毒力基因fimD、sdiA、flgG、invH、rpoS的转录水平,所用引物分别来源于文献[10]和[11]。
2 结 果
2.1 肠炎沙门菌C50336ΔompD的构建 利用同源重组方法缺失肠炎沙门菌C50336 菌株ompD基因,对获得的一次重组菌株(C50336ΔompD::cat)和二次重组菌株(C50336ΔompD)进行PCR(P5/P6)检测。结果显示,对照野生型菌株扩增片段约为1 700 bp,一次重组菌株和二次重组菌株扩增片段分别约为1 800 bp和900 bp (图1),与预期大小一致;对二次重组菌株PCR (P5/P6)产物测序结果显示,经过两次重组得到的C50336ΔompD菌株基因组中已不含ompD基因片段;RT-qPCR (P7/P8)结果显示未检测到ompD基因转录产物(图略)。上述结果表明正确构建了肠炎沙门菌缺失菌株C50336ΔompD。同时,利用引物P3/P4 进行菌液PCR 鉴定回补株,结果显示回补株正确构建(图略)。

图1 肠炎沙门菌ompD 基因缺失株的PCR 鉴定Fig.1 Identification of the knockout of ompD gene in Salmonella enteritidis strains by PCR
2.2ompD基因缺失对肠炎沙门菌生长特性的影响分别绘制肠炎沙门菌3 种菌株在LB 和M9 培养基中的生长曲线,结果显示,3 株菌生长速度在这两种培养基中均无明显差异(图2)。表明ompD基因的缺失对肠炎沙门菌生长速率无影响。
碾压混凝土因其具有施工速度快的优点得到了广泛应用。近年来,大型碾压混凝土大坝施工中,碾压混凝土日浇筑上万立方已较为普遍。即使是在小型碾压混凝土坝施工中,碾压混凝土的日浇筑方量通常也能达到一千立方以上。一般情况下,只有混凝土拌和系统的生产能力足够高的情况下,碾压混凝土的施工强度可以是同等条件下常态混凝土施工强度的3倍以上。
2.3ompD基因缺失对肠炎沙门菌BF 的影响 利用试管法和96 孔微量法检测肠炎沙门菌3 种菌株BF 形成情况。结果显示,C50336ΔompD株在试管气液交界处形成的BF 明显少于野生型菌株和回补菌株(图3A);定量检测结果显示,相对于野生型菌株,C50336ΔompD株 BF 减少了近 75 % (图3B),表明ompD基因缺失能够降低肠炎沙门BF 的形成。
进一步将肠炎沙门菌3 种菌株接种刚果红琼脂,观察各菌落的形态及颜色。结果显示,野生型菌株和回补菌株均能够在刚果红培养基上形成粗糙的带有明显褶皱的红色菌落,而缺失菌株C50336ΔompD所形成的菌落较为光滑(图3C),表明ompD基因缺失能够降低肠炎沙门BF 关键成分卷毛蛋白的合成。
进一步将肠炎沙门菌3 种菌株接种含荧光增白剂琼脂,在紫外线下观察菌落荧光情况,结果显示,缺失菌株C50336ΔompD菌落荧光强度略低于野生型菌株和回补菌株(图3D),表明ompD基因缺失能够降低肠炎沙门BF 重要成分纤维素的合成。

图2 肠炎沙门菌生长曲线的测定结果Fig.2 Growth characteristics of C50336 isogenic deletion strains
2.4ompD基因缺失对肠炎沙门菌耐药性的影响利用K-B 纸片法分析肠炎沙门菌3 种菌株的耐药情况,结果显示,相对野生型菌株和回补菌株,在涂布缺失菌株C50336ΔompD平板上各药敏纸片形成抑菌圈直径明显增大(表2),表明ompD基因缺失会引起肠炎沙门菌对多种抗生素的敏感性增强。值得注意的是,本研究发现ompD基因缺失也会造成肠炎沙门菌对多肽类抗生素多粘菌素B 的敏感性增强,其对多粘菌素 B 的 MIC 由 16 μg/mL 下降至4 μg/mL,表明OmpD 可能参与肠炎沙门菌感染中应对体内抗菌肽的杀伤。

图3 肠炎沙门菌BF 形成及成分分析Fig.3 Determination of biofilm formation and its components in the C50336 isogenic deletion strains
2.5ompD基因缺失对肠炎沙门菌黏附的影响 检测肠炎沙门菌3 种菌株对人结肠癌细胞Caco-2 细胞的黏附能力。结果显示,与野生型菌株和回补菌株相比,基因缺失菌株C50336ΔompD对Caco-2 细胞的黏附能力无显著差异(图4,p>0.05),表明OmpD不影响肠炎沙门菌对细胞的粘附。
2.6ompD基因缺失对肠炎沙门菌毒力的影响 利用小鼠模型测定肠炎沙门菌3 种菌株的LD50,结果显示,野生型菌株、ompD基因缺失菌株和回补菌株的 LD50分别为 3.16×106cfu/ 只、6.3×107cfu/ 只和1.29×107cfu/ 只,相较于野生型菌株,基因缺失菌株C50336ΔompD对小鼠LD50提高了近20 倍,表明OmpD 影响肠炎沙门菌的毒力。
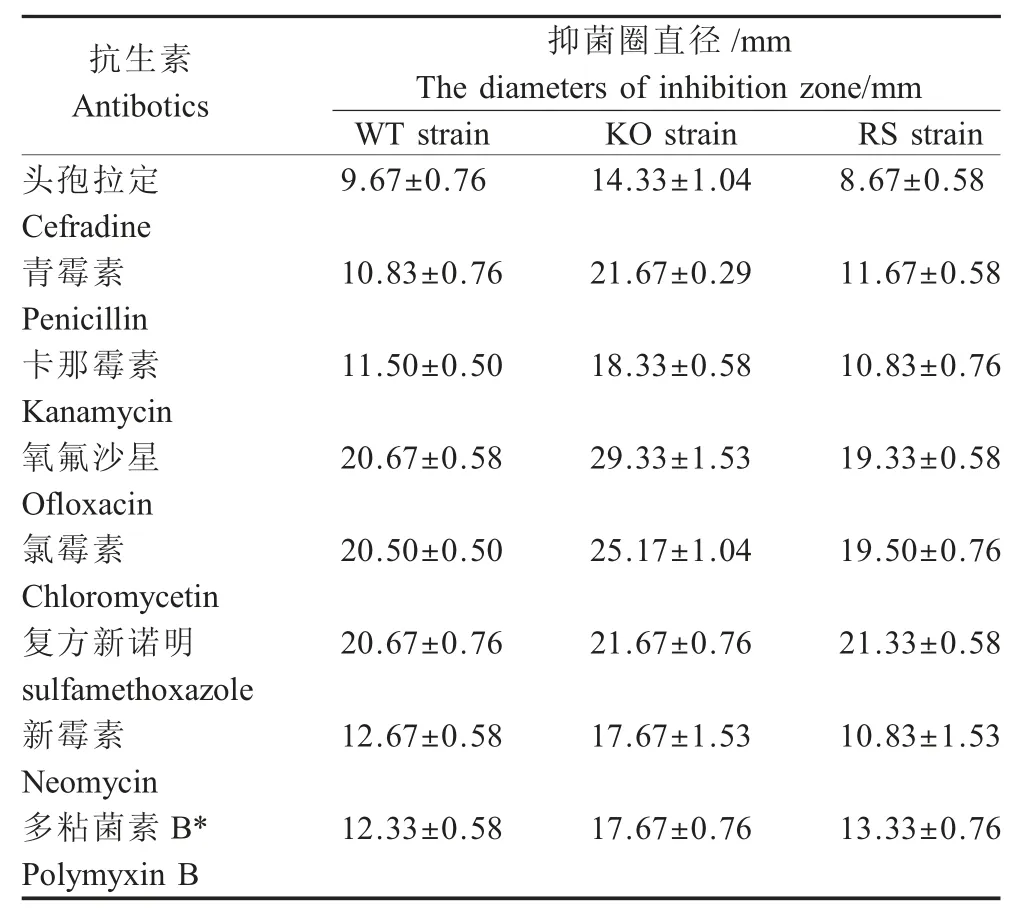
表2 肠炎沙门菌药敏试验结果Table 2 Antibotics sensitivity assay of C50336 isogenic deletion strains

图4 肠炎沙门菌生物的黏附能力测定Fig.4 Adhesion assay of C50336 isogenic deletion strains
2.7ompD基因缺失对肠炎沙门菌相关基因转录水平的影响 利用RT-qRT 方法检测肠炎沙门菌内毒力基因转录情况,结果显示,相比野生型菌株和回补菌株,缺失菌株C50336ΔompD中参与肠炎沙门菌BF 调控基因csgA、csgD、ompR、adrA的转录水平均不同程度下调(图5A),其它毒力基因fimD、sdiA、flgG、invH和rpoS等转录水平也有不同程度下调(图5B),结果初步揭示OmpD 蛋白影响肠炎沙门菌的BF 形成以及参与毒力机制。

图5 RT-qPCR 分析肠炎沙门菌各菌株毒力基因转录水平情况Fig.5 Analysis of virulence gene expression of C50336 isogenic deletion strains by RT-qPCR
3 讨 论
沙门菌能够感染多种动物,对成年动物多造成隐性感染和持续性感染,感染持续时间可达数月甚至数年,给该病防控造成重大困扰[12]。BF 有助于沙门菌应对不利环境和应激,对其体内持续感染十分重要[1]。因此研究沙门菌BF 的形成机制和调控因素,对沙门菌病的防控具有指导意义。本研究主要围绕沙门菌外膜孔蛋白OmpD与肠炎沙门菌BF 的关系进行研究,探索该蛋白在沙门菌致病中的作用。
影响BF 形成的因素十分复杂,多种基因被报道在沙门菌BF 生成中发挥关键作用,本研究中通过RT-qPCR 检测结果显示,与BF 相关的csgA、csgD、ompR、adrA[10,14]基因转录水平不同程度下调,确认了OmpD 蛋白对肠炎沙门菌BF 的影响。
BF 是细菌的重要粘附因子,其主要成分卷毛蛋白参与细菌对宿主细胞的定植黏附以及细胞间的相互作用[15],研究发现OmpD 蛋白在鼠伤寒沙门菌黏附细胞过程中发挥一定作用[16],因此推测OmpD 与肠炎沙门菌粘附相关,然而本研究未观察到肠炎沙门菌ompD基因缺失菌株黏附能力的显著下降,其原因有待进一步研究。
BF 能够保护细菌免受外界不利环境的杀伤,与细菌的耐药性密切相关[1],已有研究发现OmpD 在鼠伤寒沙门菌对抗头孢曲松钠杀伤过程中发挥关键作用[17];此外,作为细菌表达量最大的外膜孔蛋白,OmpD 一个重要功能是排出各种毒性物质[16],因此推测OmpD 参与细菌应对多种杀菌物质杀伤。本研究通过检测肠炎沙门菌3 种菌株抗生素敏感性发现,ompD基因缺失能够不同程度增加肠炎沙门菌对多种常用抗生素的敏感性。在众多待检抗生素中,多黏菌素B 是抗菌多肽类抗生素,其杀菌机制与宿主免疫系统分泌的抗菌肽相似,常作为机体抗菌肽的代表模型[18]。本研究ompD基因缺失菌株对多黏菌素B 的敏感性增强,MIC 提高了3 倍,表明OmpD 蛋白可能参与肠炎沙门菌应对宿主抗菌肽的杀伤。
基于本研究确认的OmpD 蛋白上述功能推测该蛋白可能参与肠炎沙门菌的致病过程。关于OmpD蛋白与细菌毒力关系还存在诸多争议,Dorman 等通过测定LD50认为ompD基因缺失能够降低鼠伤寒沙门菌毒力[19]。而Mayer 等用小鼠模型分析认为ompD基因缺失不会影响沙门菌毒力[20]。本研究利用昆明鼠模型分析肠炎沙门菌3 种菌株致病力,发现ompD基因缺失能够降低肠炎沙门菌的毒力。此外,本研究还检测到了ompD基因缺失所引起的一些毒力基因的变化,包括运动相关基因fimD、flgG,侵袭基因invH以及调控性基因sdiA、rpoS[10],这些结果表明OmpD 蛋白可能参与肠炎沙门菌这些相关生理过程。
综上所述,OmpD 蛋白参与肠炎沙门菌BF 形成和抗生素敏感性,与细菌致病性密切相关。
