鸭源鸡杆菌gtxA/flfA基因双缺失株的构建及其生物学特性分析
2020-01-17刘盼盼王继洋刘红英李永涛常洪涛王新卫夏银河王川庆
刘盼盼,王继洋,杨 霞, 刘红英,李永涛,常洪涛,王新卫,夏银河,陈 陆,赵 军,王川庆
(河南农业大学禽病研究所,河南郑州450002)
鸭源鸡杆菌(Gallibacterium anatis,G.anatis)为巴氏杆菌科鸡杆菌属,是一种定植于易感动物上呼吸道及下生殖道的条件性致病菌[1],主要感染鸡、鸭、鹅、火鸡等[2],输卵管是其主要靶器官,常引起腹膜炎、输卵管炎[3]、输卵管囊肿[4]等疾病,导致蛋鸡产蛋量及质量明显下降,死亡率提高,混合感染的情况下会给养殖业造成更大的损失,因而对G.anatis的致病机理和致病因子的研究越来越受到关注[5]。目前已确定的G.anatis毒力因子主要有外膜囊泡、GtxA 毒素、菌毛、荚膜及金属蛋白酶等[6]。Lucio等发现G.anatis能够黏附于鸡口咽上皮细胞和惰性物质表面,并在其表面观察到短而小的毛发样结构[7]。随后 Bager 等证实了G.anatis表面存在 F-17 菌毛,该菌毛基因簇由flfD、flfC、flfG,flfA4 个基因构成,G.anatis的FlfA 菌毛不但有良好的免疫原性,而且与其毒力也密切相关[8]。另有文献显示,G.anatis的F-17 样菌毛是一种可以黏附于含N- 乙酰基-D- 氨基葡萄糖的细胞表面受体,其与对宿主细胞的黏附密切相关[9]。Kristensten 等人发现G.anatis具有溶血活性及较强细胞毒性,并随后通过基因组分析预测到一个RTX 样毒素GtxA,并发现该菌具有的溶血能力与分泌型RTX 毒素GtxA 有关[10]。
鉴于此, 本研究以中国G.anatis分离株PDS-RZ-1-SLG 为研究对象,在RTX 样毒素GtxA基因缺失株RZΔgtxA基础上进一步构建F-17 菌毛flfA基因缺失菌株RZΔgtxAΔflfA,分析其生物学特性变化,并以已建立的鸡原代输卵管上皮细胞感染模型,探究GtxA 毒素及F-17 菌毛在G.anatis感染中的作用及两毒力因子之间的相互作用关系,为进一步了解G.anatis的致病机理奠定基础。
1 材料与方法
1.1 菌株与质粒G.anatisPDS-RZ-1-SLG(RZ)株由本实验室分离鉴定并保存;RZΔgtxA[11]由本实验室构建保存。质粒pMD18-T、pUC18 购自宝生物工程(大连)有限公司;质粒pBC KS+由本实验实保存。
1.2 主要试剂和培养基 血琼脂平板购自郑州贝瑞特有限公司;酵母浸膏、蛋白胨、DL2000 DNA Marker、dNTP 混合液、TaqDNA 聚合酶、限制性内切酶均购自宝生物工程(大连)有限公司;Ezup 柱式细菌基因组DNA 抽提试剂盒购自生工生物工程(上海)股份有限公司;L- 天冬氨酸、L- 谷氨酸、富马酸(反丁烯二酸)、NaCl、K2HPO4、KH2PO4、吐温80、L- 胱氨酸、L- 酪氨酸、L- 瓜氨酸、L- 苯丙氨酸、L- 丝氨酸、L- 丙氨酸、CaCl2、MgSO4、MTT均购自北京索莱宝科技有限公司;兔抗原核表达FlfA 多克隆抗体[12]由本实验室制备保存,羊抗兔IgG-HRP 购自武汉三鹰生物公司;无维生素酪蛋白氨基酸购自美国BD 公司;BHI 培养基购自美国Difco 公司。
1.3 引物的设计与合成 依据UMN179 菌株全基因组(NC015460.1)中flfA基因序列,利用Primer 5.0设计用于扩增flfA基因上游同源臂片段引物FlfA-S-F/FlfA-S-R、下游同源臂片段引物FlfA-X-F/FlfA-X-R、转化片段引物PSKX-F/PSKX-R 及突变菌株鉴定引物FlfA-T-F/FlfA-T-R。同时根据质粒pBC KS+ 的序列信息,设计扩增卡那霉素(Kan+)的引物KAN-F/KAN-R。所有引物均由上海生工生物工程有限公司合成(表1)。
1.4 同源重组质粒pUC18-S-K-X 的构建与鉴定利用细菌基因组DNA 快速抽提试剂盒提取G.anatisRZΔgtxA株全基因组,并以其为模板PCR 扩增flfA基因上下游同源臂。同时以pBC KS+ 质粒为模板,经PCR 扩增获得kan+筛选标记片段。用EcoRⅠ和BamH Ⅰ双酶切回收纯化的上游同源臂克隆至pUC18 构建pUC18-S 质粒。回收纯化的下游同源臂和pUC18-S 质粒经Hind Ⅲ和BamHⅠ双酶切构建pUC18-S-X,然后将该质粒和抗性标记片段经BamHⅠ单酶切后构建pUC18-S-K-X,将其转入DH5α 感受态细胞,经BamHⅠ单酶切,EcoRⅠ和Hind Ⅲ双酶切及测序鉴定正确的质粒保存备用。

表1 构建RZΔgtxAΔflfA 所需引物Table 1 Primer used for contructing the RZΔgtxAΔflfA mutant strain
1.5 缺失株RZΔgtxAΔflfA的构建及筛选 以质粒pUC18-S-K-X 为模板,利用引物 PSKX-F/PSKX-R PCR 扩增S-K-X 片段。依据Ragnhild J[6]报道的方法制备G.anatisRZΔgtxA株感受态细胞,加 1 μg 转化片段S-K-X 到1 mL 感受态细胞中培养25 min,加入2 倍体积的BHI 培养2 h 后涂布于Kan+平板。48 h后挑单个菌落于Kan+培养基筛选阳性克隆。对筛选到的的具有稳定Kan+的菌株经煮沸法提取其基因组DNA 为模板,利用引物FlfA-T-F/FlfA-T-R 对其进行PCR 鉴定。鉴定阳性的PCR 产物由上海生工生物工程技术服务有限公司测序,并命名为RZΔgtxAΔflfA。
1.6 缺失株 RZΔgtxAΔflfA的 western blot 鉴定 将G.anatisRZΔgtxA及 RZΔgtxAΔflfA单菌落接种至不含Kan+的BHI 肉汤中,培养至其OD600nm为1.0,收集菌体后,以兔抗FlfA 多克隆抗体(1∶3 750)为一抗,羊抗兔IgG-HRP (1∶4 000)为二抗,经 western blot 鉴定FlfA 是否缺失。
1.7 缺失株RZΔgtxAΔflfA的遗传稳定性检测 将RZΔgtxAΔflfA株接种于BHI 固体培养基中连续盲传10 代,挑取第2、4、6、8、10 代单菌落,提取基因组后,利用FlfA-T-F /FlfA-T-R 引物进行菌落PCR鉴定,分析缺失株ΔgtxA/ΔflfA是否稳定遗传flfA基因的缺失。
1.8 缺失株RZΔgtxAΔflfA生长特性试验 将G.a-natisRZ 株、RZΔgtxA和 RZΔgtxAΔflfA分别接种于绵羊血琼脂平板,37 ℃孵育24 h,观察各菌的溶血活性及菌落形态。
同时,在相同培养条件下将这3 株G.anatis于BHI 液体培养基过夜培养。分别取等量的G.anatis过夜培养物接种于BHI 液体培养基中,37 ℃振荡培养,每隔1 h 测定其OD600nm。试验重复3 次并绘制各菌的生长曲线。
1.9 缺失株RZΔgtxAΔflfA生物被膜形成能力测定挑取G.anatisRZ 株、RZΔgtxA、RZΔgtxAΔflfA单菌落接种于BHI 培养液中过夜培养,参考文献[13]结晶紫半定量法进行生物被膜形成能力测定。每个菌株设置8 个重复,同时设不接菌的培养基为对照,试验重复3 次取平均值计算。
1.10 缺失株RZΔgtxAΔflfA黏附能力测定 参照文献[14-16]进行鸡原代上皮细胞分离培养,培养至长满单层,用无菌PBS 清洗3 遍,每孔细胞中分别加入 500 μL 浓度为 1.0×107cfu/mL (MOI 100)的G.anatisRZ 株、RZΔgtxA、RZΔgtxAΔflfA菌液。分别在感染 30 min、60 min、90 min、120 min 时用无菌PBS 清洗3 次,胰酶消化后离心收集部分细胞。经500 μL 1 %的 TritionX-100 溶解混匀,采用琼脂平板活菌计数法,计算每孔溶解液中的细菌数量。每个样品设置4 个重复,试验重复3 次。取每孔细菌黏附细胞数量的对数值作图分析RZΔgtxAΔflfA对细胞的黏附能力。
1.11 缺失株 RZΔgtxAΔflfA的细胞毒性试验 将G.anatisRZ 株、RZΔgtxA及 RZΔgtxAΔflfA分别在BHI 培养基中37 ℃振荡培养6 h,收集并洗涤菌体,使其终浓度为1.0×107cfu/mL 并以 MOI 100 的量分别接种鸡原代输卵管上皮细胞,37 ℃培养24 h 后于每孔加入20 μL MTT 溶液,继续培养2 h、4 h、6 h,分别测定其OD570nm。每株菌分别做8 个重复孔,并设立未接种G.anatis细胞孔为对照组。计算细胞死亡率[细胞死亡率(%)=(1- 实验组 OD570nm/ 对照组OD570nm)×100 %],作为检测G.anatis对鸡原代输卵管上皮细胞的毒性指标。
2 结 果
2.1 重组质粒pUC18-S-K-X 的构建与鉴定 对构建的重组质粒pUC18-S-K-X 分别采用BamHⅠ单酶切和EcoRⅠ/Hind Ⅲ双酶切鉴定,酶切片段与预期片段大小一致(图1)。测序结果显示插入片段为flfA基因上下游同源臂、Kan+抗性基因,且序列无突变。表明重组质粒pUC18-S-K-X 正确构建。

图1 pUC18-S-K-X 质粒的酶切鉴定Fig.1 Identification of puc18-S-K-X plasmid by restriction enzyme digestion
2.2 缺失株RZΔgtxAΔflfA的PCR 鉴定结果 利用引物FlfA-T-F/FlfA-T-R 对筛选到的具有稳定Kan+的G.anatis菌液进行PCR 鉴定。结果显示,该菌液的PCR 扩增片段长度为1 326 bp,而RZΔgtxA的扩增片段为596 bp (图2),测序结果进一步证实缺失株ΔgtxA/ΔflfA的扩增片段为 Kan+抗性基因及flfA基因的两端序列。表明RZΔgtxAΔflfA株构建正确。

图2 G.anatis RZΔgtxAΔflfA 的 PCR 鉴定Fig.2 Identification of G.anatis RZΔgtxAΔflfA mutant strain by PCR
2.3 缺失株 RZΔgtxAΔflfA的 western blot 鉴定结果利用 western blot 对构建的 RZΔgtxAΔflfA进行蛋白水平的鉴定。结果显示,RZΔgtxA在约20.1 ku 处出现目的蛋白条带,而RZΔgtxAΔflfA在该处无目的蛋白条带(图3)。表明 RZΔgtxAΔflfA不表达 FlfA 菌毛,进一步表明RZΔgtxAΔflfA构建正确。
2.4 缺失株RZΔgtxAΔflfA的遗传稳定性检测结果将 RZΔgtxAΔflfA连续盲传 10 代,挑取 2、4、6、8、10 代单菌落提取基因组后经PCR 鉴定。结果显示,各代次缺失菌株均能够扩增出长度约为1 300 bp的目的条带(图4),表明flfA基因缺失在RZΔgtxAΔflfA株中能够稳定遗传。

图3 RZΔgtxAΔflfA 和 RZΔgtxA 的 western blot 鉴定结果Fig.3 Identification of mutant RZΔgtxA and mutant RZΔgtxAΔflfA by western blot

图4 缺失株体外遗传稳定性分析Fig.4 Analysis of the heredity stability of the mutations in vitro
2.5 缺失株 RZΔgtxAΔflfA生长特性的检测结果将G.anatisRZ 株、RZΔgtxA株和 RZΔgtxAΔflfA株分别划线接种于5 %绵羊血平板上,37 ℃培养24 h后均长出半透明、灰白色、有完整边缘、直径1 mm~2 mm 的圆形菌落;两突变株相比RZ 株菌落形态、大小无显著变化,但二者溶血环均消失,表明gtxA基因的缺失改变了G.anatis的溶血活性,但gtxA和flfA基因的缺失并未导致缺失株与亲本株菌落形态及大小出现明显的差异。
在相同的条件下培养G.anatisRZ 株、RZΔgtxA和 RZΔgtxAΔflfA株,每隔 1 h 测定其 OD600nm值,绘制生长曲线。结果显示,三者生长速率和生长状态均相似且无明显差别(图5)。表明gtxA和flfA基因的缺失并未改变G.anatis的生长特性。
2.6 缺失株RZΔgtxAΔflfA生物被膜形成能力测定结果 分别取该3 株菌过夜培养物于37 ℃恒温培养24 h,采用结晶紫半定量法测定3 株菌的OD595nm,比较3 种菌的生物被膜形成能力。结果显示,相比G.anatisRZ 株,RZΔgtxA株和 RZΔgtxAΔflfA株生物被膜形成能力均显著降低(p<0.001),但 RZΔgtx-AΔflfA株相比RZΔgtxA株生物被膜形成能力稍提高,但二者无显著差异(p>0.05) (图6)。表明gtxA基因的缺失使G.anatis生物被膜形成能力显著下降,但flfA基因的缺失则对生物被膜的形成能力无明显影响。

图5 G.anatis RZ 株、RZΔgtxA 株和 RZΔgtxAΔflfA 株生长曲线的测定结果Fig.5 The determination of growth curves of wild type G.anatis RZ,RZΔgtxA and RZΔgtxAΔflfA

图6 G.anatis RZ 株、RZΔgtxA 株和 RZΔgtxAΔflfA 株生物被膜形成能力的检测结果Fig.6 Detection results of biofilm formation of strain G.anatis RZ,RZΔgtxA and RZΔgtxAΔflfA
2.7 缺失株RZΔgtxAΔflfA黏附能力测定结果 将该3 株菌分别以相同的感染量接种于生长至单层的鸡原代输卵管上皮细胞,取每孔黏附细胞的细菌数量的对数值作为结果,测定各菌株对细胞的黏附能力。结果显示,3 株G.anatis黏附能力随时间延长而增强,在感染细胞90 min 时达到最大值;但RZΔgtxA株和 RZΔgtxAΔflfA株的黏附能力始终低于G.anatisRZ 株,RZΔgtxAΔflfA株的黏附能力始终低于RZΔgtxA株,且在感染细胞90 min 时差异显著(p<0.05);感染120 min 后,三者黏附鸡原代输卵管上皮细胞的数量均下降(p<0.05) (图7)。表明gtxA基因和flfA基因的缺失均能够使G.anatis的黏附能力下降。
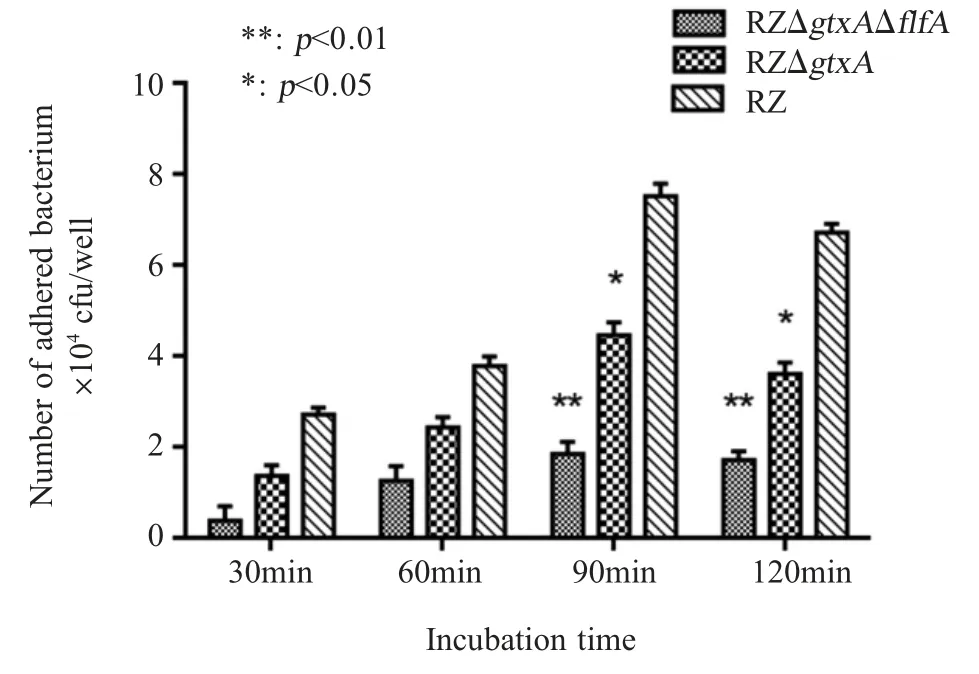
图7 G.anatis RZ、RZΔgtxA 和 RZΔgtxAΔflfA 株对鸡原代输卵管上皮细胞黏附能力的检测结果Fig.7 Adhesion of G.anatis RZ, RZΔgtxA and RZΔgtxAΔflfA on primary chicken oviduct epithelial cells
2.8 缺失株 RZΔgtxAΔflfA的细胞毒性测定结果参照文献[13]采用 MTT 法检测 RZΔgtxAΔflfA感染鸡原代输卵管上皮细胞后不同时间点的细胞死亡率。结果显示,各菌株感染该细胞后,其死亡率随培养时间延长而升高,但 RZΔgtxA株和RZΔgtxAΔflfA株感染该细胞的死亡率始终低于G.anatisRZ株(图8)。表明gtxA基因和flfA基因的缺失降低了G.anatis对鸡原代输卵管上皮细胞的毒性。
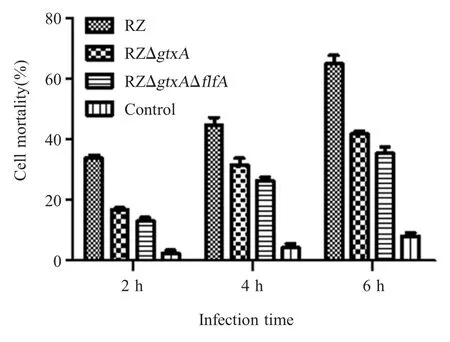
图8 G.anatis RZ 株、RZΔgtxA 株和 RZΔgtxAΔflfA 株对鸡输卵管上皮细胞毒性的检测结果Fig.8 The toxic test of G.anatis RZ, RZΔgtxA and RZΔgtxAΔflfA on chicken oviduct epithelial cells
3 讨 论
自然环境中某些细菌为适应环境变化而拥有自然转化能力,借此获得外源DNA 从而得到稳定遗传的新性状。2012 年Kristensen 等发现G.anatis也存在自然感受性,其自然转化效率优于电转化,并且环形质粒DNA 转化G.anatis的效率明显低于线性DNA 的转化效率,同时电转化法对染色体整合无效[17]。鉴于此,本研究借助G.anatis自然感受性,利用自然转化法将带有flfA基因的上下游同源臂及Kan+基因的线性片段转化入RZΔgtxA基因组构建了flfA基因缺失的RZΔgtxAΔflfA,并对其进行相关特性分析。结果显示,相比RZ 株、RZΔgtxA株和RZΔgtxAΔflfA株菌落形态、生长特性无显著变化、溶血活性消失;RZΔgtxA和 RZΔgtxAΔflfA生物被膜形成能力明显下降,黏附能力和毒性作用均降低。相比RZΔgtxA,RZΔgtxAΔflfA生物被膜形成能力稍有升高但二者差异不明显,其黏附能力及毒性作用下降。然而,环形质粒虽然也能通过电转化或自然转化法低效率进入G.anatis,但该菌自身含有一个或者多个质粒,可能存在其与常见表达载体的不相容性,且该菌具有倾向于摄取其自身DNA 的特性(常用质粒往往不能经转化进入G.anatis菌体),目前尚未有G.anatis回补株构建成功的报道[18]。本研究过程中尝试用与G.anatis同科的猪胸膜肺炎放线杆菌的穿梭载体用于转化但未成功,因此暂未能构建回补株。
细菌的黏附力是决定细菌致病性的关键环节。对细菌黏附机制的报道除了细菌黏附素- 受体特异性黏附机制外[19],还包括细菌疏水性和生物被膜在细菌非特异性黏附过程中的作用机制研究[20]。本研究中,比较了 RZΔgtxAΔflfA与 RZΔgtxA及野生株RZ 3 株菌生物被膜的形成能力,结果显示当gtxA基因缺失时,G.anatis生物被膜形成能力显著下降(p<0.001),相应的黏附力出现一定程度的下降(p<0.05),表明gtxA基因在G.anatis生物被膜形成过程中起重要作用,并影响G.anatis对鸡原代输卵管上皮细胞的黏附,这与霍乱弧菌RTXA、嗜肺军团菌RTXA和肠道沙门氏菌RTXA 均促进细菌生物被膜形成且发挥黏附作用的结果一致[21]。当在RZΔgtxA基础上进一步缺失菌毛flfA基因时,RZΔgtxAΔflfA的黏附能力有所降低,生物被膜形成能力几乎无变化,这与大肠杆菌F18ac 的Ⅰ型菌毛亚基fimA缺失造成生物被膜形成下降有一定差异[22],推测可能由于体外培养的G.anatis菌毛表达受到严格调控,与其仅表达FlfA 菌毛亚基有关。以上研究表明,G.anatisGtxA 和菌毛在其感染鸡原代输卵管上皮细胞过程中均发挥毒性和黏附作用,且呈现明显的协同作用。鉴于G.anatis的感染需要多种毒力因子共同发挥作用,其具体作用机制还需要结合其他重要毒力因子的相关试验来进一步分析。本研究为G.anatis感染机制的研究奠定基础。
