双重血浆分子吸附系统联合激素治疗慢加急性肝衰竭的疗效
2020-01-16许何明张骏飞董静宋海燕陈照林刘力伟潘劲劲刘波陈曦吕荣德安徽医科大学解放军临床学院合肥00中国人民解放军联勤保障部队第九一医院感染性疾病科合肥00合肥京东方医院感染性疾病科合肥00
许何明 张骏飞 董静 宋海燕 陈照林 刘力伟 潘劲劲 刘波陈曦 吕荣德安徽医科大学解放军临床学院(合肥00);中国人民解放军联勤保障部队第九〇一医院感染性疾病科(合肥00);合肥京东方医院感染性疾病科(合肥00)
慢加急性肝衰竭(acuteonchronic liver failure,ACLF)是指在慢性肝病的基础上,以患者出现黄疸和(或)凝血功能障碍为最初临床表现的急性肝功能失代偿,临床特征为起病急、进展迅速,且病死率高达50%以上[1]。而ACLF一旦确诊,在采用内科综合治疗的基础上,应早期进行人工肝治疗为肝细胞再生及肝功能恢复创造条件或为等待肝移植争取时间[2]。近几年出现的双重血浆分子吸附系统(double plasma moleculesadsorption system,DPMAS)的治疗模式是采用中性大孔树脂(HA330-Ⅱ)和离子交换树脂(BS330)两种吸附剂联合进行血浆吸附治疗,在胆红素吸附治疗的同时清除炎性介质、中大分子及蛋白结合毒素等有害物质,这项技术相对于血浆置换治疗手段而言,克服了血浆紧缺和过敏等缺点,可作为血浆置换的替代治疗[3]。另外,糖皮质激素作为肝衰竭的治疗手段之一,虽然在治疗的时机、类型、剂量与疗程上还存在一些争议,但其很强的抗炎作用及免疫抑制功能可使病情得到有效的控制;尤其是在ACLF的前期,以免疫过激及持续的炎症反应为主要特点,此时联用糖皮质激素可以抑制前期剧烈的炎性反应,减轻肝脏的免疫损伤,从而避免肝衰竭的持续性进展[4-5]。因此,笔者认为在DPMAS治疗的基础上联用激素,可能会更快速地降低ACLF患者的炎症因子水平,从而达到更好的治疗效果。为了验证这一假设,本研究选取38例乙型肝炎病毒(hepatitis B virus,HBV)感染相关ACLF患者为分析对象,对比观察了DPMAS联合糖皮质激素和单纯DPMAS两种治疗方案的临床疗效,现报告如下。
1 资料与方法
1.1 一般资料经中国人民解放军联勤保障部队第九〇一医院伦理委员会批准,批准号为2016A025;参与研究的患者个体及其家属均为自愿参加,所有供者及受者对试验过程完全知情同意,在充分了解治疗方案的前提下签署“知情同意书”。回顾性分析2016年1月至2019年2月第九〇一医院感染科接受双重血浆分子吸附治疗好转出院的38例HBV相关ACLF患者的临床资料,所有HBV感染相关ACLF患者的诊断参照《肝衰竭诊治指南(2018 年版)》[2]。入选标准:(1)在慢性肝病基础上;(2)患者黄疸迅速加深,血清总胆红素(total bilirubin,TBIL)≥ 10×正常值上限(ULN)或每日上升≥ 17.1 μmol/L;(3)有出血表现,血浆凝血酶原活动度≤40%或国际标准化比值(international normalized ratio,INR)≥ 1.5。排除标准:(1)肝癌;(2)有严重的其他系统疾病及有激素禁忌证者;(3)肝外胆汁於积所致黄疸进行性加深;(4)药物性肝炎、自身免疫性肝炎及合并其他病毒性肝炎的患者;(5)入院时有肝性脑病、肝肾综合征、肺部感染、腹水、腹膜炎及出血等并发症者;(6)血流动力学不稳定,治疗过程中死亡及妊娠或哺乳期妇女。
1.2 方法
1.2.1 设备耗材及药物血液净化机DX-10(珠海健帆);MPS07血浆分离器(意大利贝尔克),BS330血浆胆红素吸附柱(珠海健帆),HA330-Ⅱ树脂血液灌流器(珠海健帆),一次性体外循环血液管路(哈娜好),双腔深静脉导管(金宝),注射用甲泼尼龙琥珀酸钠(命得生),醋酸泼尼松片(仙居),肝素钠(万邦),硫酸鱼精蛋白(凯悦博康)。
1.2.2 分组及治疗方法所有患者均给予抗病毒、保肝、降酶、退黄及输注白蛋白等常规护肝治疗,并在入院后第2或3天开始DPMAS技术治疗;凝血功能异常者及DPMAS术后予以静脉输注血浆(100或200 mL/d);出现肺部感染、自发性细菌性腹膜炎、腹水及肝肾综合征等并发症的患者予以对症处理。自发性细菌性腹膜炎是指腹水多形核白细胞计数≥0.25×109/L,且排除腹腔继发性感染的腹水感染[6]。而肝肾综合征是指重症肝病如肝硬化合并腹水、急性肝衰竭和酒精性肝炎的患者发生一种以内脏循环动脉血管舒张和肾脏血管收缩为主要特征的肾功能不全[7]。根据是否应用糖皮质激素将患者分为观察组(DPMAS技术联合糖皮质激素治疗)和对照组(DPMAS技术治疗)。(1)对照组:以股静脉置管的方式建立血液通路,连接体外循环血液管路后应用珠海健帆公司DX-10多功能血液净化治疗装置进行人工肝治疗,预先用0.9%生理盐水2 500~3 000 mL预冲管路及吸附柱,排尽其内气体,再用500 mL肝素钠生理盐水(含肝素钠20 mg)进行肝素化预冲,10~30 min达到肝素化后密闭管路;选择25 mL肝素钠生理盐水(含肝素钠100 mg),按5 mL/h微泵注射,并根据病情及凝血功能调整用量;控制术中血流速度100~120 mL/min,控制血浆分离速度为20~24 mL/min,吸附时间为120~180 min;治疗结束时用硫酸鱼精蛋白静推,剂量为肝素总用量一半(不超过50 mg);治疗间隔3~5 d,据患者病情决定治疗次数。(2)观察组:在双重血浆分子吸附及内科综合治疗的基础上,在DPMAS治疗前1天给予激素治疗,其治疗方案参考龙云等[8]文献中所述的激素递减疗法,给予注射用甲泼尼龙琥珀酸钠(南光化学制药股份有限公司,国药准字HC20160039)1 mg/(kg·d),在治疗7 d后,无论TBIL下降情况如何,均将剂量减至原有剂量的1/2~3/4,继续治疗7 d后改成醋酸泼尼松片10 mg口服3次/d,每隔1周减量5 mg,直至停药。
1.2.3 检测方法使用日本HITACHI 7600-020全自动生化分析仪及其配套试剂检测肝肾功能指标;使用日本SEKISUI CP2000分析仪检测凝血酶原时间(PT)和C反应蛋白(CRP);使用中国Hotgen MQ60分析仪检测白细胞介素-6(IL-6),室内质控在控;INR根据PT比值(PTR)和国际敏感度指数(ISI)计算;以上数据均来自中国人民解放军联勤保障部队第九〇一医院检验科。采用双抗体夹心ELISA法检测白细胞介素-8(interleukin-8,IL-8)(CHE0011,四正柏),用酶标仪在450 nm波长处测OD值,通过绘制标准曲线计算出样品中IL-8的浓度。
1.3 观察指标以DPMAS治疗前1 d为治疗起点,以患者好转出院日期为治疗终点,收集所有研究对象的基本信息及实验室数据,包括性别、年龄及两组患者治疗过程中血浆使用总量;治疗前、治疗2周时及出院时TBIL、丙氨酸氨基转移酶(alanine amiotransferase,ALT)、PT、INR、CRP、IL-6、IL-8,消化道症状(乏力、食欲减退、腹胀等)改善时间,TBIL降至肝衰竭诊断临界值之下所需时间,住院时间、DPMAS治疗次数及各种并发症的发生率。
1.4 统计学方法采用SPSS 23.0软件进行统计分析,计数资料用百分比和例数表示,用χ2检验;计量资料用表示,治疗前后比较采用配对样本t检验,两组间比较采用独立样本t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者一般临床资料比较入选患者共38例,均治疗好转出院。观察组20例,其中男16例(83.33%),平均年龄为(50.30±9.04)岁,血浆使用总量30 800 mL,平均(1 540.00±528.55)mL;对照组18例,其中男15例(80.00%),平均年龄为(49.83±9.28)岁,血浆使用总量29 100 mL,平均(1 616.67±536.05)mL;两组性别、年龄及血浆使用量差异无统计学意义(分别为χ2=0.070,P=0.791;t=-1.57,P=0.876;t=0.443,P=0.660),具有可比性。2组患者均根据病情不同,3~4 d进行1次DPMAS治疗,其中观察组共进行治疗60例次,对照组共进行76例次。
2.2 两组患者生化指标比较两组患者治疗前血清TBIL、ALT、PT、INR、CRP、IL-6及IL-8比较,差异无统计学意义(分别为t=-0.396,P=0.694;t=0.707,P=0.484;t=-0.862,P=0.394;t=-0.618,P=0.541;t=0.075,P=0.941;t=-0.108,P=0.914;t=-0.405,P=0.688);治疗2周时,两组间血清TBIL、CRP、IL-6及IL-8水平比较,差异有统计学意义(分别为t=4.572,P<0.001;t=6.548,P< 0.001;t=2.416,P=0.024;t=3.026,P=0.005),两组间血清ALT、PT及INR水平比较,差异无统计学意义(分别为t=0.711,P=0.482;t=0.906,P=0.371;t=0.619,P=0.540);与治疗前比较,两组患者在治疗2周时、出院时血清TBIL、ALT、PT、INR、CRP、IL-6及IL-8水平均显著减低,差异有统计学意义(均P<0.001);出院时,两组间患者血清TBIL、ALT、PT、INR、CRP、IL-6及IL-8比较,差异无统计学意义(分别为t=1.878,P=0.069;t=0.365,P=0.717;t=1.363,P=0.181;t=1.391,P=0.173;t=0.659,P=0.514;t=0.609,P=0.547;t=-0.052,P=0.959)。见表1。
表1 两组患者治疗前后各生化指标比较Tab.1 Comparison of biochemical parameters between the two groups before and after treatment ±s
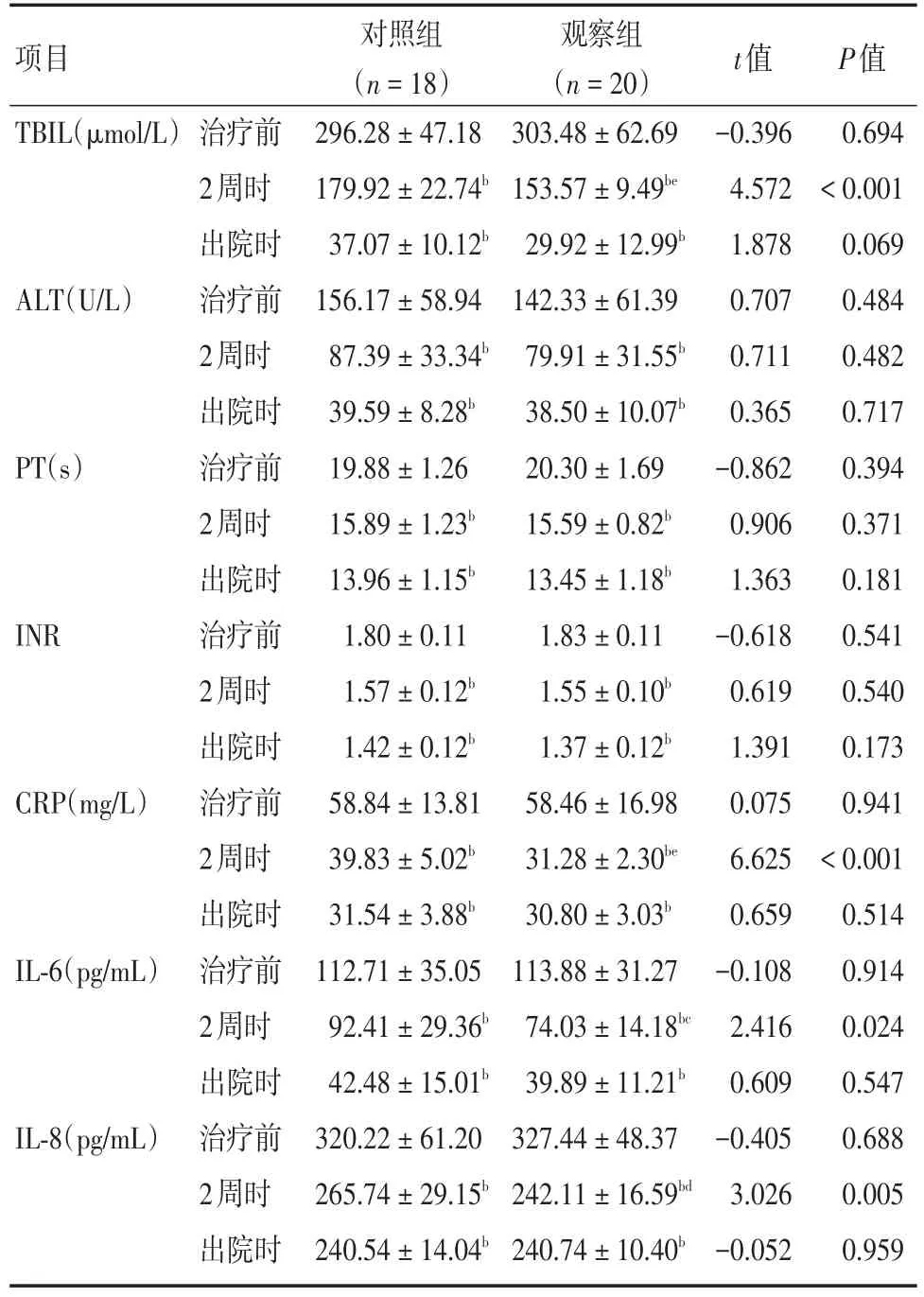
表1 两组患者治疗前后各生化指标比较Tab.1 Comparison of biochemical parameters between the two groups before and after treatment ±s
注:与同组治疗前比较,aP<0.01,bP<0.001;2周时、出院时与对照组比较,cP<0.05,dP<0.01,eP<0.001
项目TBIL(μmol/L)ALT(U/L)PT(s)INR CRP(mg/L)IL-6(pg/mL)IL-8(pg/mL)治疗前2周时出院时治疗前2周时出院时治疗前2周时出院时治疗前2周时出院时治疗前2周时出院时治疗前2周时出院时治疗前2周时出院时对照组(n=18)296.28±47.18 179.92±22.74b 37.07±10.12b 156.17±58.94 87.39±33.34b 39.59±8.28b 19.88±1.26 15.89±1.23b 13.96±1.15b 1.80±0.11 1.57±0.12b 1.42±0.12b 58.84±13.81 39.83±5.02b 31.54±3.88b 112.71±35.05 92.41±29.36b 42.48±15.01b 320.22±61.20 265.74±29.15b 240.54±14.04b观察组(n=20)303.48±62.69 153.57±9.49be 29.92±12.99b 142.33±61.39 79.91±31.55b 38.50±10.07b 20.30±1.69 15.59±0.82b 13.45±1.18b 1.83±0.11 1.55±0.10b 1.37±0.12b 58.46±16.98 31.28±2.30be 30.80±3.03b 113.88±31.27 74.03±14.18bc 39.89±11.21b 327.44±48.37 242.11±16.59bd 240.74±10.40b t值-0.396 4.572 1.878 0.707 0.711 0.365-0.862 0.906 1.363-0.618 0.619 1.391 0.075 6.625 0.659-0.108 2.416 0.609-0.405 3.026-0.052 P值0.694<0.001 0.069 0.484 0.482 0.717 0.394 0.371 0.181 0.541 0.540 0.173 0.941<0.001 0.514 0.914 0.024 0.547 0.688 0.005 0.959
2.3 治疗2周时两组各生化指标下降率的比较治疗2周时观察组血清TBIL、CRP、IL-6及IL-8的下降率同对照组比较显著升高,差异有统计学意义(分别为t=-5.850,P<0.001;t=-2.241,P=0.031;t=-3.917,P<0.001;t=0.086,P=0.039),血清ALT、PT及INR的下降率同对照组比较,差异无统计学意义(分别为t=-0.704,P=0.486;t=-1.290,P=0.205;t=-1.124,P=0.269)。见表2。
表2 两组治疗前和治疗2周时各生化指标下降率的比较Tab.2 Comparison of the decline rates of biochemical indicators between the two groups before treatment and at 2 weeks of treatment ±s
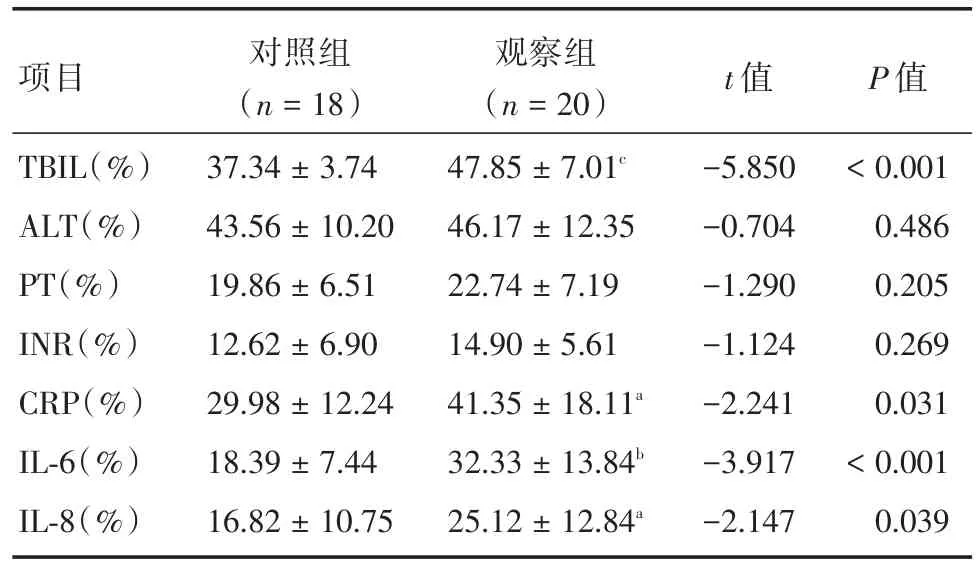
表2 两组治疗前和治疗2周时各生化指标下降率的比较Tab.2 Comparison of the decline rates of biochemical indicators between the two groups before treatment and at 2 weeks of treatment ±s
注:与对照组比较,aP<0.05,bP<0.01,cP<0.001
项目TBIL(%)ALT(%)PT(%)INR(%)CRP(%)IL-6(%)IL-8(%)对照组(n=18)37.34±3.74 43.56±10.20 19.86±6.51 12.62±6.90 29.98±12.24 18.39±7.44 16.82±10.75观察组(n=20)47.85±7.01c 46.17±12.35 22.74±7.19 14.90±5.61 41.35±18.11a 32.33±13.84b 25.12±12.84a t值-5.850-0.704-1.290-1.124-2.241-3.917-2.147 P值<0.001 0.486 0.205 0.269 0.031<0.001 0.039
2.4 两组患者消化道症状改善时间、TBIL降至肝衰竭诊断临界值之下的时间、平均住院时间、DPMAS治疗次数比较观察组消化道症状(乏力、腹胀、呕吐)改善时间、TBIL降至肝衰竭诊断临界值之下的时间、平均住院时间、DPMAS治疗次数均较对照组减少,差异有统计学意义(分别为t=10.767,P<0.001;t=5.398,P<0.001;t=5.913,P<0.001;t=2.920,P=0.007)。见表3。
表3 38例患者一般临床资料的比较Tab.3 Comparison of general clinical data of 38 patients ±s

表3 38例患者一般临床资料的比较Tab.3 Comparison of general clinical data of 38 patients ±s
注:与对照组比较,aP<0.01,bP<0.001
组别对照组观察组t值P值例数18 20消化道症状改善时间(d)10.11±2.49 3.20±1.15b 10.767<0.001 TBIL<171.0 mmol/L所需时间(d)19.92±2.81 15.25±1.33b 5.398<0.001住院时间(d)59.25±8.06 44.20±4.62b 5.913<0.001 DPMAS次数4.22±1.52 3.00±0.97a 2.920 0.007
2.5 两组患者并发症发生率比较观察组中有1例患者在激素治疗第13天出现肺部真菌感染,另3例为普通细菌感染,对照组中的4例患者均为普通细菌感染,两组患者出现肺部感染后均未停用激素,在对症抗感染治疗后好转;两组共有17例患者出现腹水,其中14例出现自发性细菌性腹膜炎,均在输注白蛋白及积极抗感染后得以好转;两组共有5例患者出现肝肾综合征,均在特利加压素联合白蛋白治疗后好转。两组患者肺部感染、自发性细菌性腹膜炎、腹水、肝肾综合征的发生率比较,差异无统计学意义(分别为χ2=0.329,P=0.566;χ2=0.181,P=0.671;χ2=0.001,P=0.973;χ2=0.368,P=0.544)。见表4。
3 讨论
HBV相关ACLF是在慢性乙型肝炎基础上发展形成的一种肝功能急剧失代偿表现,近年来出现的DPMAS技术通过串联两种吸附剂的组合应用,在胆红素吸附治疗的基础上同时吸附中大分子毒素。有研究[9-10]表明这种全新的组合方式,可快速吸附胆红素,清除炎症介质,为肝细胞再生提供有利的条件。另一方面,糖皮质激素作为传统免疫抑制剂,虽然在酒精性肝衰竭、自身免疫性肝炎所致肝衰竭中的应用已有一定的共识[11-12],但因HBV相关ACLF的发病机制与上述肝衰竭类型有所不同,糖皮质激素在HBV相关ACLF患者中的应用经历了由盲目推崇到一味排斥,再到有条件的接受这一过程[13]。
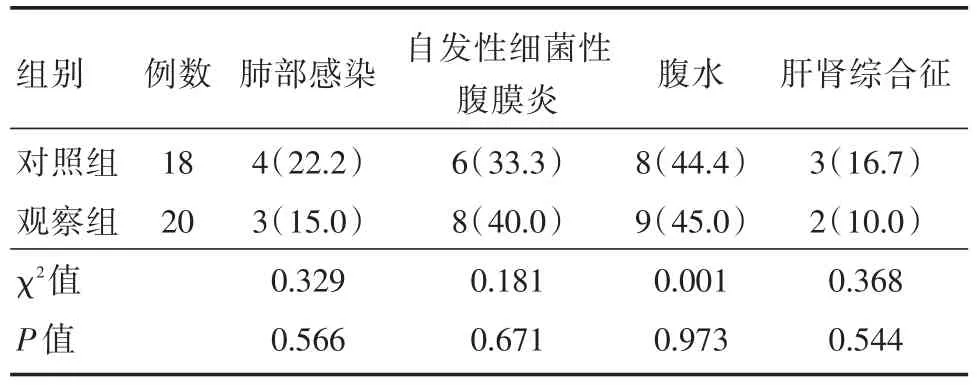
表4 两组患者各种并发症发生率比较Tab.4 Comparison of the incidence of various complications in the two groups of patients 例(%)
ANASTASIOU等[14]研究表明糖皮质激素可以显著降低肝衰竭患者的血清TBIL水平,改善患者预后。在本研究中激素的使用方法参考了龙云等[8]文献中所述的激素递减疗法,笔者分析了DPMAS技术联合糖皮质激素治疗HBV相关ACLF的临床疗效,结果显示,两组患者在治疗2周时、出院时血清TBIL和ALT同治疗前比较均明显下降,虽然出院时两组间血清TBIL和ALT比较,差异无统计学意义(分别为P=0.069,P=0.717),但治疗2周时两组间血清TBIL比较,差异有统计学意义(P<0.001);表明单纯DPMAS和DPMAS联合糖皮质激素治疗均可有效降低ACLF患者血清TBIL水平,但是激素的联用可在治疗前期(前2周)更高效、快速地清除血清TBIL水平,这与ANASTASIOU等[14]的结果一致。需要强调的是,肝脏作为胆红素代谢的最主要器官,当肝衰竭发生后,短时间内大量肝细胞的变性、坏死,会引起肝细胞对胆红素的摄取、转化及排泄障碍;而糖皮质激素不仅可以稳定肝细胞膜,阻止肝细胞进一步坏死,还可以抑制T细胞和B细胞的功能,抑制单核巨噬细胞释放的多种炎性介质,进而阻止或延缓免疫介导的肝损伤[4]。
WATANABE等[15]研究表明短疗程大剂量糖皮质激素可快速降低重型酒精性肝炎患者的IL-6、IL-8及TNF-α等炎症因子水平。而这些炎性因子可诱导肝细胞坏死和凋亡,但糖皮质激素可通过抑制相关基因的转录,下调NLRP3炎性小体的表达,达到抑制各种炎症因子的合成和减少炎症因子释放的作用[16-18]。在本研究中采用激素递减疗法,结果显示治疗2周时观察组血清IL-6及IL-8较对照组明显降低,差异有统计学意义(P=0.024,P=0.005),表明激素递减疗法同样可以显著降低炎症因子的水平。另外CRP作为肝脏在炎症和组织坏死发生6 h后合成的一种急性期反应产物,其在ACLF患者中的水平要明显高于慢乙肝患者及正常人,而这对ACLF患者感染的诊断、疗效观察及预后判断有较高的临床意义[19]。WATANABE等[15]应用短疗程大剂量糖皮质激素冲击治疗重型酒精性肝炎3 d后停用激素,所有患者均出现CRP的反弹;而本研究中采用激素递减疗法在治疗2周时观察组血清CRP水平明显低于对照组,差异有统计学意义(P<0.001),且在整个治疗过程中,均未出现过CRP反弹的现象,表明激素递减疗法相对于短疗程大剂量激素冲击治疗更为安全有效。笔者进一步分析在治疗2周时两组各生化指标的下降率发现,两组TBIL下降率比较(P<0.001),CRP下降率比较(P=0.031),IL-6下降率比较(P<0.001),IL-8下降率比较(P=0.039),差异均有统计学意义;这进一步佐证了激素的联用可在治疗前2周更高效、快速地清除各种炎症因子水平,从而改善肝功能及其局部微环境。
由于临床上血浆的供应紧缺,一定程度上限制了血浆置换治疗的开展,有研究[3,10]表明DPMAS在改善HBV相关ACLF患者12周存活率方面和治疗性血浆置换相似,且能有效改善肝功能,显著清除炎症因子,克服血浆缺乏和过敏等缺点,可作为血浆置换的替代治疗。在本研究中所有患者在行DPMAS术后即时凝血功能均表现为PT较前延长,INR较前升高的现象,这可能是因为肝素钠的运用,也可能是吸附剂非特异性地吸附了血浆中的部分凝血因子。为降低出血风险,在DPMAS术后笔者及时予以静脉输注血浆治疗,在治疗2周时两组间血清PT及INR水平比较,差异均无统计学意义(分别有P=0.371,P=0.540),两组(对照组和观察组)在治疗过程中的平均血浆使用量[(1 616.67 ± 536.05)mLvs.(1 540.00 ± 528.55)mL,P=0.660],差异无统计学意义,且在治疗2周时及出院时两组患者PT均较治疗前缩短,INR水平均较治疗前下降(均P<0.001),表明激素递减疗法对凝血功能无明显影响,在行静脉输注血浆后两组患者凝血功能均得到改善。
此外,邱波等的研究表明小剂量糖皮质激素治疗可显著改善HBV相关ACLF患者的精神、食欲状况,并降低了患者的胆红素水平,显著缩短了疗程,减少住院费用。在本研究中,观察组患者消化道症状(乏力、食欲减退、腹胀等)改善所需时间,TBIL降至肝衰竭诊断临界值之下所需时间,住院时间及DPMAS治疗次数均较对照组明显减少,差异有统计学意义(分别P<0.001、P<0.001、P<0.001、P=0.007),说明激素递减疗法的联用可以快速缓解患者消化道症状,快速降低血清胆红素水平,减少人工肝治疗次数和缩短住院时间的临床优势,不仅为患者节约了治疗费用,而且有助于提高患者的临床疗效,这与邱波等的研究结果相似。但是,长期大剂量使用糖皮质激素可以促进病毒复制[20],导致感染加重及出血等并发症的发生。本研究两组患者肺部感染、自发性细菌性腹膜炎、腹水及肝肾综合征并发症的发生率比较,差异无统计学意义(分别P=0.566,P=0.671,P=0.973,P=0.544),但观察组有1例患者发生的肺部真菌感染,另2例为普通细菌感染,分析原因,可能是糖皮质激素的应用增加了合并真菌感染的风险,这也是应用糖皮质激素的最大担忧。
综上所述,本研究首次分析了DPMAS联合糖皮质激素递减疗法治疗在HBV感染相关的ACLF疾病中的疗效;结果表明,在DPMAS基础上联用激素递减疗法可以更快速的降低HBV感染相关的ACLF患者的血清TBIL、CRP、IL-6及IL-8的水平,并可快速改善患者消化道症状,缩短住院时间,减少DPMAS治疗次数,显著改善患者病情且不会增加患者感染风险和并发症的发生率。但本研究尚有不足之处,即未将治疗过程中死亡的患者纳入研究,且病例数较少,这对本文的准确性都造成了不可忽视的影响;因此,本研究的结论仍需要更多大样本量的实验和分析去验证。另外,目前糖皮质激素在治疗肝衰竭方面的应用尚未形成统一的方案,如何在提高肝衰竭治疗效果的同时,最大限度的减少真菌感染及其他并发症的发生,有待进一步研究,以求得到更合理、安全地应用于临床。
