Luminal型乳腺癌中PD-L1的表达特点及预测价值
2020-01-16郝语晨毕恺欣刘晓青徐毅陶新楠张亚芬山西医科大学太原030000山西医科大学附属人民医院太原0300
郝语晨 毕恺欣 刘晓青 徐毅 陶新楠 张亚芬山西医科大学(太原030000);山西医科大学附属人民医院(太原0300)
国际癌症研究中心发布的2018年全球癌症统计报告显示乳腺癌居于全球女性癌症发病率首位,而我国人口基数庞大是不容忽视的乳腺癌大国[1]。根据世界癌症生存研究CONCORD发布的最新数据,我国乳腺癌年龄标化生存率为83.2%,比澳大利亚、美国等西方发达国家的同期数据落后6%左右[2],延长生存时间、降低病死率是我国乳腺癌疾病管理的重点。PD-1/PD-L1检查点(programmed cell death-1/programmed death ligand-1 checkpoint)及其抑制剂是最近几年肿瘤免疫学中备受瞩目的研究热点[3-4],其理论基础是肿瘤的免疫逃逸机制:正常生理条件下,人体免疫系统存在促进自我耐受防止自身免疫的机制,即T细胞被激活时其表面PD-1表达增加,而攻击性炎症因子IFN-γ、TNF-α等刺激特异性免疫细胞表达其配体PD-L1和PD-L2,其中主要为PD-L1,当PD-1与其配体PD-L1结合时,经过一系列酶联反应抑制下游的PI3K/AKt/mTOR通路,进而抑制T细胞功能,而肿瘤细胞恰恰习得这种逃避免疫攻击的方法,在其细胞表面大量表达PD-L1,实现免疫逃逸,参与肿瘤增殖、侵袭、转移等恶性生物学行为[5-6]。
肿瘤组织中肿瘤细胞和肿瘤浸润淋巴细胞(tumor infiltrating lymphocytes,TILs)均有PD-L1表达[5-6],本研究关注PD-L1在上述两类细胞的表达特点,分别探索对生存预后有无预测价值。PD-L1在三阴性、Her-2过表达型乳腺癌的预后预测价值已被大量研究[7-13]证实,即PD-L1表达越多,提示预后越差。然而三阴性、Her-2过表达型并非最常见亚型,仅占乳腺癌总体的不到30%,上述研究发现的普适意义有限,因此笔者认为,进一步研究最常见亚型(即Luminal型)对临床的预后预测和治疗指导意义更大。为避免Her-2阳性患者赫赛汀治疗不规范影响预后分析,本研究仅纳入Luminal(Her-2阴性)型病例。
1 资料与方法
1.1 一般资料本研究为历史前瞻性研究。本研究入组2013年1-12月于山西省人民医院乳腺外科住院治疗的乳腺浸润性导管癌病例。纳入标准:(1)女性;(2)乳腺癌分期较早可行规范手术治疗者;(3)病理类型为浸润性导管癌;(4)分子类型为Luminal(Her-2阴性)型;(5)相关病例资料完善。排除标准:(1)本次诊断为双侧乳腺癌;(2)既往或本次治疗期间有乳腺或其他原发恶性肿瘤病史;(3)因患者无法承受或患者意愿等行姑息性手术者;(4)内分泌治疗不规范。
1.2 方法
1.2.1 临床数据年龄(以身份证出生年月为准);月经状态(绝经定义为双侧卵巢切除术后/年龄≥60岁/年龄<60岁,自然停经≥12个月/FSH和雌二醇处于绝经后范围);乳腺/妇科合并症(定义为乳腺纤维瘤、乳管内乳头状瘤/子宫肌瘤、卵巢囊肿等与雌性激素紊乱相关的乳腺/妇科良性疾病);家族史(定义为直系亲属有恶性肿瘤病史)。
1.2.2 病理数据病理学分级、ER%、PR%、TIL%、Ki-67、TNM分期(依据AJCC第九版,记为Ⅰ/Ⅱ/Ⅲ期)、分子分型[将Luminal型分为Luminal A型,即ER和/或PR阳性、Ki-67<14%且Her2阴性;Luminal B(Her2-),即ER和(或)PR阳性、Ki-67≥14%且Her2阴性]。
1.2.3 治疗情况手术时间及方式、术后辅助治疗类型、具体药物方案。
1.3 免疫组化本研究采用免疫组化二步法。PD-L1抗体试剂选用中山金桥兔单克隆一抗,克隆号为SP142。PD-L1在肿瘤细胞膜和/或细胞质表达记为TC(tumor-cell),在TILs表达记为IC(immuno-cell),采用David E等的评分方法[14],即计算PD-L1表达细胞在肿瘤区域的占比,以百分比表示(即TC%/IC%);选取1%、5%、10%为截点,即<1%记为TC/IC0分,≥1%且<5%记为TC/IC1分,≥5%且<10%记为TC/IC2分,≥10%记为TC/IC3分。TC和IC的cut-off值均为1,即0分为阴性表达,1、2、3分为阳性表达。
查阅病理报告并记录病理学分级,调取原始H&E切片判读ER%、PR%、Her-2±FISH、Ki-67、TIL%。ER、PR判读参照我国《乳腺癌雌、孕激素免疫组织化学检测指南(2015版)》。Her-2判读采用2017年ASCO-CAP会议发布的最新指南[15]。TILs%判读根据国际TILs工作组2015年版的推荐进行[16]。阅片结果由高年资病理科医师审核确认。
ER%、PR%、Ki-67采用SOFT&TEXT试验[17]的截点进行分层,即:ER%分层为<50、≥50;PR%分层为<20、20~ 49、≥ 50;Ki-67分层为<14、14~ 19、20~25、≥26。病理学分级分为1/2/3级。TIL%选取30%、60%为截点,即<30%记为TIL(1+),≥30%且<60%记为TIL(2+),≥60%记为TIL(3+)。
1.4 随访通过电话、门诊等方式随访患者院外内分泌治疗情况及生存情况。生存事件定义为与乳腺癌疾病进展相关的死亡。随访时间为开始内分泌治疗到内分泌治疗满5年。计算总生存期(overall survival,OS)。
1.5 统计学方法使用SPSS 25.0进行分析,计量资料以均数±标准差表示,对其进行正态性检验,符合正态性分布者进行独立样本t检验,不符合正态性分布者进行秩和检验。计数资料以率(%)表示,采用χ2检验。运用Cox生存分析判断复发和生存预后的独立因素。运用Kaplan-Meier法绘制生存曲线,生存率的比较使用Log-rank检验。以P<0.05为差异具有统计学意义。
2 结果
2.1 一般资料本研究共纳入225例Luminal型乳腺浸润性导管癌患者,年龄21~78岁,平均(51.17±11.32)岁,中位年龄50岁;左乳癌109例,右乳癌117例。5年生存率为88.9%(200/225)。OS事件23例;删失19例,其中16例失访,3例死于其他疾病。
2.2 肿瘤组织中PD-L1表达特点PD-L1在肿瘤细胞和TILs均有表达,见图1。225个样本中有86(38.2%)个样本的肿瘤细胞PD-L1阳性表达,24(10.7%)个样本的TILs PD-L1阳性表达。纳入指标的赋值见表1。

图1 PD-L1在乳腺癌组织的表达Fig.1 PD-L1 expression in breast cancer tissue

表1 相关因素赋值说明Tab.1 Related factors and assignment instructions
2.2.1 PD-L1的表达与临床指标的关系对年龄、月经状态、合并症、家族史、分期分析显示:肿瘤细胞和TILs中PD-L1的表达仅在不同分期时差异具有统计学意义,见表2。
2.2.2 PD-L1的表达与病理指标的关系对ER%、PR%、Her2状态、TIL评分、Ki-67、分子分型统计学分析显示,不同PR%、TIL评分、Ki-67、分子分型的PD-L1在肿瘤细胞和TILs的表达差异具有统计学意义(P<0.01),另外ER%(P=0.046)也是TILs中PD-L1表达的影响因素,见表3。
2.3 Cox回归分析计算生存状态的危险因素,由结果可见,IC评分(RR=2.375,P<0.01)、PR(RR=0.926,P<0.01)、Ki-67(RR=1.026,P=0.01)和病理学分级(RR=4.137,P<0.01)是生存的独立危险因素,而TC评分在单因素分析时有意义,多因素分析时差异无统计学意义,说明其受其他混杂因素影响,不能独立影响生存预后。见表4。
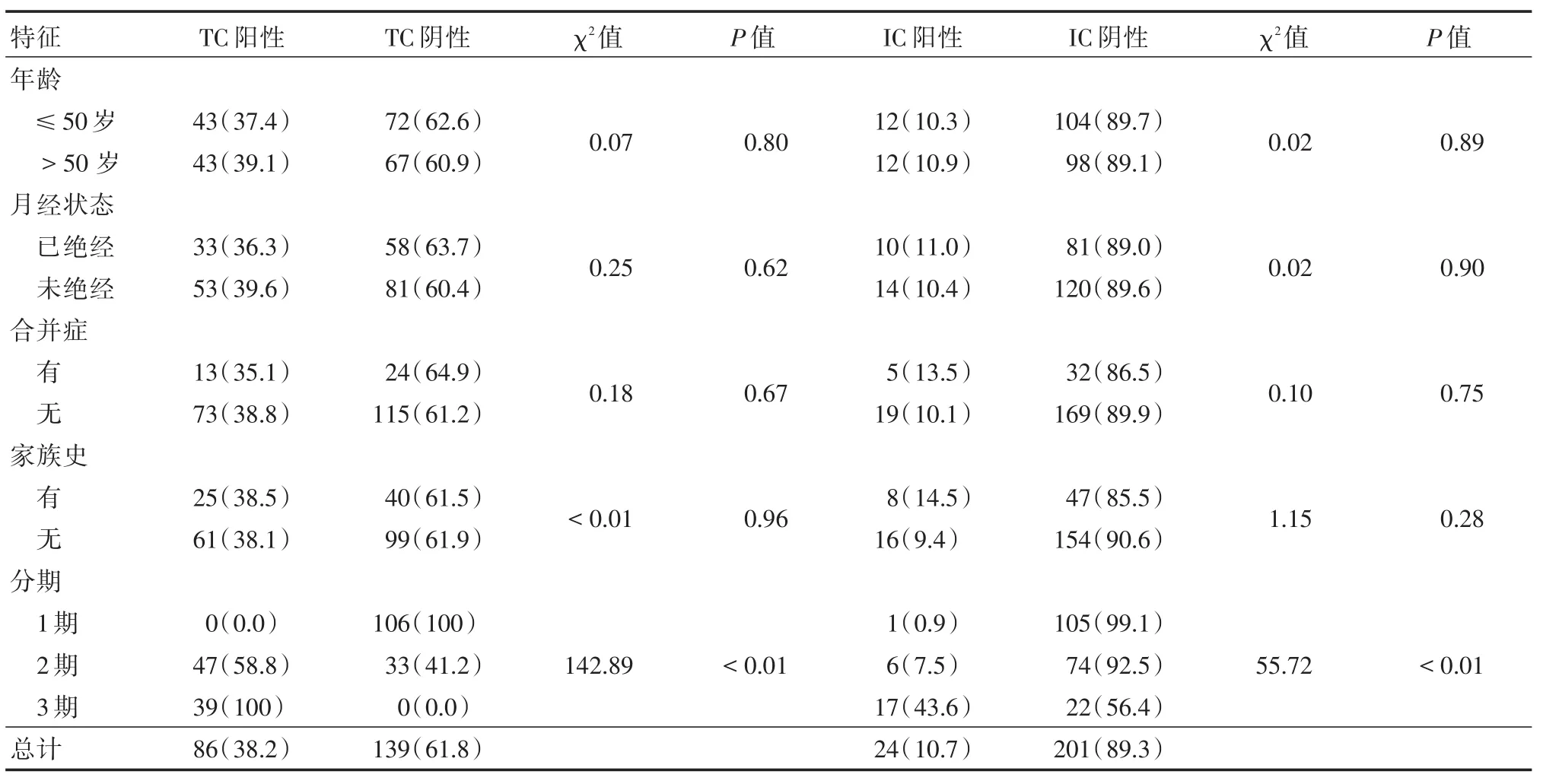
表2 PD-L1表达与临床指标的关系Tab.2 Relationship between PD-L1 expression and clinical indicators 例(%)

表3 PD-L1表达与病理指标的关系Tab.3 Relationship between PD-L1 expression and pathological indicators 例(%)

表4 生存状态的危险因素分析Tab.4 Risk factor analysis of survival status
2.4 生存情况的比较对生存情况分析发现,IC阳性组患者生存率为37.5%(9/24),低于IC阴性组患者生存率96.0%(193/201),差异具有统计学意义(χ2=117.7,P<0.001)。生存曲线见图2。
3 讨论

图2 IC阴性组(n=201)和阳性组(n=24)(TILs中PD-L1表达阴性/阳性)的生存曲线Fig.2 Survival curves of IC negative group(n=201)and positive group(n=24)(negative/positive PD-L1 expression in TILs)
既往研究[7,12,18-19]报道 PD-L1 在 Luminal型乳腺癌细胞的阳性率为14.8%~53.1%,本研究中PD-L1在肿瘤细胞阳性率为38.2%,与上述报道基本一致。之前的研究[12,18,20]仅统计肿瘤细胞中PD-L1的表达,或不区分肿瘤细胞和TILs,笼统地记为肿瘤组织的表达[21],据笔者所知,大部分学者没有关注PD-L1在TILs的表达并作为一个独立指标进行研究,因而其阳性率鲜有报道。笔者认为肿瘤微环境的主要有形成分为肿瘤细胞和TILs,综合考虑两者的PD-L1表达情况不仅能反映肿瘤的免疫逃逸能力,而且能够研究免疫系统的应答状态,与单独研究肿瘤细胞相比更为严谨科学。目前肿瘤细胞阳性表达的判读标准不尽相同,有的研究[7,21]仅认可细胞膜的着色,而有的研究[10,12,18,22]将细胞膜和/或细胞质的着色均判定为阳性表达,因此相关研究结果可比性较低,难以汇总分析形成大数据支持的结论,亟待统一公认的判读标准。
本研究发现:PD-L1表达水平与病理学分级、ER、PR、Ki-67、分期显著相关,PD-L1阳性组织较阴性组织病理学分级较高、ER%较低、PR%较低、TIL评分较高、Ki-67较高、分期较晚,Luminal B(Her2-)型阳性率显著高于Luminal A型,换言之,无论肿瘤组织或TILs中,PD-L1阳性均提示肿瘤恶性程度较高,预后预期较差,这一结论可用肿瘤免疫逃逸来解释。
单因素和多因素生存分析均显示TIL不是生存的影响因素,与其他研究[8,23-24]的发现一致。而χ2检验提示不同TILs评分组织的PD-L1表达显著不同,TILs中PD-L1的表达是死亡的独立危险因素,因此笔者推测结合TILs和PD-L1能够提供预后预测的额外信息。本研究发现TILs中PD-L1表达是生存的独立危险因素,肿瘤细胞的PD-L1表达仅在单因素生存分析时是独立危险因素,而Luminal A型和Luminal B Her2-型的PD-L1在肿瘤细胞和TILs的表达情况差异具有统计学意义,因此笔者考虑该结论与入组人群中Luminal A型和Luminal B Her2-型相对比例有关,后续研究将对Luminal型进一步细化分析。
PR状态、Ki-67和病理学分级是公认的预后预测因素。PAN等[25]对EBCTCG数据库中500 692例激素受体阳性早期乳癌患者内分泌治疗5年后20年随访研究发现,淋巴结状态在任意时间段都是强预测因子,组织学分级和Ki-67是最初5年预后的重要独立预测因子,但在后续时间段仅具有中等预测效力。ORUCEVIC等[26]根据TAILORx研究的最新结果对复发预测风险评分检验,纳入年龄、肿瘤大小、病理学分级、PR状态和组织学类型分析发现病理学分级和PR状态是5个临床病理特征中复发风险评分高低的最强预测因素。本研究对纳入人群随访5年,生存分析结果与上述研究相一致,由于Luminal型乳腺癌与其他亚型相比5年后仍有较高复发率,笔者将继续随访以获取各个时间段肿瘤浸润淋巴细胞PD-L1表达预测意义的变化。
肿瘤细胞和免疫细胞都能激活PD-1/PD-L1检查点,上调PD-L1的表达,负性调节抗肿瘤免疫反应[20]。目前研究较为透彻的机制主要为两条信号通路的激活[27]:PI3K/AKt/mTOR激活介导的细胞内信号通路和IFNGRs/JAK/STAT激活介导的细胞外信号通路。CHEN等[28]报道IFNγ上调外泌体PD-L1表达水平,抑制免疫和促瘤生长;外泌体PD-L1水平变化能够预测治疗后肿瘤细胞对T细胞再活化的适应性反应水平。笔者认为,TILs和外泌体中的PD-L1水平都能反映肿瘤与免疫系统抗衡的结果,其变化规律是治疗反应性的重要预测因子,对指导临床工作具有重要意义,例如对于需要新辅助治疗的晚期乳腺癌患者,穿刺获取组织中PD-L1的表达情况,为患者初始治疗时选择的个体化治疗方案,未来条件允许时,密切检测血液中PD-L1水平变化,掌握免疫系统受压制程度变化,及时调整用药选择。
综上,PD-L1在TILs的表达对生存预后具有一定的预测价值,可为临床医师预后判断及治疗选择提供一定指导。
