川南地区乳腺癌患者人表皮生长因子受体2基因状态及其蛋白表达与临床病理特征的关系
2020-01-16罗斯译柴利阮思蓓凌凤李昕高子清李丽杨志惠唐明希西南医科大学四川泸州644000西南医科大学附属医院病理科四川泸州644000广东省妇女儿童医疗中心儿科研究所广州50000
罗斯译 柴利 阮思蓓 凌凤 李昕 高子清 李丽 杨志惠 唐明希西南医科大学(四川泸州644000);西南医科大学附属医院病理科(四川泸州644000);广东省妇女儿童医疗中心儿科研究所(广州50000)
乳腺癌为全球女性最常见的恶性肿瘤,已成为全球主要的公共卫生问题之一[1-2]。本文通过国内最新指南《乳腺癌HER2检测指南(2019版)》再评价IHC和FISH检测结果的一致性,并评估新版指南人类表皮生长因子受体2(HER-2)基因状态和蛋白表达及与各临床病理特征关系,为乳腺癌患者正确选择治疗方案和预后评估提供重要参考。
1 资料与方法
1.1 病例资料选取2010年11月-2019年6月经西南医科大学附属医院病理科确诊为浸润性乳腺癌并进行FISH和IHC检测的女性乳腺癌患者1 182例。组织标本主要来源于泸州、宜宾、内江、自贡等川南地区。标本类型为乳腺癌根治手术切除标本1 067例和粗针穿刺标本115例。年龄17~90岁,平均(45.07±9.54)岁。选取的所有病例均有完整FISH报告记录和ER、PR、HER-2/neu等IHC切片以及年龄、肿瘤大小、组织学分级等临床病理资料。根据《乳腺癌HER2检测指南(2019版)》和《乳腺癌HER2检测指南(2014版)》指南中IHC和FISH判读标准对所有病例进行再判读和差异统计分析,FISH再判读主要通过查阅检测报告记录,IHC再判读由2名副教授复阅切片完成。
1.2 试剂与探针IHC中ER、PR和Her-2/neu检测使用罗氏公司抗体(ER克隆号:SP1;PR克隆号:1E2;Her-2/neu克隆号:4B5);Ki-67抗体(克隆号:MIB.I)由北京中杉金桥生物技术有限公司提供。FISH检测采用北京金普嘉公司HER-2基因扩增试剂盒。
1.3 方法
1.3.1 IHC法新鲜标本经10%中性福尔马林固定后石蜡包埋并连续切片3 μm,IHC操作按照En-Vision两步法操作说明进行,以PBS代替一抗作阴性对照。细胞核呈棕色或棕褐色为ER、PR、Ki-67阳性表达,细胞膜呈棕色为HER-2/neu阳性表达。
1.3.2 FISH法按照北京金普嘉公司HER-2基因扩增试剂盒操作说明进行FISH检测,具体的操作步骤如前述[3-4]。
1.4 结果判定
1.4.1 FISH结果判读按照《乳腺癌HER2检测指南(2019版)》[5]FISH判读标准对所有病例进行再评价,双探针FISH判读标准分以下5种情况:(1)第1组,HER2/CEP17比值≥ 2.0,且平均HER2拷贝数/细胞≥4.0;此种情况判为FISH阳性;此外,若HER2信号连接成簇时可直接判断为FISH阳性。(2)第2组,HER2/CEP17比值≥ 2.0,平均HER2拷贝数/细胞<4.0(此种情况需增加细胞计数,若结果不变,则FISH判读为阴性)。(3)第3组,HER2/CEP17比值< 2.0,平均HER2拷贝数/细胞≥ 6.0(此种情况需增加细胞计数,若结果不变,则判读为FISH阳性)。(4)第4组,HER2/CEP17比值< 2.0,平均HER2拷贝/细胞数≥4.0且<6.0(此种情况需增加细胞计数,若结果不变,需对两次结果进行综合判断分析。若仍为上述情况,此类患者需要结合IHC结果,若IHC结果为3+,HER2状态则为阳性。若IHC结果为0、1+或2+,HER2状态应判读为阴性)。(5)第5组,HER2/CEP17比值< 2.0,HER2拷贝/细胞数<4.0,此种情况判读为FISH阴性。
1.4.2 IHC结果判断HER-2/neu蛋白表达强度判读参照《乳腺癌HER2检测指南(2019版)》[5]进行。
1.5 统计学方法数据分析使用SPSS 17.0软件,采用Kappa检验对IHC和FISH检测结果进行一致性分析,HER2基因状态及蛋白表达与临床病理特征关系采用χ2检验及Spearman相关分析,以P<0.05为差异具有统计学意义。
2 结果
2.1 1 182例乳腺癌HER2/neu蛋白表达和HER-2基因扩增情况IHC法检测1 182例乳腺癌患者组织标本,HER-2蛋白表达(-)者22例(1.86%),(+)者146例(12.35%),(2+)者889例(75.21%),(3+)者125例(10.58%),HER-2/neu蛋白表达情况见图1。FISH检测HER-2基因扩增312例(26.40%),无扩增870例(73.60%),FISH检测情况见图2。
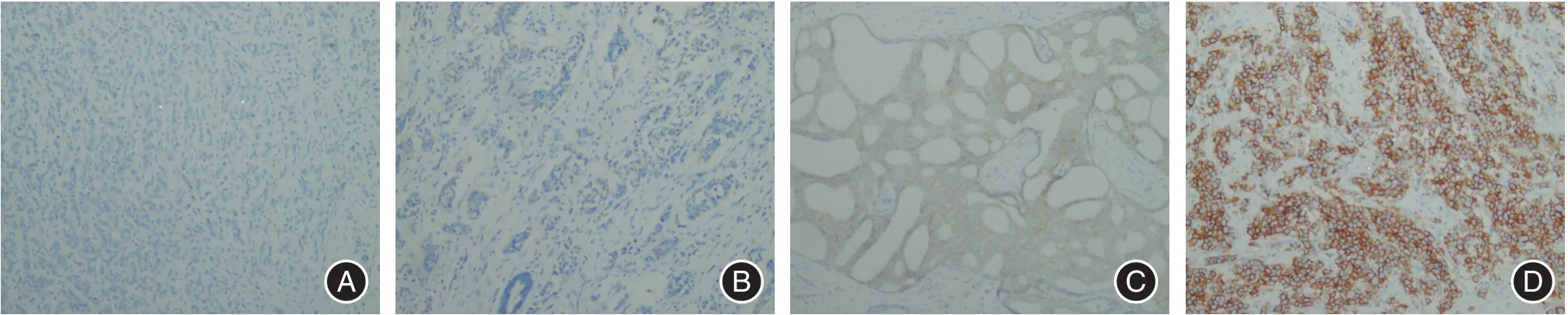
图1 HER-2/neu蛋白表达评分结果图Fig.1 IHC scored of Her-2/neu protein expression
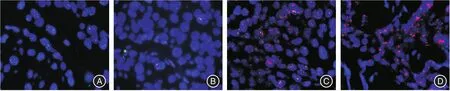
图2 FISH结果(CEP 17呈绿色,HER-2呈红色,FISH油镜×100)Fig.2 FISH results(CEP17 stained green and HER-2 gene stained red,FISH oil mirror× 100)
2.2 FISH检测乳腺癌组织HER2/neu蛋白表达与基因扩增结果比较在新标准下:IHC和FISH检测阴性符合率为100%;HER-2蛋白表达(+)与FISH检测阴性符合率为93.84%;HER-2蛋白表达(2+)与FISH检测阳性符合率为25.42%;HER-2蛋白表达(3+)与FISH检测的阳性符合率为61.60%。IHC和FISH检测结果总体一致率为40.06%,存在一致性(Kappa=0.089,P=0.000)且呈正相关(r=0.194,P=0.000),见表1。

表1 FISH及IHC检测HER-2基因状态和蛋白表达新旧指南一致率比较Tab.1 Comparison the coincidence rate of new and old standards for detection of HER-2 gene status and protein expression by FISH and IHC
2.3 1 182例乳腺癌HER-2基因扩增及HER2/neu蛋白表达与临床病理特征的相关性ER、PR、ER/PR表达状态、淋巴结转移数量与HER2基因扩增(χ2=169.047,P=0.000;χ2=73.931,P=0.000;χ2=79.883,P=0.000;χ2=7.752,P=0.021)及HER-2/neu蛋白表达(χ2=47.667,P=0.000;χ2=61.055,P=0.000;χ2=13.646,P< 0.05;χ2=11.472,P<0.05)差异具有显著性(组间比较用卡方检验);组织学分级与HER-2/neu蛋白表达正相关,而与HER2基因扩增无明显相关性。ER表达与HER2基因扩增及蛋白表达呈负相关(r=-0.360,P<0.001;r=-0.078,P< 0.05),PR、ER/PR状态与HER2基因扩增呈负相关(r=-0.248,P< 0.001;r=-0.256,P<0.001),与HER-2/neu蛋白表达无关(P>0.05)。此外,HER-2基因扩增与淋巴结转移数量呈正相关。HER-2/neu蛋白表达与肿瘤大小、组织学分级正相关,年龄与HER-2基因扩增及蛋白表达无相关性(P>0.05,表2)。
3 讨论
HER-2基因是一种具有酪氨酸激酶活性的185 kD跨膜糖蛋白受体,可与HER家族成员形成二聚体而使细胞内激酶活化而诱导细胞增殖[6],研究发现,约20%乳腺癌患者有HER-2的过表达,而HER-2过表达患者预后较差、转移风险高、生存期较短且对内分泌治疗和标准化疗治疗的效果均不佳[7]。但随着HER-2阳性乳腺癌治疗药物曲妥珠单抗及其联合药物的应用极大地改善了HER-2阳性患者的预后[8]。因此,能否正确检测和评估HER-2状态对乳腺癌治疗方案选择和预后评估极其重要,特别是抗HER-2阳性靶向治疗个体化方案的制定和疗效评估。
本研究结果显示,新指南下本地区HER-2总体蛋白表达阳性率为10.58%,低于杨雅洁(26.35%)[9]及周国江(21.25%)[10]等的报道,可能与本研究IHC(-/+)以及IHC(3+)样本量较少而以IHC(2+)为主有关。新指南下本地区HER-2基因阳性表达率26.40%,与国外报道的15%~30%[11]基本相符,略高于国内张虹等[12]报道的23.05%,但低于要建超(38%)[13]、国风(41.9%)[14]及周国江等报道的43.75%[10],一方面反映出与新指南结合了HER-2/CEP17比值、平均HER-2基因拷贝数及IHC对HER-2状态进行综合评估和取消“可疑”判读标准有关,同时,也不排除不同地区[15]及种族[16-17]间HER-2阳性表达率可能存在的差异。
新指南下FISH阴性和IHC(-)的符合率为100%,与本文旧标准结果一致,也与其他报道相符[13-14];FISH阴性和IHC(+)的符合率为93.84%,与旧标准本地区的92.46%和有研究[18]报道的100%,与要建超等[13]报道的93.30%基本一致,提示IHC(-/+)者与FISH结果高度一致;新标准下的FISH阳性和IHC(2+)符合率为25.42%,与GHEYBI等报道的 27.50%[19]及国风等报道的 28.63%[14]一致。本研究与LATEEF等[20]研究结果相同均认为对于IHC(2+)者需常规行FISH检测进一步准确评估HER-2状态;新标准下FISH阳性和IHC(3+)符合率为61.60%,与笔者旧标准的57.6%和笔者已经报道的 54.67%[4]、60.98%[21]及其周国江等报道的 58.82%[10]基本一致,但低于要建超等[13]报道的78.9%,这可能与本研究IHC(3+)样本量较少,且多为5年以前样本而与当时样本固定、IHC检测抗原修复法等因素有关。尽管在新旧指南中均认为IHC(3+)患者明确判读为阳性,但鉴于本研究中IHC(3+)和FISH阳性符合率较低(61.60%),且研究[22]认为FISH相对于IHC而言能更好识别HER-2/neu阳性病例,故IHC(3+)者也建议进一步做FISH检测以明确HER-2状态。因此,笔者认为IHC(2+/3+)者都应进一步行FISH检测,以完善诊断并指导治疗和判断预后。新指南考虑IHC对HER-2的影响,并取消了HER-2“可疑状态”的判读标准,使临床对乳腺癌患者靶向药物应用更加明确和完善。
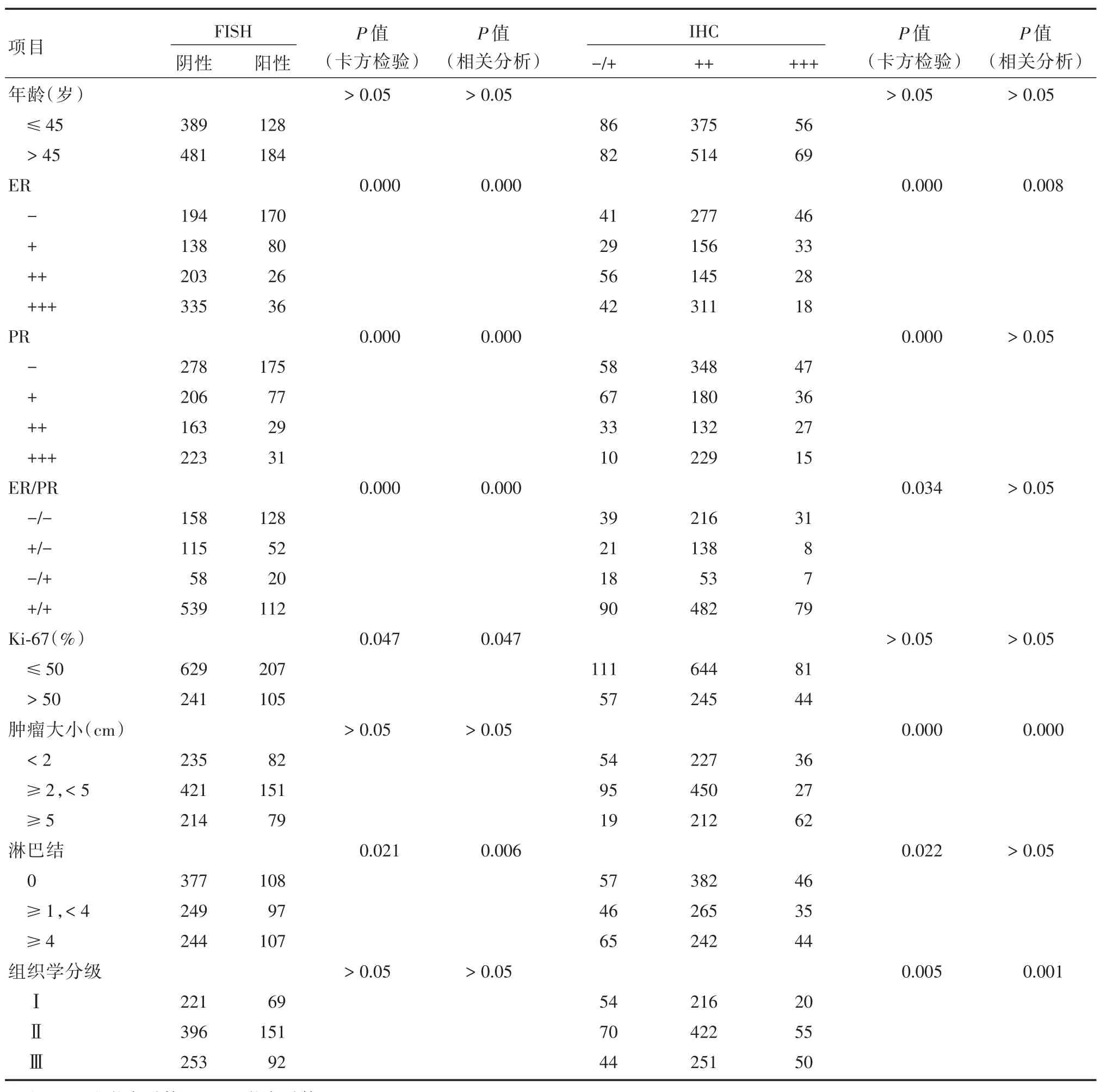
表2 Her-2/neu蛋白表达、HER-2基因状态与临床病理特征的相关性Tab.2 Association of HER-2/neu protein expression,HER-2 gene status and clinical-pathological characteristics 例
本研究中ER表达与HER-2基因扩增和HER-2/neu蛋白表达负相关,PR表达及ER/PR状态与HER2基因扩增呈负相关,以上相关性均与周国江等[10]和何春燕等[23]的报道一致,提示ER、PR表达阴性者其肿瘤预后较差可能与HER-2基因高表达及扩增率有关。此外,淋巴结转移数量与HER-2基因扩增呈正相关,与要建超等[13]的报道一致。另外,本研究还发现肿瘤大小和组织学分级与HER-2/neu蛋白表达呈正相关,与笔者的报道[4,21]、SHI等[24]及要建超等[13]的报道一致,可能与HER2基因扩增后肿瘤细胞增殖使瘤体增大、组织学分级增高有关。
综上,新旧指南下IHC(-/+)与FISH结果均高度一致,FISH仍是评价IHC(2+/3+)者HER-2基因扩增的标准方法。新指南结合了HER-2/CEP17比值、平均HER-2基因拷贝数、IHC对HER-2状态的影响,并取消了HER-2“可疑状态”的判读标准,提高了FISH检测的阴性率,使临床对患者的靶向用药及预后评估更为准确。由于本研究的具体例数有限,也不排除不同地域、不同年龄及不同种族对结果的影响,相关数据还需大量、长期、多中心的调查及临床疗效的评估,使患者对靶向药物的应用及预后评估更加有效和准确。
