乳腺癌中泛素蛋白连接酶E3A与泛素特异性蛋白酶25的表达及其临床意义
2020-01-16荣欣欣黄红梅李静佳侯令密刘家有李金穗谢少利杨懿邓世山川北医学院解剖教研室四川南充637000川北医学院附属医院甲状腺乳腺外科四川南充637000
荣欣欣 黄红梅 李静佳 侯令密 刘家有 李金穗 谢少利 杨懿 邓世山川北医学院解剖教研室(四川南充637000);川北医学院附属医院甲状腺乳腺外科(四川南充637000)
乳腺癌是女性最常见的癌症和死亡的主要原因。其中,中国乳腺癌死亡病例占全球的1/10,严重影响女性健康[1-2]。因而,寻找乳腺癌治疗的靶点或者新的思路成为乳腺癌研究的热点。人体蛋白质的降解途径主要有两种:溶酶体途径和泛素-蛋白酶体途径(UPP)。泛素-蛋白酶体系统由泛素、泛素活化酶(E1)、泛素连接酶(E2s)、泛素-蛋白连接酶(E3s)、26s蛋白酶体和去泛素化酶(DUBs)等组成。泛素蛋白连接酶E3A(ubiquitin protein ligase E3A,UBE3A)是泛素-蛋白连接酶(E3s)中的一员,主要作用是泛素化连接相关的靶蛋白,使其通过UPP途径被降解。泛素特异性蛋白酶25(ubiquitin specific protease 25,USP25)是一种去泛素化酶,能够去泛素化相关的底物蛋白,从而避免底物蛋白被UPP途径降解。UBE3A与USP25均为泛素蛋白酶体系统中的组成成员,其中UBE3A与天使综合征的关系密切[3-6],而在乳腺癌中的研究较少;USP25在炎症免疫反应中研究较多[7-9],而在乳腺癌中的作用尚未见报道。DENG等[10]通过限制性片段差异显示多聚酶链反应(RFDD-PCR)对泛素蛋白酶体组成部分进行研究发现,UBE3A与USP25在乳腺癌组织中均高表达(>3倍),但未对其在乳腺癌中的作用和它们之间的关系作具体研究。本课题通过免疫组化染色观察UBE3A与USP25在乳腺癌组织中的表达情况,并分析它们与乳腺癌临床病理特征之间的关系,为乳腺癌的临床研究及治疗提供思路。
1 材料与方法
1.1 材料
1.1.1 研究对象所有乳腺组织标本来自川北医学院附属医院甲状腺乳腺外科2017-2018年手术切除的组织,包括癌组织与邻近相对正常的组织,病理诊断均为浸润性导管癌,并收集了相关的临床、病理资料,共50例。患者年龄36~70岁,其中<60岁41例,≥60岁9例。癌组织病理分化程度分级:WHOⅠ级13例,WHOⅡ级25例,WHOⅢ级12例;TNM分期:Ⅰ期8例,Ⅱ期30例,Ⅲ期12例;有淋巴结转移者的34例,无淋巴结转移者16例。
1.1.2 实验试剂乳腺癌细胞株MCF-7购至中国科学院细胞总库,shRNA-UBE3A慢病毒委托上海吉凯基因化学有限公司合成。兔抗人USP25多克隆抗体(Abcam,美国),兔抗人UBE3A多克隆抗体(Abcam,美国),山羊抗兔IgG二抗(Proteintech,中国),UBE3A、USP25上下游引物(生工生物工程股份有限公司,中国),BCA蛋白浓度测定试剂盒、ECL化学发光超特敏试剂盒(碧云天,中国),SYBR®Premix Ex TaqTMⅡ(TaKaRa,日本)。
1.2 实验方法
1.2.1 免疫组化及结果判断免疫组化采用En-Vision法染色:65℃烤箱内烤片2 h,二甲苯Ⅰ、Ⅱ各脱蜡10 min,梯度酒精水化各3 min,流水冲洗5 min,枸橼酸缓冲液抗原修复煮沸15 min,冷却后PBS液洗3次×3 min,3%H2O2去离子水常温10 min灭活内源性过氧化氢酶活性,PBS液洗3次×3 min,10%的羊血清37℃、封闭非特异性抗原10 min,滴加一抗4℃冰箱过夜,37℃恒温箱复温20 min,PBS液洗3次×3 min,滴加二抗37℃恒温箱中孵育40 min,PBS液洗3次×3 min,按说明书配制DAB显色液,DAB显色,流水冲洗5 min,苏木素复染3 min,流水冲洗5 min,1%盐酸酒精分色10 s,流水冲洗5 min,梯度酒精脱水各3 min,二甲苯Ⅰ、Ⅱ各透明10 min,中性快干胶封片,普通显微镜下观察并进行拍照。PBS代替一抗作空白对照,癌旁组织染色作阴性对照。光镜下观察,UBE3A与USP25主要表达于乳腺癌细胞的细胞质,以细胞质呈现棕黄色颗粒为阳性。实验结果采用半定量计分法进行分析[11]。阳性细胞率:≤5%为0分,>5%~25%为1分,>25%~50%为2分,>50%~75%为3分,>75%为4分。染色强度:无显色为0分,浅黄色为1分,中等棕黄色为2分,深棕黄色为3分。两项指标得分的乘积作为判断标准:0~4分为阴性(-),5~12分为阳性(+)。
1.2.2 细胞培养及慢病毒转染MCF-7细胞用含15%胎牛血清的DMEM培养基于37℃、5%CO2恒温培养箱内培养。慢病毒转染按照吉凯基因说明书进行。
1.2.3 qRT-PCR按照试剂盒说明书提取RNA,逆转录成cDNA。在LightCycler PCR仪上进行PCR反应,设置反应条件:(1)预变性:95 ℃、30 s,1 cycle;(2)2步法PCR反应:95 ℃、5 s,60 ℃、30 s,40 cycle;(3)溶解:95 ℃、5 s,60 ℃、60 s,95 ℃、1 s,1 cycle;(4)降温:50 ℃、30 s,1 cycle。
1.2.4 Western Blot检测配置RIPA∶PMSF=100∶1的裂解液,提取总蛋白,BCA法测定蛋白浓度,SDS-PAGE电泳,转膜,抗原抗体免疫反应,ECL超特敏化学发光试剂盒进行化学发光反应,荧光成像仪内曝光条带。
1.3 统计学方法采用SPSS 19.0软件进行统计学分析,计数资料用率表示,率的比较采用χ2检验;计量资料正态分布用均数±标准差表示,各组间均数比较采用方差分析,其中两两比较用LSD法。以P<0.05为差异有统计学意义。
2 结果
2.1 乳腺癌组织中UBE3A与USP25的表达UBE3A与USP25主要表达于乳腺癌细胞的细胞质(图1)。50例乳腺癌组织,UBE3A在32例中表达阳性,阳性率64%(32/50),而在邻近相对正常组织中为阴性表达,其差异具有统计学意义(χ2=47.059,P< 0.001);USP25在36例乳腺癌组织中表达阳性,阳性率72%(36/50),而在邻近相对正常组织中为阴性表达,其差异具有统计学意义(χ2=56.250,P< 0.001)。

图1 UBE3A与USP25在乳腺癌及癌旁相对正常组织中的表达情况(EnVision法,200×)Fig.1 Expression of UBE3A and USP25 in breast cancer and adjacent normal tissues(EnVision method,200 ×)
2.2 UBE3A、USP25在乳腺癌组织中的表达与临床病理特征之间的关系将UBE3A、USP25的表达情况与患者临床病理特征间的关系进行分析(表1),在乳腺癌组织中,UBE3A与USP25的表达均与淋巴结转移相关(P=0.001,P=0.041),其阳性率在有淋巴结转移患者中明显高于无淋巴结转移者;UBE3A与USP25的表达均与Ki-67的表达相关(P<0.001,P=0.029),且在Ki-67高表达组(Ki-67≥14%)阳性表达率远远高于Ki-67低表达组(Ki-67<14%)。另外,USP25在乳腺癌组织中的表达与组织学分级(病理分化程度)相关(χ2=6.270,P=0.046),其阳性率随着分化程度降低而逐渐升高。
2.3 UBE3A敲减结果验证在乳腺癌MCF-7细胞中敲减UBE3A的表达,并检测基因和蛋白的敲减水平(图2、3)。在空白组、阴性对照组、敲减UBE3A组UBE3A mRNA的相对表达量分别为1、1.000 ± 0.024、0.345 ± 0.012(F=1 761.405,P<0.001),UBE3A蛋白的相对表达量分别为0.877±0.034 、0.793 ± 0.071、0.374 ± 0.031(F=90.231,P<0.001)。UBE3A mRNA在敲减UBE3A组的表达量为空白组的34.5%,敲减率65.5%,其差异具有统计学意义(P<0.001);UBE3A蛋白在敲减UBE3A组的表达量为空白组的42.5%,敲减率为57.5%,其差异具有统计学意义(P<0.001);两者在阴性对照组与空白组的表达差异无统计学意义(P=0.974,P=0.079),实验结果表明UBE3A的基因与蛋白被有效敲减。
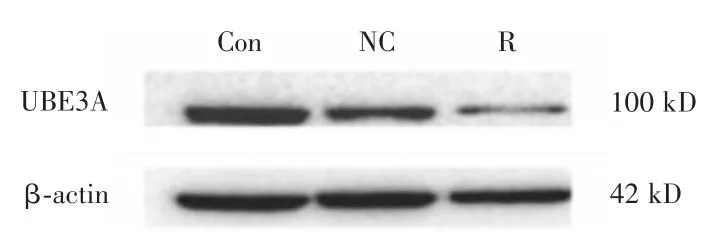
图2 Western Blot检测UBE3A的敲减水平Fig.2 Knockdown level of UBE3A detected by Western Blot

图3 UBE3A mRNA及蛋白的敲减水平Fig.3 Knockdown levels of UBE3A mRNA and protein

表1 UBE3A、USP25的表达与乳腺癌临床病理特征之间的关系Tab.1 Relationship between UBE3A,USP25 and clinicopathological features of breast cancer
2.4 敲减UBE3A后观察USP25 mRNA的表达水平在空白组、阴性对照组、敲减UBE3A组USP25 mRNA的相对表达量分别为1、1.033±0.055、0.400± 0.023(F=318.953,P< 0.001)。敲减UBE3A组的USP25 mRNA表达量较空白组明显降低,差异具有统计学意义(P<0.001),阴性对照组与空白组比较,差异无统计学意义(P=0.288),实验结果表明敲减UBE3A后USP25mRNA表达明显降低(图4)。
2.5 敲减UBE3A后观察USP25蛋白的表达水平在空白组、阴性对照组、敲减UBE3A组USP25蛋白的相对表达量分别为0.551±0.030、0.539±0.014、0.207 ± 0.010(F=293.410,P< 0.001)。敲减UBE3A组USP25蛋白的表达量较空白组明显降低,差异具有统计学意义(P<0.001),阴性对照组与空白组比较,差异无统计学意义(P=0.472),实验结果表明敲减UBE3A后USP25蛋白表达明显降低(图5、6)。

图4 Q-PCR检测敲减UBE3A后USP25mRNA的表达水平Fig.4 Expressionof USP25mRNA after UBE3A knockdown detected by Q-PCR
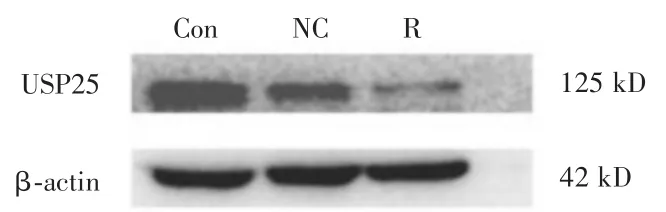
图5 Western Blot检测敲减UBE3A后USP25蛋白的表达水平Fig.5 Expression of USP25 protein after UBE3A knockdown detected by Western Blot

图6 Western Blot检测敲减UBE3A后USP25蛋白的表达水平Fig.6 Expression of USP25 protein after UBE3A knockdown detected by Western Blot
3 讨论
本组实验结果观察到UBE3A在乳腺癌组织中高表达,并且与Ki-67的表达及淋巴结转移有密切关系。UBE3A的表达与Ki-67的表达相关(P<0.001),在Ki-67高表达组(Ki-67≥14%)阳性表达率远远高于Ki-67低表达组(Ki-67<14%),Ki-67是一种细胞增殖标志物,表达越高肿瘤细胞增殖越活跃,这可能提示UBE3A与乳腺癌细胞的增殖有关;UBE3A的表达与淋巴结转移相关(P=0.001),其阳性率在有淋巴结转移患者中明显高于无淋巴结转移者,可能提示UBE3A与乳腺癌细胞的转移有关。有研究报道,在乳腺癌细胞中敲减UBE3A基因可使annexinA2表达下调,同时抑制乳腺癌细胞的增殖、浸润、转移及诱导细胞凋亡,UBE3A基因可能通过调节annexinA2的表达而影响乳腺癌细胞的增殖、浸润、转移等[12]。在肝细胞癌中UBE3A介导sirt6降解,促进了癌细胞的增殖、迁移和侵袭,且在肝细胞癌的小鼠模型中证实,sirt6的下调和随后诱导的annexinA2是UBE3A介导肿瘤发生的关键[13]。
本组实验结果中USP25在乳腺癌组织中高表达,且和组织学分级(病理分化程度)、Ki-67的表达、淋巴结转移有关。USP25在乳腺癌组织中的表达与组织学分级(病理分化程度)相关(P=0.046),其阳性率随着分化程度降低而逐渐升高,在高分化肿瘤中的阳性率低于低分化肿瘤,这可能与乳腺癌从高分化到低分化的恶性进展密切相关;USP25的表达与Ki-67的表达相关(P=0.029),且在Ki-67高表达组(Ki-67≥14%)阳性表达率远远高于Ki-67低表达组(Ki-67<14%),Ki-67是细胞增殖标志物,此结果可能提示USP25的表达和乳腺癌增殖有密切关系;USP25的表达与淋巴结转移相关(P=0.041),其阳性率在有淋巴结转移患者中明显高于无淋巴结转移者,可能表明USP25的表达与乳腺癌细胞的转移有关。USP25在乳腺癌中的作用尚未见报道,但在非小细胞型肺癌(NSCLC)中,USP25高表达,并且USP25的表达与组织学分级、Ki-67的表达和淋巴结转移等相关,进一步研究发现miR-200c能够抑制USP25的表达从而抑制非小细胞型肺癌细胞的浸润与转移[14]。USPs家族中其他成员在乳腺癌中也有类似的报道:USP14在乳腺癌组织中表达增高,且与乳腺癌组织学分级、Ki-67和淋巴结状态相关,在后续实验中观察到USP14促进乳腺癌细胞的增殖、迁移及抑制细胞凋亡,促进乳腺癌的发展[15];USP21在三阴性乳腺癌(TNBC)细胞株中的表达明显高于其他亚型乳腺癌,在TNBC细胞中敲除USP21后抑制细胞增殖、迁移和侵袭,研究证实USP21在乳腺癌中的上调促进了细胞的成瘤能力,并与NOD样受体信号通路有关[16]。USP22在乳腺癌组织中高表达,并与淋巴结转移、Ki-67等呈正相关,多元Cox回归分析显示USP22表达水平是总体存活率或无病生存率的一个独立的预后因素[17]。
实验结果表明UBE3A与USP25在乳腺癌组织中均高表达,且在乳腺癌MCF-7细胞中敲减UBE3A后USP25基因及蛋白的表达量明显降低(P<0.001),这可能提示UBE3A与USP25在乳腺癌泛素蛋白酶体系统中功能作用更加活跃且保持动态平衡,这与相关文献报道是一致的。DENG等[10]使用RFDD-PCR及2-DE为基础的蛋白质组学方法对泛素-蛋白酶体系统组成部分进行观察,结果发现5个蛋白酶体亚单位基因(PSMB5、PSMD1、PSMD2、PSMD8与PSMD11)、4个泛素特异性蛋白酶基因(USP9X、USP9Y、USP10与USP25)及1个泛素蛋白连接酶E3A基因(UBE3A)在乳腺癌组织中表达上调(>3倍),其结果提示乳腺癌中泛素-蛋白酶体系统泛素化及去泛素化活动均明显加强,乳腺癌的发生发展可能与泛素-蛋白酶体系统多环节、多步聚功能改变有关。
综上,UBE3A与USP25在乳腺癌组织中高表达,且与乳腺癌细胞的增殖、转移等生物学行为相关,在乳腺癌泛素蛋白酶体系统中UBE3A与USP25功能作用明显增强且保持动态平衡,它们可能共同作用促进乳腺癌的的发生发展。因而,在乳腺癌的治疗中,可能通过降低UBE3A或USP25的表达,或者通过抑制UBE3A调控USP25的表达,从而抑制乳腺癌细胞的增殖、转移等生物学行为。目前,关于泛素蛋白酶体系统及组成成员抑制剂的研究报道较多,部分已经用于临床[18-22]。针对UBE3A或USP25表达阳性的乳腺癌患者,使用特异性的抑制剂减少乳腺癌细胞的增殖、转移成为可能。然而,此次研究样本量还不足够大,后期还需要扩大样本量进一步证实实验结果;另外,UBE3A与USP25在乳腺癌中的作用机制还不十分清楚,以及UBE3A如何调控USP25的表达等都还需进一步研究。
