蛋白激酶Cε过量表达与乳腺癌临床病理特征的关系
2020-01-16方晓露徐冬娟胥明远张红梅蒋宗英吕怀盛宁夏医科大学病理学与病理生理学系银川75000宁夏医科大学总医院肿瘤医院病理科银川75000宁夏医科大学药学院银川75000深圳市妇幼保健院病理科深圳5808
方晓露 徐冬娟 胥明远 张红梅 蒋宗英 吕怀盛,宁夏医科大学病理学与病理生理学系(银川75000);宁夏医科大学总医院肿瘤医院病理科(银川75000);宁夏医科大学药学院(银川75000);深圳市妇幼保健院病理科(深圳5808)
PKC家族激酶(protein kinase Cs,PKCs)在20世纪80年代初期,由于其作为自然致癌物佛波酯(phorbol ester,TPA/PMA)的底物诱导小鼠皮肤癌的发生而备受关注[1]。佛波酯协同Ras癌基因诱导细胞转化,同时也发现有二酰基甘油(DAG)的表达异常,随后进一步研究发现PKCs与fos和Myc等癌基因的功能密切相关[2],从而将PKCs置于肿瘤信号通路的中心位置。蛋白激酶Cε(PKCε)属于新型PKC(novel PKC,nPKC)中的一种[3]。已有研究表明PKCε在乳腺癌细胞系中表达明显高于其在永生化的正常乳腺上皮细胞中的表达[4],但其在正常乳腺与乳腺癌组织中的表达缺乏系统观察,本研究采用免疫组化方法检测PKCε蛋白在人正常乳腺组织和乳腺非特殊型浸润性癌中的表达,观察PKCε的过量表达与乳腺癌临床病理特征的关系。
1 资料与方法
1.1 一般资料收集2015年1月至2017年12月宁夏医科大学总医院肿瘤医院手术切除且经病理证实的存档标本,包括正常乳腺组织(33例)、导管原位癌(26例)、浸润性乳腺癌(126例,包括非特殊型浸润性癌108例、典型髓样癌11例及浸润性微乳头状癌7例)。所有标本均采用4%的中性福尔马林固定6~24 h。正常乳腺病例中位年龄47(36~62)岁,乳腺导管原位癌患者中位年龄为47(34~62)岁,浸润性乳腺癌患者中位年龄53(29~83)岁;126例浸润性癌按TNM分期标准进行分期,其中TNMⅠ期38例、TNMⅡ期67例、TNMⅢ期20例,Ⅳ期1例;1且均根据Nottingham改良方案进行组织学分级:Ⅰ级31例,Ⅱ级55例,Ⅲ级40例。
1.2 方法采用EliVision免疫组化方法常规检测ER、PR、HER2、Ki-67。即用型鼠/兔通用型免疫组化检测试剂盒(PV9000)、兔抗人PKCε多克隆抗体(TA327275s)、DAB kit(ZLI-9019)、ER(ZA-0102)、PR(ZM-0215)、HER2(ZA-0023)及Ki-67(UMAB107)均购自北京中杉金桥公司。
3 μm切片常规脱蜡水化后采用pH 8.0的枸橼酸缓冲液高压抗原修复,山羊血清封闭,滴加一抗PKCε(1∶100稀释)4℃孵育过夜,次日室温复温30 min,PBS充分洗涤后,滴加二抗室温孵育30 min,充分洗涤后采用新鲜配制的DAB显色5 min,水洗后苏木素复染,中性树胶封片。实验中应用了鼠IgG及PBS代替一抗作为阴性对照,同时选择PKCε蛋白阳性染色的乳腺癌切片作为阳性对照。
1.3 结果判定结果采用半定量法,根据细胞染色的强度和阳性细胞的百分数分别进行评分,再将二者的得分相乘计算免疫组化总评分。染色强度评分:0分:无色;1分:淡黄色;2分:棕黄色;3分:棕褐色。阳性细胞率评分:0分:阳性细胞<10%;1分:阳性细胞占10%~25%;2分:阳性细胞占26%~50%;3分:阳性细胞>50%。总得分0、1分为阴性,2、3分为阳性,4分以上为强阳性。ER、PR、Ki-67及HER2的判断根据全国乳腺癌ER、PR[5]、Ki-67及HER2免疫组化检测的共识标准进行判断,HER2免疫组化结果为2+者,进一步采用FISH检测明确HER2是否扩增。
1.4 统计学方法采用SPSS 22.0统计软件进行数据处理,PKCε的表达与乳腺非特殊型浸润性癌的临床病理特征的关系采用χ2检验分析;当1≤理论频数<5时,采用Fisher精确概率法分析。P<0.05表示差异有统计学意义。
2 结果
2.1 PKCε在乳腺浸润性癌中的表达PKCε在乳腺浸润性癌中的表达高于其在正常乳腺组织和乳腺导管原位癌中的表达,且其表达水平与乳腺癌的组织学类型相关。PKCε在正常乳腺组织、乳腺导管原位癌组织中均有表达,但水平较低,强阳性率分别为27.27%、19.23%;但在乳腺浸润性癌中表达水平明显增加,强阳性率为50.79%,明显高于其在正常乳腺组织(χ2=6.185,P=0.045)、乳腺导管原位癌组织(χ2=9.573,P=0.008)中的表达。126例乳腺浸润性癌中,有乳腺非特殊型浸润性癌108例,其中有58例PKCε过量表达,强阳性率达53.70%;7例微乳头状癌组织中有6例PKCε过量表达,强阳性率达85.71%,而11例典型髓样癌组织中PKCε表达水平则较低,强阳性率为0;PKCε在乳腺非特殊型浸润性癌(χ2=12.628,P=0.002)与微乳头状癌(χ2=15.195,P=0.001)组织中的表达但都明显高于典型髓样癌。见图1。
2.2 PKCε在乳腺浸润性癌中的表达与临床病理特征的关系126例乳腺浸润性癌样本中,有51例发生淋巴结转移,其中33例PKCε过量表达,强阳性率达64.71%,而未发生淋巴结转移者,PKCε强阳性率为41.33%(31/75),差异有统计学意义(χ2=11.263,P=0.004);61例PR阳性的乳腺癌组织中,有35例PKCε过量表达,强阳性率达57.38%,而在65例PR阴性的乳腺癌组织中,有29例PKCε过量表达,强阳性率为44.62%,差异有统计学意义(χ2=8.262,P=0.016);组织学分级为2~3级的组织有95例,其中有55例PKCε过量表达,强阳性率达57.90%,而31例乳腺癌组织学分级1级的组织中,PKCε过量表达者9例,强阳性率为29.03%,差异有统计学意义(χ2=7.853,P=0.02);此外,26例HER2过表达的乳腺癌组织中,有18例PKCε过量表达,强阳性率为69.23%,而在100例HER2无扩增的乳腺癌中,有46例PKCε过量表达,强阳性率为46.00%,差异有统计学意义(χ2=4.456,P=0.035),见图1。但PKCε的过量表达与乳腺癌患者的年龄、癌灶大小、肿瘤的TNM分期、Ki-67的过量表达及ER的表达无明显相关性(P>0.05)。见表1。
3 讨论
近年来,乳腺癌在全球的发病率逐年增加[6],已成为导致全世界女性死亡的重要原因,2015年,我国乳腺癌新发病达272 000例,因乳腺癌死亡的人数达70 000例[7]。目前认为,各种原因导致的细胞间及细胞内信号转导紊乱在乳腺癌的发生发展中发挥着关键作用[8]。PKCs作为信号通路中的关键效应分子,与各种肿瘤的发生、演进、转移及预后的关系一直是研究的热点。PKCs是一组丝-苏氨酸激酶,根据其包含的部分亚基的结构不同分为 3类:(1)经典型 PKC(cPKCs)包括 PKC-α,PKC-βI,PKC-βII和PKC-γ,其活化依赖于Ca离子的结合,同时也可与DAG结合而活化;(2)新型PKC(nPKC),包括PKC-δ,PKC-ε、PKC-η和PKC-θ,其活化不依赖于于Ca离子但依赖于DAG;(3)非典型 PKC(aPKC),包括 PKC-ζ和 PKC-ι/λ两种[9],其活化既不依赖Ca离子,同时也不依赖DAG。
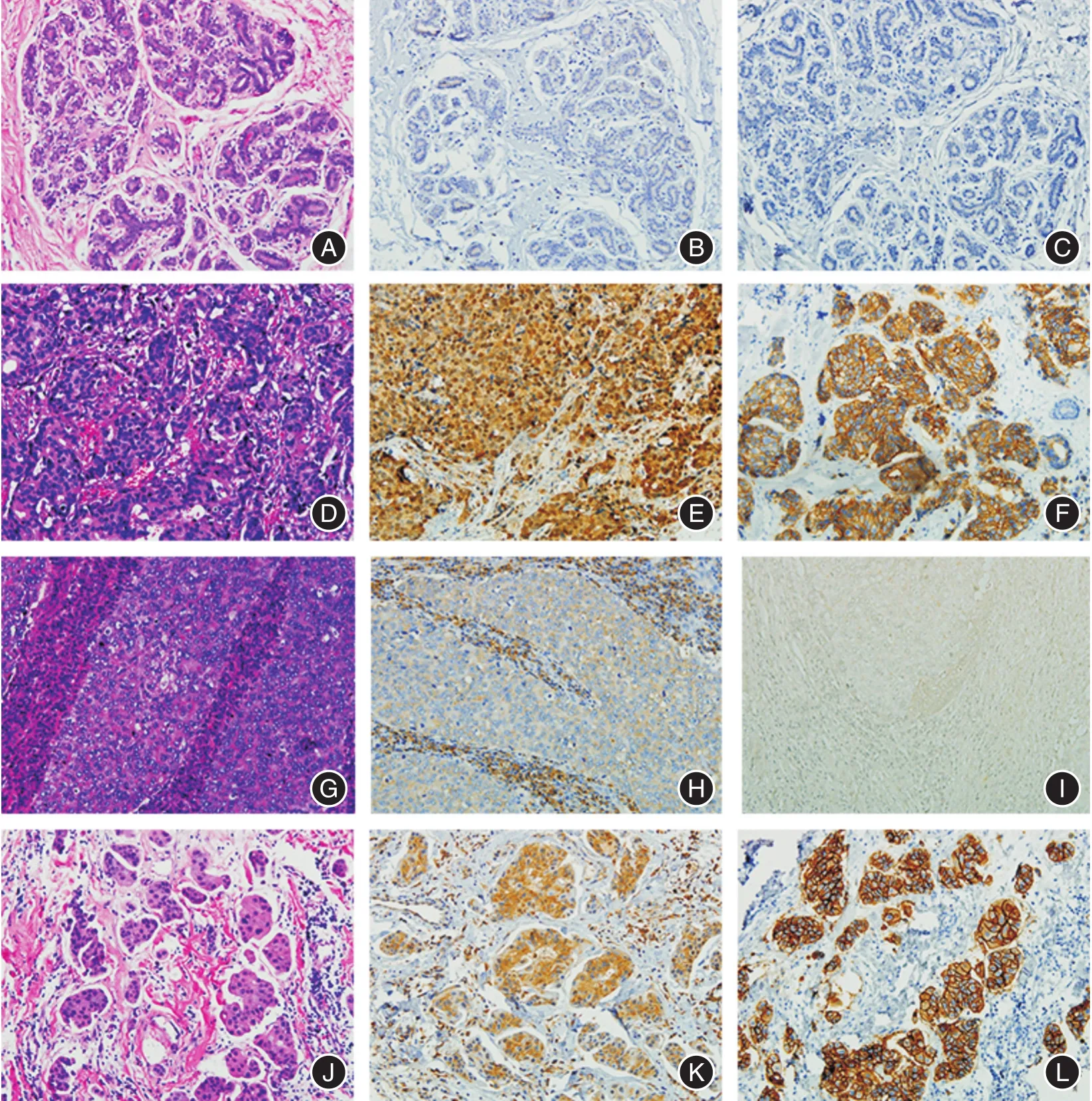
图1 PKCε、HER2在不同乳腺组织中的表达Fig.1 The expression of protein kinase C epsilon(PKCε)in different kinds of breast tissue
已有实验结果表明PKCε在乳腺癌细胞系中的表达明显高于其在永生化的正常乳腺细胞系中的表达,表明其在乳腺癌中发生过程中发挥着重要作用。本研究采用免疫组化方法检测了PKCε在正常乳腺和乳腺癌中的表达水平。结果显示PKCε在乳腺癌中的表达明显增加,与细胞学实验的结果一致[4],进一步证明PKCε的过量表达与乳腺癌的发生相关。
本研究结果显示,PKCε在高级别乳腺浸润性癌、发生淋巴结转移的乳腺癌及HER2过表达的乳腺癌中的表达均明显增加,表明PKCε的过量表达与乳腺癌的不良预后密切相关。远处转移是乳腺癌预后差的主要原因,SHAO等[10]发现敲低乳腺癌细胞中PKCε可降低ezrinT567磷酸化水平,导致乳腺癌的侵袭转移能力降低,表明PKCε在乳腺癌细胞侵袭转移中发挥着重要作用。JAIN等[11]发现在非致瘤性乳腺上皮细胞MCF-10细胞中过表达PKCε可以诱发间叶细胞表型,并使其上皮标志物减少,而敲减PKCε可使MCF-10细胞中由TGFβ介导的Snail和间叶细胞减少,表明PKCε是乳腺癌EMT的重要介导因子。
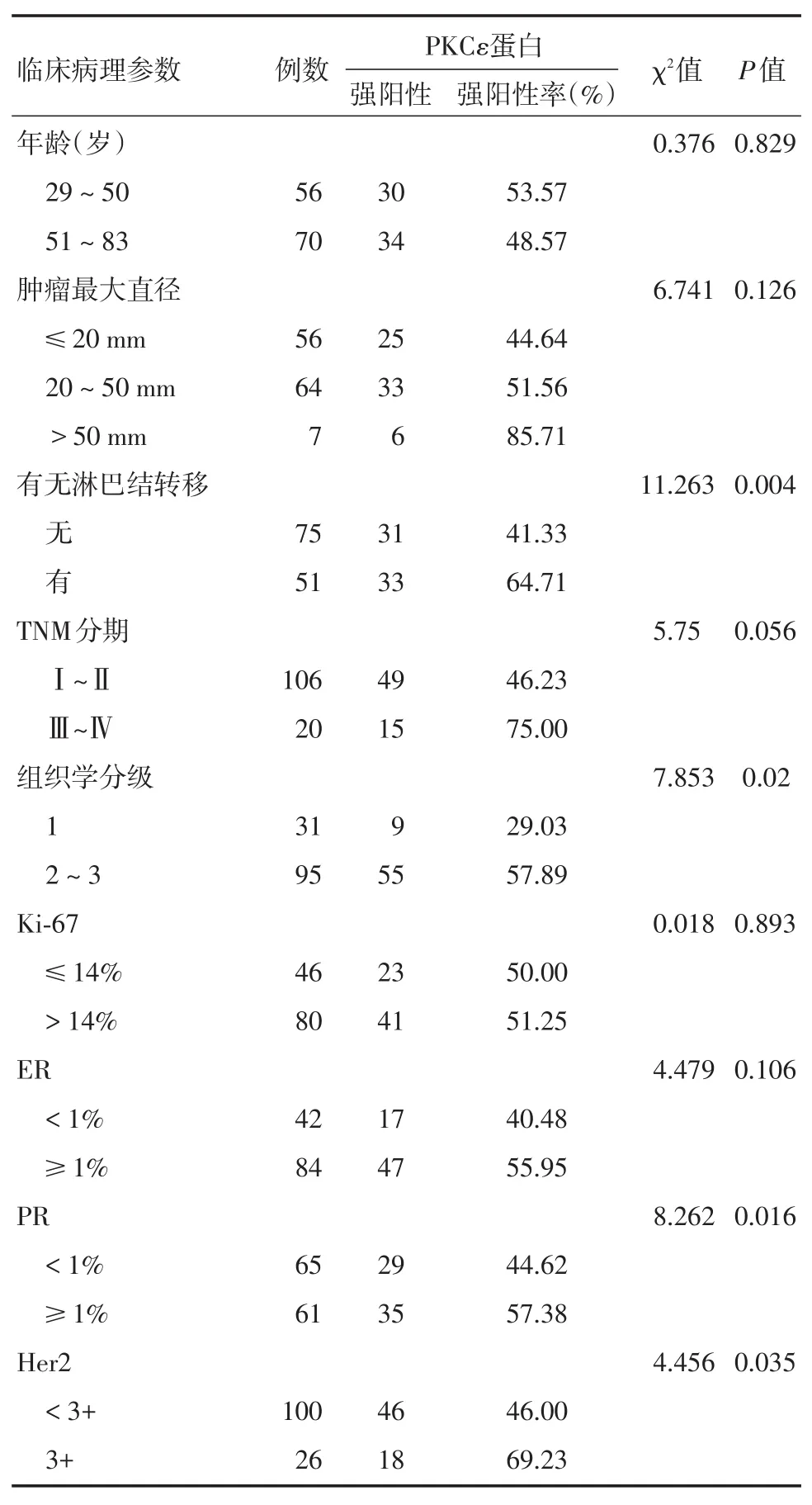
表1 PKCε与浸润性乳腺癌组织临床病理学特征的关系Tab.1 The relationship between PKCε and clinicopathological features of invasive breast cancer 例
人类表皮生长因子受体2(human epidermal growth factor 2,HER-2)蛋白过表达与乳腺癌转移、复发、不良预后紧密相关[12],本组研究中26例HER-2阳性的乳腺癌组织中18例均出现PKCε的过量表达,表明PKCε的过量表达与乳腺癌中HER-2的扩增密切相关。PAN等[13]使用PKC抑制剂处理HER2扩增性乳腺癌细胞后发现HER2介导的NF-κB活化降低,表明HER2可通过激活PKC-NF-κB通路促进恶性肿瘤的增殖、凋亡逃逸、迁移和侵袭。HER2扩增性乳腺癌可以通过RictormTORC2信号诱导肿瘤形成、和增加对HER2靶向治疗的耐药性。MORRISON等[14]发现在HER2扩增性乳腺癌细胞中,PKC a(mTORC2的直接底物)的磷酸化在rictor缺失的细胞中被破坏,表明乳腺癌中HER2-Rictor-mTORC2通路可激活PKC a。PKCε与PKC a同属PKC家族,它们可能具有相似的功能,且有文献[15]表明PKCε也可通过促进mTORC2复合物形成,活化AKT(S473),从而激活PI3K-AKT通路,促进肿瘤细胞的增殖、转移。因此HER-2可能通过HER2-mTORC2-PKC ε通路促进乳腺癌的发生发展。MAPK/ERK通路是介导细胞外信号向细胞内传到的重要信号传递系统,可被多种生长因子和细胞因子磷酸化激活[16];ERK是调节细胞生长发育的核心信号分子,位于细胞质中,可以转移到细胞核,来调节HER2与配体结合,激活蛋白质酪氨酸激酶,使其SH2和SH3区招募Sos,激活Ras及其下游ERK[17],从而促进肿瘤细胞的增殖与转移,而PKCε可以通过MAPK/ERK通路介导肿瘤细胞的增殖与转移[18]。笔者推测,HER-2和PKCε可能参与这些信号通路相互调节,并作用于下游的转录因子,导致乳腺癌发生发展。但HER2是否可以直接磷酸化PKCε使其下游信号通路活化有待进一步研究。
MAO等[19]通过构建HER2过表达的ER阴性乳腺癌细胞系SKBR-3和ER阳性的MCF-7细胞系,来评价和比较褪黑激素的抗转移作用,结果表明褪黑素通过抑制RSK2的表达从而抑制HER2阳性的人类乳腺癌细胞的转移。VENTURUTTI等[20]发现STAT3与Her2启动子上的反应元件(GAS)结合,在Her2阳性的转移性乳腺癌中上调ErbB-2的转录。这些研究表明,HER2可以通过RSK2、STAT3等因子发挥其促进癌细胞转移的作用。而本课题组的其他研究发现PKCε可通过激活ERKRSK2-STAT3信号通路促进乳腺癌细胞MCF-7的增殖与迁移能力。结合本研究免疫组化结果,可以推测HER-2可能通过PKCε-ERK-RSK2-STAT3信号通路发挥其致癌作用,后续本课题组可以进一步研究HER-2是否可以直接磷酸化PKCε导致乳腺癌的发生和转移。
综上所述,PKCε在乳腺癌组织中表达明显升高,并且其过量表达与乳腺癌的组织学分级、淋巴结转移及HER2的过表达密切相关,检测PKCε的表达水平可作为乳腺癌预后判断的重要指标。肿瘤的发展是多因素、多步骤参与的过程,因此,乳腺癌发生发展的相关机制需要继续研究。已有一些研究认为以PKC为治疗靶点可能是一种有效的抗癌策略[21]。CAINO等[22]将PKCε选择性抑制剂肽varepsilonV1-2应用于患有小鼠身上,发现可以减少非小细胞肺癌的异位移植,且PKCε的RNA干扰耗竭和药理抑制均导致NSCLC肿瘤凋亡细胞数量显著升高。因此,靶向抑制PKCε或其在肿瘤中上调的机制可能为PKCε过表达所致乳腺癌的治疗提供新的方法。
