黏蛋白5B上调高迁移率族蛋白组A1促进乳腺癌细胞侵袭转移
2020-01-16陈永胜曾珊珊郑文英贾小婷
陈永胜 曾珊珊 郑文英 贾小婷
广州医科大学附属肿瘤医院肿瘤研究所,广州恶性肿瘤治疗转化医学重点实验室(广州510095)
乳腺癌是女性最常见的恶性肿瘤[1]。全国肿瘤登记中心公布我国2014年女性乳腺癌的发病率(新增病例27.89万例)大约占到整个女性肿瘤的16.51%[2]。手术、放/化疗以及免疫治疗是乳腺癌常见的治疗方式,但90%的乳腺癌患者还是死于远端转移[3]。转移是一个多基因多步骤的复杂生物学过程[4]:细胞丢失其上皮细胞-细胞连接和顶端-基底细胞极性并转变为具有纺锤状细胞形状和增加的低增殖状态,从而迁移和侵入以产生或再生新的组织。转移一直被认为是进展性乳腺癌的最终步骤[5]。但是目前转移的分子机制尚未完全阐明,针对已有的靶点无法满足临床的治疗需求。因此,阐述乳腺癌转移的分子机制对于降低乳腺癌远端转移率,提高乳腺癌诊治水平具有非常重要的意义,也是医学和生命科学领域面临的十分紧迫的重大课题。
笔者在前期通过数据库分析发现黏蛋白5B(mucin 5B,MUC5B)在乳腺癌组织中显著高表达。MUC5B是黏蛋白家族蛋白,属于高分子量的O-糖蛋白,通常在上皮细胞表面表达[6-8]。黏蛋白参与多种细胞基本的生命活动:保护和润滑上皮细胞、维持上皮特征、细胞黏附、分化和免疫[9-12]。已显示黏蛋白的表达在许多病理状况如炎性肠病和瘤体形成中被改变[13-15]。笔者通过数据库分析发现MUC5B在乳腺癌中的表达量显著高于其在正常组织中的表达量,且生物信息学预测MUC5B可能与高迁移率族蛋白组A1(human high mobility group A1,HMGA1)的表达正相关。本文拟在上述基础上,探讨MUC5B在乳腺癌侵袭转移中的作用及具体的分子机制。
1 材料与方法
1.1 细胞及培养人乳腺癌细胞T47D、MDA-MB-231、MCF-7、HCC1937、ZR-75-30、BT549和 SKBR3均由本实验室保存。乳腺癌细胞由1640(Gibco公司)完全培养液(含10%胎牛血清),在5%CO2、37℃的培养箱中培养。正常乳腺上皮细胞MCF-10A的培养基配置如下:含有5%马血清的DMEM/F12(1∶1)培养基,依次加入表皮生长因子(20 ng/mL)、氢化可的松(0.5 μg/mL)和胰岛素(10 μg/mL),培养条件与乳腺癌细胞一致。
1.2 RNA提取及逆转录购买RNA Isolation Kit I试剂盒(Omega公司)用于细胞总RNAs的提取。预冷PBS洗涤细胞,700 μL RTK裂解液处理细胞,加入700 μL无水乙醇,12 000g,4 ℃离心15 min。上清加入柱中,10 000g离心1 min。500 μL RW1洗涤柱子,10 000g离心 1 min。700 μL RW2洗涤柱子两次。空甩,12 000g,3 min。用30 μL无核酶水溶解RNA,静置2 min。12 000g离心2 min。-80℃保存RNA样品。
根据说明书,配置逆转录体系如下:Random Primer 1 μL,RNA 4 μg,水补足12 μL。65 ℃ 5 min,立即冰置 2 min。加入 4 μL Reaction Buffer,1 μL RNase inhibitor,2 μL dNTP,1μL Reverse trscriptase。42℃ 1 h,70℃ 5 min。-20℃保存cDNA。
1.3 qRT-PCR方法根据说明书,配置qRT-PCR检测体系:Forward primer 0.8 μL,SYBR 10 μL,cDNA 1 μL,Reverse primer 0.8 μL,用水补足20 μL体系。运行程序:50℃ 2 min,95℃ 2 min,95℃15 s,60 ℃ 30 s(40个循环)。引物序列见表1,根据 2-ΔΔct值计算相对表达量。

表1 引物序列汇总Tab.1 Summary of primers in this study
1.4 Transwell将Transwell小室放在corning 24孔板中,50 μL无血清培养基加入上室,水化基底膜(置于37℃、5%CO2的培养箱中)。30 min后,给上室加入1×105细胞,下室加入600 μL完全培养基。24 h后,固定小室(甲醇)10 min,棉签擦拭上室的细胞,1%结晶紫染色细胞10 min,流动水冲洗小室,室温晾干。
1.5 生物信息学预测UALCAN(http://ualcan.path.uab.edu/);The Human Protein Altas(https://www.proteinatlas.org/);starBase(http://starbase.sysu.edu.cn/)
1.6 统计学方法所有实验重复3次以上,所有的数据均用均数±标准差表示。两组间比较用独立样本t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 MUC5B在乳腺癌中高表达如图1A所示:在线数据库UALCAN展示了MUC5B在1 097例乳腺癌组织中的表达量显著高于其在144例癌旁组织中的表达量(P<0.000 1)。这是MUC5B mRNA水平的表达模式,相同的蛋白质水平表达模式见图1B。在线数据库The human altas通过免疫组化的方法证实MUC5B在7例乳腺癌中高表达,1例中表达,仅4例低表达。最后,本研究在乳腺正常上皮细胞MCF-10A及多种乳腺癌细胞中检测MUC5B的表达量。qRT-PCR结果证实MUC5B在乳腺癌细胞中显著高表达。与MCF-10A相比,MUC5B在MDA-MB-231中的表达量上调7.31倍,在MCF-7中的表达量上调2.20倍(图1C)。

图1 MUC5B在乳腺癌中高表达Fig.1 MUC5B is enhanced in breast cancer
2.2 MUC5B促进乳腺癌细胞发生侵袭本研究在MCF-7细胞和MDA-MB-231细胞中干预MUC5B的表达。在MCF-7细胞中转染MUC5B过表达质粒,MUC5B表达量较对照组上调8.44倍(图2A)。Transwell实验发现与对照组相比,MUC5B可明显增加该细胞的侵袭能力(图2B)。同样的,在MDA-MB-231细胞中转染靶向MUC5B的干扰质粒,qRT-PCR结果证实sh-MUC5B-1#沉默效果最好,可敲低81.67%的MUC5B表达量,用于后续研究(图2C)。Transwell实验发现与对照组相比,敲低MUC5B后该细胞的侵袭能力较对照组明显降低(图2D)。

图2 MUC5B调控乳腺癌细胞的侵袭转移能力Fig.2 MUC5B modulated invasion of breast cancer cells
2.3 MUC5B促进乳腺癌细胞侵袭的分子机制明确了MUC5B可促进乳腺癌细胞发生侵袭转移的作用后,本研究将重点探讨其发挥作用的具体分子机制。在线软件starbase预测到MUC5B与HMGA1在1 104例乳腺癌组织中表达正相关(图3A)。在MCF-7中过表达MUC5B,可上调HMGA1表达量至4.53倍,而在MDA-MB-231细胞中敲低MUC5B则可大大降低HMGA1的表达量(图3B)。此外,本研究在MCF-7细胞中过表达HMGA1,在MDAMB-231中敲低HMGA1。WB结果证实HMGA1表达量及敲低模型均成功建立(图3C)。最后,通过transwell实验发现:在MCF-7中过表达MUC5B,可明显增加该细胞侵袭能力,但是同时过表达MUC5B和敲低HMGA1,可大大降低该细胞的侵袭能力(图3D);同样的,在MDA-MB-231细胞中敲低MUC5B,则该细胞侵袭能力减弱,但若同时敲低MUC5B和过表达HMGA1,又可以逆转该细胞的侵袭能力(图3D)。提示MUC5B通过HMGA1发挥促乳腺癌细胞侵袭转移的作用。
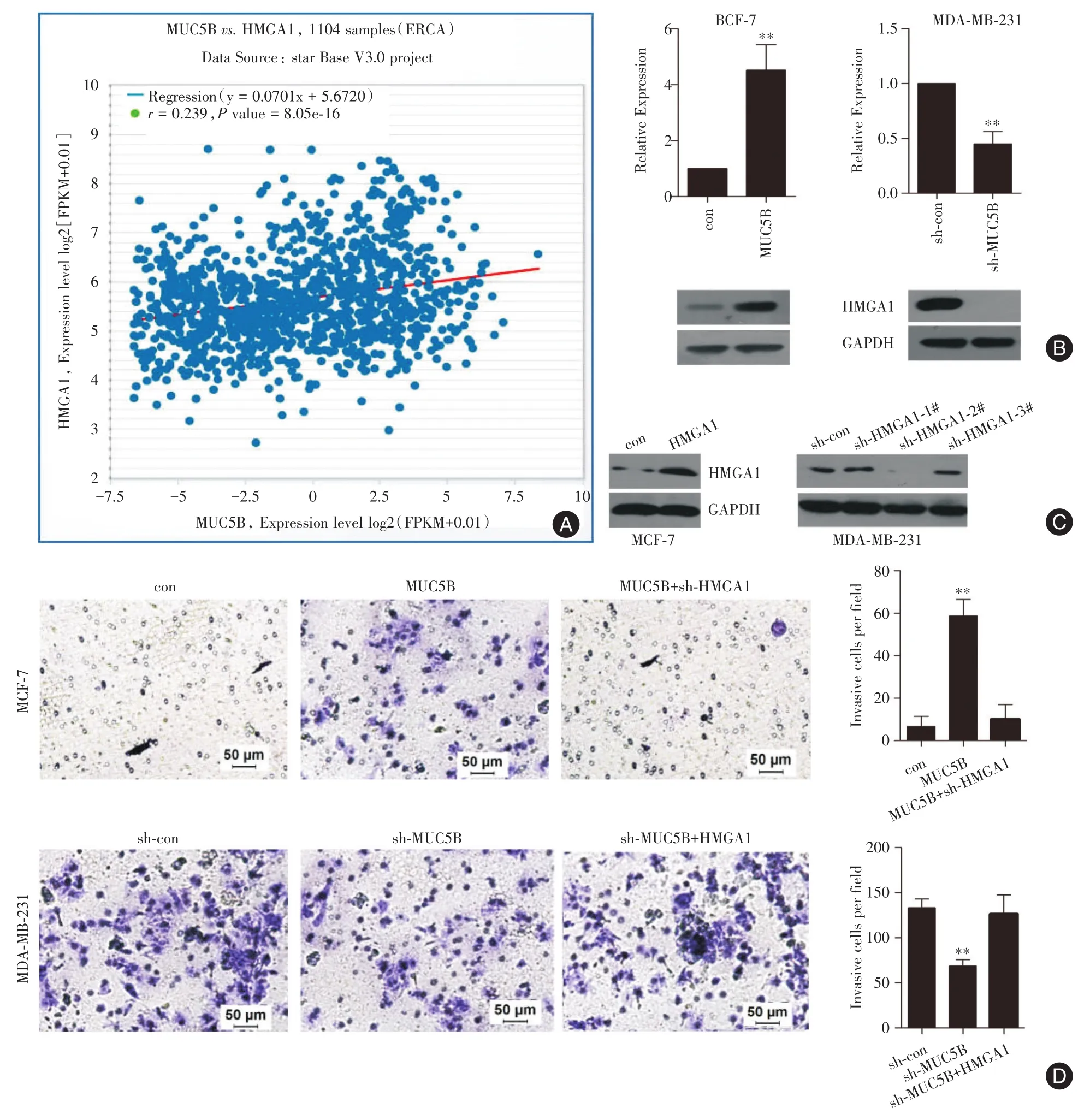
图3 MUC5B通过调控HMGA1促进乳腺癌细胞侵袭转移Fig.3 MUC5B promoted breast cancer cells invasion via accelerating HMGA1
3 讨论
MUC5B在乳腺癌中的作用备受关注。有学者在乳腺癌细胞中敲低MUC5B的表达后,发现该细胞的黏附性、细胞生长、克隆形成能力均较对照组显著降低,但是细胞并未发生凋亡。同时还发现MUC5B与乳腺癌较差的化疗敏感性有关,降低MUC5B将促进乳腺癌化疗增敏[16]。MUC5B在体外侧近细胞增殖和浸润,在体内可促进瘤体生长和细胞扩散[17]。与此相一致的是,本研究在乳腺癌细胞中敲低MUC5B,发现该细胞的侵袭能力降低,反之亦然。为探讨MUC5B在乳腺癌中的作用机制,本研究通过生物信息学及实验验证发现MUC5B上调HMGA1。HMGA1是核内转录因子,能够结合到富含AT区域的DNA链上,调控下游效应基因的转录活性[18]。HMGA1通常在胚胎发育中表达量较高,而在成熟组织中低表达[19]。HMGA1在多种肿瘤中高表达,且HMGA1通常与转移和患者较差的预后正相关[20]。这是因为HMGA1可以调控多种参与细胞增殖和DNA损伤修复相关基因的表达[21]。此外,还发现HMGA1是晚期糖基化终产物特异性受体(receptor of advanced glycation endproducts,RAGE)的配体,可以活化ERK信号通路,参与细胞黏附、迁移与转移等能力[22]。与这些结果一致的是,在本研究中发现HMGA1可以逆转敲低MUC5B引起的乳腺癌细胞侵袭转移能力减弱。而在MCF-7细胞中敲低HMGA1可以逆转因过表达MUC5B而引起的转移能力增强。后续笔者将进一步探讨MUC5B调控HMGA1的分子机制。
