预热变性程度对大豆蛋白凝胶性质的影响
2020-01-15陈力扬华欲飞孔祥珍陈业明张彩猛李兴飞
陈力扬,华欲飞,孔祥珍,陈业明,张彩猛,李兴飞
(江南大学 食品学院,江苏 无锡 214122)
大豆蛋白主要由大豆球蛋白(11S)和伴大豆球蛋白(7S)组成。11S蛋白质分子由6个亚基组成,每个亚基又由酸性肽链(A)和碱性肽链(B)通过一个链间二硫键(S—S)连接而成(一般表示为AB)[1]。对于天然大豆蛋白,通过非还原SDS-PAGE可以发现1个明显AB条带,且热处理时AB条带逐渐消失。我们的前期研究表明[2-3],AB条带含量对热非常敏感,热诱导下AB条带逐渐减少趋向于形成聚集体,这一变化伴随着蛋白质热变性同步进行,是大豆蛋白热变性的重要标志之一,因此可以通过软件对非还原电泳的AB条带进行定量来表征大豆蛋白的热变性程度,这种方法更有利于研究大豆蛋白热处理变性、聚集对凝胶性质的影响。
大豆蛋白的凝胶性很大程度上依赖于蛋白质的变性、解离、聚集的程度[4-5]。研究发现7S和11S在加热时发生去折叠、解离和形成聚集体等行为[6],这些变化涉及氢键、范德华力、疏水相互作用的断开和形成。其中巯基与二硫键是大豆蛋白中重要的功能基团,热处理中巯基/二硫键交换反应以及巯基的氧化是影响其凝胶性能的重要因素[7-8],有文献表明热诱导过程中巯基/二硫键交换反应驱动了聚集体的形成,并决定了形成聚集体的大小和多分散性[9-10],可见热处理可以改变大豆蛋白的聚集状态从而对其凝胶性产生影响。
国内外的类似研究主要集中在制备凝胶时的热处理条件对凝胶性质的影响[11-12],或者制备凝胶前对蛋白溶液进行预热处理对凝胶性质的影响[13-14],而对于制备大豆蛋白过程中预热变性对凝胶性质影响的研究比较少见。何志勇[15]、张海瑞[16]等研究了大豆分离蛋白制备过程中在碱溶、酸沉、中和阶段以较低温度(40~60℃)加热大豆蛋白对所制备的大豆分离蛋白凝胶性质的影响,发现热处理对凝胶性质有一定的促进作用,但并未使蛋白质不同程度变性。本研究创新性地以大豆蛋白在非还原SDS-PAGE电泳中AB条带的变化定量表征蛋白质变性程度,能够更准确和直观地显示蛋白质变性程度及AB亚基的热聚集情况。在此基础上通过预热处理制备不同变性程度的大豆蛋白,并研究所制备的大豆蛋白的凝胶性质以及凝胶形成特性,以期为大豆蛋白加工工艺的进一步优化提供理论依据。
1 材料与方法
1.1 实验材料
1.1.1 原料与试剂
低温脱脂豆粕,山东禹王实业有限公司;氢氧化钠、浓盐酸、十二烷基硫酸钠(SDS)等,国药集团化学试剂公司。
1.1.2 仪器与设备
Himac CR21 GⅡ型冷冻离心机,日本日立公司;垂直电泳仪、凝胶成像仪,伯乐生命医学产品有限公司;喷雾干燥机,德国GEA集团;Chirascan圆二色光谱仪;TA.XT Plus型物性分析仪,美国TA公司; MCR301旋转流变仪,奥地利安东帕有限公司;Nano Brook Omni型多角度粒度与高灵敏度Zeta 电位分析仪。
1.2 实验方法
1.2.1 大豆蛋白的制备
采用碱溶酸沉法,将低温脱脂豆粕与去离子水按照1∶10的比例混合,常温低速搅拌1 h,期间不断调节pH至7.0,后纱布过滤收集滤液8 000 r/min离心30 min,收集上清,调节上清液pH至4.5使蛋白沉淀,8 000 r/min离心20 min收集沉淀蛋白凝乳,去离子水洗涤3次,将凝乳粉碎并加入去离子水调pH至7.0,充分搅拌复溶后4 000 r/min离心去除未溶解的蛋白凝乳。
1.2.2 不同预热变性程度的大豆蛋白及凝胶的制备
将1.2.1中制备的大豆蛋白溶液调至质量浓度为60 mg/mL,利用蠕动泵推动使蛋白溶液经过2.5 mm细管处于水浴环境,通过控制蠕动泵流速和置于水浴环境中细管的长度控制加热时间。分别在80、90、100℃加热10、20、30、40、50、60、120、180 s,以及在60、65、70、75、80、85、90、95、100℃加热50 s后立即冷却,样品用于电泳分析;60、70、80、90、100℃加热50 s的样品经过喷雾干燥后得到不同变性程度大豆蛋白,未经预热变性的大豆蛋白喷雾干燥为SP0。喷雾干燥条件为:进风温度180℃,出风温度80℃。
将大豆蛋白粉分散于0.01 mol/L磷酸盐缓冲液中,充分水化后,4 000 r/min离心10 min脱去气泡,调节使最终蛋白质质量浓度为120 mg/mL,将蛋白溶液置于四氟乙烯密封瓶中(直径30 mm,高65 mm),将密封瓶置于95℃水浴环境保温50 min,保温结束后立即冷却并置于4℃保存12 h,从密封瓶中小心取出圆柱形凝胶以供测量。
1.2.3 非还原SDS-PAGE电泳分析
样品的非还原SDS-PAGE电泳分析参考Laemmli等[17]的方法。浓缩胶3%和分离胶12.5%,将4 mg/mL蛋白样品用样品溶解液(4%SDS,48%甘油,pH 6.8的0.125 mol/L Tris-HCl缓冲液,0.01%溴酚蓝)稀释至2 mg/mL,充分混合后作为非还原电泳样品。电泳完成后固定1 h,0.2%的考马斯亮蓝G-250染色液染色2 h后,去离子水脱色12 h。凝胶成像后,用ImageLab(伯乐,美国)软件对电泳图像进行分析。
1.2.4 圆二色(CD)光谱测定
大豆蛋白溶液于10 000 r/min离心30 min,上清液用BCA法测得蛋白质质量浓度,去离子水稀释使蛋白质质量浓度为0.2 mg/mL,置于Chirascan圆二色光谱仪中,设定波长190~250 nm,石英比色皿厚度2 mm,25℃下扫描5次取平均值,结果以平均摩尔椭圆率 [θ](deg·cm2·dmol-1)表示。
1.2.5 大豆蛋白变性程度计算
非还原SDS-PAGE图谱中,定义未经加热的大豆蛋白为未变性状态,此时的AB条带含量为AB0,经过100℃、50 s加热的大豆蛋白为完全变性状态,此时的AB条带含量为ABd,加热强度在未加热与100℃、50 s加热之间时AB条带含量为ABn,定义经过不同强度热处理的大豆蛋白变性程度ξSDS-PAGE为:
(1)
未加热的蛋白质在222 nm处的平均摩尔椭圆率为[θ]0,100℃、50 s加热的蛋白质在222 nm处的平均摩尔椭圆率为[θ]d,其间不同强度加热的蛋白质在222 nm处的平均摩尔椭圆率为[θ]n,根据圆二色谱定义的大豆蛋白变性程度ξCD为:
(2)
1.2.6 凝胶质构分析
由1.2.2制备的圆柱形凝胶切去底端和顶端,剩余高20 mm、直径30 mm的圆柱形凝胶块。测定采用穿刺模式,选用P/0.5探头,探头下压速度为1 mm/s,穿刺深度为16 mm,触发力为5 g,每个样品重复测定3次取平均值。
1.2.7 流变分析
将1.2.2中制备凝胶的蛋白溶液置于流变仪狭缝中,硅油封边。采用25 mm探头,狭缝距离 1 mm。
温度扫描程序:升温阶段25~95℃,升温速率2℃/min,保温阶段95℃保持30 min,降温阶段95~25℃,降温速率2℃/min,期间固定形变1%,固定角频率0.63 rad/s。
频率扫描:温度扫描结束后,切换至频率扫描,温度恒定25℃,固定形变1%,扫描频率0.1~100 Hz。
1.2.8 粒径分析
将大豆蛋白溶液质量浓度调至1 mg/mL,高速离心至澄清透明,置于多角度粒度及Zeta电位分析仪中测量平均粒径,每个样品测量3次取平均值,测量温度25℃。
2 结果与讨论
2.1 大豆蛋白预热变性过程中的亚基变化
图1为经过不同强度预热处理的大豆蛋白非还原SDS-PAGE图谱,图中显示了亚基的变化,图2为不同加热强度下大豆蛋白非还原SDS-PAGE图谱条带定量分析。
结合图1和图2可知:80℃加热时(图1A、图2A),大豆蛋白各亚基相对稳定,随着加热时间的延长仅在加热180 s时11S的AB、A5B3条带和7S蛋白的β条带略微减少,聚合体含量略微增多; 90℃加热时(图1B、图2B),Band 1、AB、β、A5B3条带随加热时间的延长逐渐减少,相应的聚合体含量逐渐增加,而α′、α条带在热处理过程中没有明显变化,该趋势始于30 s,120 s后趋于稳定;100℃加热时(图1C、图2C),该变化趋势始于10 s,40 s后趋于稳定;对于不同温度加热50 s的大豆蛋白(图1D、图2D),当加热温度在60~80℃时,各泳道中条带含量之间无显著性差异(p>0.05),80℃之后蛋白质亚基含量呈现明显的差异性,具体表现为AB、A5B3、Band 1显著降低,聚合体含量显著升高,100℃时,图谱中AB、A5B3条带完全消失。聚合体条带位于分离胶顶端,可见聚合体由减少的各亚基通过二硫键连接,另外阮奇珺[2]在大豆蛋白热聚集产物的研究中证明Band 1为α′和/或α的二聚体。
以上结果表明,不同加热温度和加热时间可导致大豆蛋白不同程度变性,大豆蛋白热变性伴随着亚基的变化,其中AB亚基的变化尤为明显。图中AB亚基表现为随着加热强度的增加逐渐减少直至消失,这种变化的临界温度为80℃,在80℃以下的热处理条件中,仅发生微弱的变化;当热处理温度达到80℃以上时,变化程度开始显著增加,并且随着加热温度的继续升高,所需的时间变短。经过热变性的大豆蛋白趋向于形成由二硫键连接的可溶性聚合体。
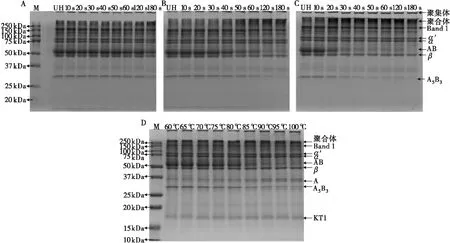
注:A. 80℃加热不同时间;B. 90℃加热不同时间;C. 100℃加热不同时间;D. 不同温度加热50 s。下同。


2.2 大豆蛋白预热变性程度的表征
大豆蛋白溶液在不同温度下预热处理50 s时,根据图2D中AB条带的含量,利用1.2.5中公式(1)计算得到大豆蛋白变性程度ξSDS-PAGE,见图3。由图3可知,大豆蛋白变性程度随着加热温度的升高呈S型曲线升高。加热温度在80℃以下时,随加热温度的升高变性程度仅缓慢上升;80~95℃时,变性程度随加热温度升高迅速上升,之后随着加热温度继续升高变性程度仅缓慢上升直至完全变性。
为了验证表征方法的可靠性,同时利用CD光谱表征大豆蛋白的预热变性程度。远紫外光区(190~250 nm)的圆二色谱图经常用于表征加热对大豆蛋白二级结构的影响,其中在222 nm附近的负凹槽显示大豆蛋白中的α-折叠结构,随着加热强度的增大蛋白质中α-螺旋结构的含量逐渐减少,222 nm处的平均摩尔椭圆率[θ]222的绝对值也随之减少[17],在大量的研究中以[θ]222来表征蛋白质受热结构展开的程度[18-20]。故本研究利用1.2.5中公式(2)计算得到大豆蛋白变性程度ξCD。
同样的加热条件下,以ξCD表征的大豆蛋白热变性曲线见图3。由图3可知,随着加热温度的升高大豆蛋白变性程度逐渐增大,与ξSDS-PAGE表征的热变性曲线一样呈现S型上升趋势。不同点是ξCD表征的大豆蛋白变性程度从70℃开始显著上升(ξSDS-PAGE从80℃开始),这可能是因为在70~80℃加热时,大豆蛋白7S部分α-螺旋结构被破坏导致在CD光谱中[θ]222绝对值减小,以致于表征的蛋白质变性程度较大,而非还原SDS-PAGE表征的热变性是以11S的AB亚基变化为依据的。综上所述,两种表征方式均可表征大豆蛋白的预热变性程度,但对于研究大豆蛋白的凝胶性质来说,用非还原SDS-PAGE表征大豆蛋白预变性程度更有实际意义,更有利于阐明大豆蛋白预热变性影响大豆蛋白凝胶性质的机理。非还原SDS-PAGE分析结果表明,60、70、80、90、100℃加热50 s的样品经过喷雾干燥后得到变性程度分别为1.5%、9.73%、22.28%、86.11%、100%的大豆蛋白SP1.5%、SP9.73%、SP22.28%、SP86.11%、SP100%。

图3 非还原SDS-PAGE法和CD光谱法表征大豆蛋白预热变性程度
2.3 不同预热变性程度的大豆蛋白成胶过程流变分析
通过在流变仪上设置制备热凝胶的温度程序监测大豆蛋白在形成凝胶过程中储能模量的变化情况,以此来评价不同预热变性程度的大豆蛋白热凝胶形成特性,见图4。

图4 不同预热变性程度的大豆蛋白凝胶形成过程
由图4可知,SP0、SP1.5%、SP9.73%的储能模量在各温度阶段基本保持一致:温度在80℃以下时储能模量无明显变化,80~95℃时储能模量开始迅速升高,这是由于加热使变性程度较小的大豆蛋白受热结构展开并形成大分子聚集体,大分子聚集体的存在导致了储能模量的提高;95℃保温时仍缓慢升高,这是由于仍有部分结构未完全展开的蛋白质形成聚集体;降温阶段储能模量持续升高,这是降温过程中氢键的形成导致的。SP22.28%开始加热时储能模量略高于SP0、SP1.5%、SPI9.73%, 这是因为在预热处理时已经有部分蛋白质变性结构展开形成聚集体,随着加热温度的升高储能模量减小,这是由于温度升高破坏原有的氢键等非共价键;随着温度的继续升高,储能模量在70℃即开始大幅提高,这一温度低于SP0、SP1.5%、SP9.73%,说明一定程度的预热变性有助于降低大豆蛋白热诱导形成凝胶的温度;后续的95℃保温过程及降温过程中储能模量持续小幅增加。SP86.11%和SP100%在起始阶段储能模量远大于其他大豆蛋白,说明在预热变性时已形成较多的聚集体,随着温度的升高SP86.11%和SP100%储能模量先降低,在70℃后开始弹性升高,但升高幅度较小,原因可能是经过预热处理后结构未展开形成聚集体的蛋白已经不多;SP86.11%在保温和降温阶段储能模量持续增大,且增大幅度明显大于其他大豆蛋白,而SP100%在保温和降温阶段储能模量没有明显提升,以致于最后SP86.11%形成储能模量较大的凝胶,而SP100%则较差。
2.4 不同预热变性程度的大豆蛋白的凝胶性质
质构分析过程中探头下压将凝胶块压裂时的破裂力和破裂时下压的深度可以分别表征凝胶硬度和弹性,破裂力越大代表凝胶硬度越大,破裂距离越大代表凝胶弹性越大,不同预热变性程度的大豆蛋白凝胶硬度和弹性见图5。由图5可知:随着预热变性程度由0%增至86.11%,大豆蛋白的凝胶硬度和弹性随之升高;当预热变性程度由86.11%继续升高至100%时,大豆蛋白的凝胶硬度明显下降,凝胶弹性基本不变;预热变性程度为86.11%时制成的凝胶硬度最大,是未经预热变性的大豆蛋白凝胶的2.15倍,预热变性程度接近或完全变性时(86.11%、100%),凝胶弹性最佳。可见一定程度的预热变性有助于提高大豆蛋白凝胶的硬度和弹性,但过度预热变性则不利于大豆蛋白在应用时形成很好的凝胶结构。将不同预热变性程度的大豆蛋白中聚合体的相对含量附于图中,分析发现:聚合体相对含量与凝胶弹性表现出一致性,可见凝胶弹性与大豆蛋白中聚合体的相对含量有关;随着聚合体相对含量的增多,凝胶硬度也随之增大,但当蛋白质完全变性时,虽然聚合体相对含量不再变化,但凝胶硬度却显著降低,这说明聚合体对凝胶硬度的影响不仅在于相对含量,还在于聚合体的状态。
图6为凝胶形成后在流变仪上的频率扫描图谱,用于分析不同预热变性程度的大豆蛋白形成的凝胶储能模量,以此表征凝胶的强度。从图6可以看出,不同预热变性程度的大豆蛋白形成的凝胶强度为SP86.11%>SP22.28%>SP9.73%>SP1.5%>SP0>SP100%。以上两种方式对凝胶性质的测定均说明一定程度的预热变性有助于改善大豆蛋白的凝胶性质,但预热变性程度过大则得到的凝胶性质较差。


图5 不同预热变性程度的大豆蛋白凝胶硬度和弹性

图6 不同预热变性程度的大豆蛋白凝胶频率扫描图谱
2.5 不同预热变性程度的大豆蛋白粒径分析
图7为不同预热变性程度的大豆蛋白在喷雾干燥前后的平均粒径分布。由图7可知,喷雾干燥前后,变性程度低于86.11%时,随着变性程度的增加,大豆蛋白平均粒径逐渐增大,当变性程度继续增大至接近完全变性(95.73%)和完全变性(100%)时,平均粒径不再增大,反而略微地减小。可见大豆蛋白预热处理时亚基聚集形成聚集体,这使得大豆蛋白平均粒径变大,一定范围内随着变性程度的增大聚集体也越大,聚集体的存在有利于凝胶的形成以及凝胶硬度、弹性等性质;当大豆蛋白预热至接近或已经完全变性时,已形成的聚集体并不会继续形成更大的聚集体,这些蛋白质聚集体受蛋白质过度变性和聚集的影响反而变得紧密,在后续形成热凝胶的过程中这些结构紧密的聚集体不利于形成网络结构均匀的凝胶,所以预热变性程度达到100%的大豆蛋白形成的凝胶强度差,这也可以解释为何100%预热变性的大豆蛋白在形成热凝胶的降温阶段获得的储能模量较少。
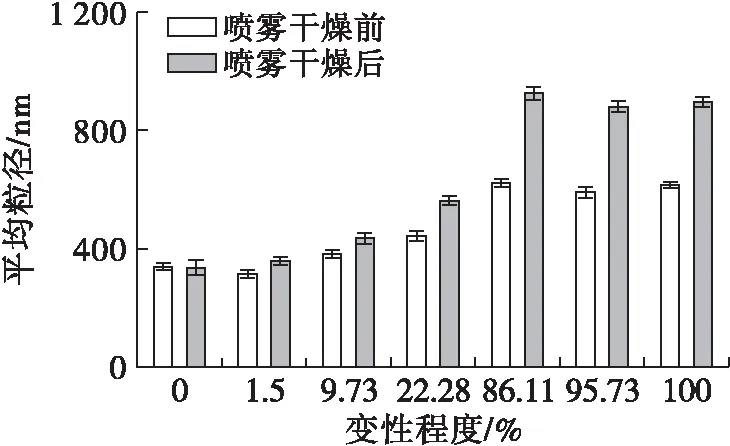
图7 不同预热变性程度的大豆蛋白喷雾干燥前后的平均粒径分布
3 结 论
通过非还原SDS-PAGE观察预热处理时大豆蛋白亚基的变化情况,发现一定加热强度下大豆蛋白的AB、A5B3、β等亚基逐渐向聚合体转化,这种转化在80℃以下加热时难以发生,80℃以上加热时随着加热温度升高,亚基的聚集变得愈发迅速;通过SDS-PAGE中AB条带的变化可定量表征大豆蛋白的变性程度,当加热时间50 s时,随着加热温度的升高,大豆蛋白变性程度呈S型上升;凝胶质构测试和频率扫描测试均表明,预热变性有助于提高大豆蛋白的凝胶硬度,随着预热变性程度的增大,凝胶硬度先上升后下降,预热变性程度为86.11%时凝胶硬度最大,是未经预热变性的大豆蛋白凝胶硬度的2.15倍;通过观察大豆蛋白凝胶形成过程发现,相比于未经预热变性的大豆蛋白,一定程度的预热变性(22.28%、86.11%、100%)有助于提高成胶速率,但100%预热变性的大豆蛋白在凝胶形成的降温阶段获得的储能模量的提升较其他大豆蛋白少,以致于最终形成的凝胶强度较差;粒径分析表明,预热变性对大豆蛋白凝胶性质的影响与预热变性过程中蛋白质变性聚集形成的聚集体尺寸和形态有关。
