中西医结合治疗肝豆状核变性1例
2020-01-13董思思刘洪亮刘成海
董思思 刘洪亮 刘成海
患者,罗某,女,45岁,教师。因反复乏力10年余,加重1月,于2017年2月28日入院。患者于2007年开始出现乏力症状,2015年B超检查提示“肝纤维化、脾大”,予天晴甘平及中药治疗(具体方药不详),2016年体检B超检查示“肝内见钙化灶,肝质地增粗欠匀,胆囊多发息肉;脾肿大(49×145 mm)”。2017年2月自觉乏力加重一月,遂来我院门诊,上腹部MRI增强提示“肝硬化伴再生结节、脾肿大、门脉高压伴侧枝形成、少量腹腔积液;胆囊窝积液”;自身抗体PCNA(+),门诊以“不明原因肝硬化”收治入院。
入院症见乏力,无腹痛,无恶心呕吐,纳可,寐安,二便调,舌红,苔黄,脉弦。查体无明显异常。既往史:否认病毒性肝炎病史,否认血吸虫病区和其他疫区接触史,否认长期可疑用药史,否认其他内科病史,预防接种史不详;否认输血史;否认食物药物过敏史;否认长期或大量饮酒史;否认家族性遗传病史。
中医诊断:虚劳;西医诊断:肝硬化。入院后完善各项检查:肝组织病理活检提示肝细胞水肿变性、疏松化,散在点灶状坏死,部分肝细胞糖原核;汇管区轻度界面性炎;纤维组织增生,并向小叶内延伸,可见桥接纤维隔形成。免疫组化:CK7(+)、CK19(+)、CD34(+)、CD8(+)、HBsAg(-)、HBcAg(-),特染:网状(+)、Masson(+)。慢性肝炎G2期,纤维化S3期(图1);门静脉CTV提示门脉高压伴食管下段、胃底静脉曲张,肝硬化、脾肿大(图2),诊断为疑似自身免疫性肝炎肝硬化,以抗炎、保肝、抗肝纤维化治疗半年,病情无明显改善。进一步检测血清铜蓝蛋白为2.81 mg/dL,ATP7B基因测序发现3个基因位点杂合突变(见表1),眼科查K-F环(-),根据肝豆状核变性诊断积分系统[1]:铜蓝蛋白 <0.1 g/L,2分;基因突变数2个,4分,合计6分,诊断为肝豆状核变性。并调整治疗方案,予“青霉胺”促进体内铜的排泄,起始剂量为250 mg/d,而后每周增加250 mg/d,直至1 500 mg/d,维持量1 000 mg/d,分3~4次餐前服用;“葡萄糖酸锌剂”减少铜吸收,350 mg/次(含元素锌50 mg/次),3次/d口服,两者服药时间至少相隔2 h;并予间断给与谷胱甘肽片、美能片等保肝治疗,中药方以健脾益肾、活血行气,药用黄芪、太子参、生白术,茯苓、炒薏苡仁,麦冬、川石斛、女贞子、车前草、赤芍、鸡血藤、虎杖。并随症加减,纳差腹胀加以枳壳、苍术、法半夏等行气除痞;目涩口干加以野菊花、旱莲草、芦根等清热滋阴生津;二便不利加以瞿麦、龙胆草、大黄、芦荟等解毒通腑;牙龈出血加以炒栀子、黄芩、赤芍等清热止血;夜寐不安加以炙远志、百合养心安神。并间断“扶正化瘀胶囊”抗肝纤维化。治疗3月后乏力等症情缓解,血清铜蓝蛋白升高至3.2 mg/dL。
图1肝活检病理 HE染色:a.汇管区局灶界面炎,局部边界不齐;b.肝细胞肿胀,包浆淡染,肝细胞糖原化核,坏死肝细胞溶解,局部可见少数淋巴细胞浸润 Masson染色 c.均显示胶原纤维沉积,桥接纤维化形成,窦周纤维化明显 罗丹宁染色 d.肝细胞内富含铜颗粒
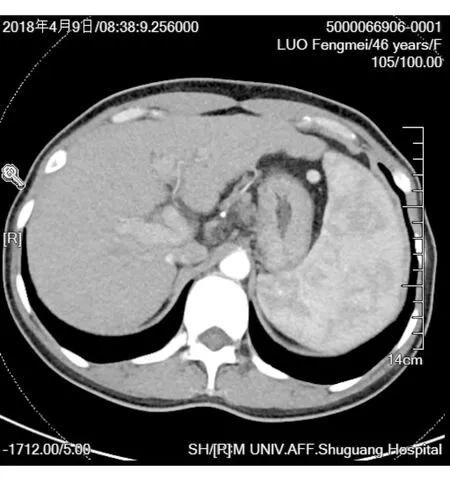
图2门静脉CTV: 门脉高压伴食管下段、胃底静脉曲张,肝硬化、脾肿大
讨论肝豆状核变性也称为Wilson病(Wilson’s disease,WD),为常染色体隐性遗传性疾病,系因编码铜转运ATP酶的基因(ATP7B)突变,导致胆汁铜排泄障碍,过多的铜在肝、脑的组织沉积而发病[2],根据临床特征分为肝型、神经型、混合型及其他[3]。本病为遗传性代谢性疾病,好发年龄为5~35岁,但是由于铜的蓄积呈缓慢、渐进的过程,年龄不能作为排除WD诊断的依据,该患者发病时已45岁,且已出现肝硬化的症状。

表1 基因检测报告
而且,常规实验室检查、角膜K-F环、甚或如本例肝组织学活检也无特异表现,最终确诊依靠血清铜蓝蛋白与基因检测。
铜蓝蛋白是筛查、诊断WD最早、最常用的指标。虽然铜蓝蛋白不由ATP7B基因编码,但是铜蓝蛋白前体需要与该基因编码的铜转运ATP酶转运来的铜离子结合,形成成熟的铜蓝蛋白,从而发挥亚铁氧化酶活性和抗氧化等多种生理功能。WD基因突变导致铜蓝蛋白前体不能获得足够的铜离子而迅速降解,所以血清铜蓝蛋白低下,对于原因不明肝病患者宜常规开展血清铜蓝蛋白检测。该患者第一次铜蓝蛋白仅为2.81 mg/dL,低于正常值(22~58 mg/dL)近10倍。基因检测具有快速、无创、准确的特点,发现ATP7B基因纯合或复合杂合突变即可确诊本病。该患者有3个ATP7B基因位点杂合突变,其中ATP7B基因的8号外显子c.2333G>T(p.R778L)[2]和11号外显子c.2621C>T(p.A874V)[4]为目前明确报道的致病基因突变类型。
WD早诊断早治疗,采用足量的驱铜药物治疗(青霉胺与锌剂等),疾病可明显缓解,并可获得良好的生活质量与生存期;WD急性肝衰竭或失代偿期肝硬化多需要进行肝移植。但是,高度纤维化或代偿期肝硬化的WD患者驱铜治疗可否获得肝纤维化逆转,目前尚无明确资料。
中医中药在WD治疗上有一定经验积累,尤其以安徽中医药大学神经病学研究所为代表取得较好结果。杨任民等[6]早期曾以按“诸风掉眩皆属于肝”理论,采用平肝熄风法,予以全蝎、地龙、龟板、鳖甲等一类药物治疗,患者症状反而加重,而后调整为清热解毒治疗方法,取得了较好疗效,并在此基础上佐以通腑利尿之品组成了“肝豆汤(或肝豆片)”——主要含大黄6~10 g,黄连10 g,穿心莲20 g,半枝莲20 g,萆薢20 g,有促进尿铜排泄与症状改善作用。
我们在临床中认为肝豆状核变性既有先天禀赋异常,又有铜的排泄障碍而致的铜毒蓄积。宜病下分证,中西医结合治疗。以青霉胺联合锌剂等西药促进体内铜的排泄,减少铜吸收;中药过度泻下恐伤正气,而以“健脾益肾,活血行气”为主,或配以抗肝纤维化中成药,以改善患者乏力等症状,并改善患者肝纤维化,协助驱铜药物作用。该患者在2年的随访过程中,没有出现神经系统损害与肝功能失代偿等进一步恶化的表现,且乏力症状得到明显缓解,铜蓝蛋白呈升高趋势,患者病情明显得到有效控制。提示中西医结合防治WD代偿期肝硬化可进一步观察研究。
