LncRNA NEAT1缺乏增加对乙酰氨基酚诱导的急性肝损伤的机制研究
2020-01-13赵杰钟成鹏蔡杰张建军
赵杰 钟成鹏 蔡杰 张建军
对乙酰氨基酚(APAP)是一种常用的镇痛解热药,尽管在推荐剂量下确认了其有效性和安全性,但APAP过量仍然会导致肝毒性甚至急性肝功能衰竭(acute liver failure, ALF)[1]。根据美国急性肝功能衰竭研究小组的报告,APAP相关肝衰竭约占所有成人ALF的46%,远远超过特异性药物引起的肝损伤[2, 3]。对于ALF且无其他治疗手段的患者,肝移植是唯一治疗选择[4],但肝移植治疗费用昂贵,并且存在肝源短缺等问题。因此,探究其病因机制,寻找合适的治疗药物,有效控制APAP诱导损伤已成为医学界关注和亟需解决的问题。
研究表明,非编码RNA,包括微小RNA(microRNA)和长链非编码RNA(long non-coding RNA,LncRNA)参与急性脑部、肾脏损伤中所致的自身结构和功能变化的病理过程,为APAP相关肝损伤患者提供了重要的治疗选择[5, 6]。由于多数LncRNA的结构与mRNA有一定相似性,提示 miRNA可能通过类似于mRNA 的作用机制负性调控LncRNA的表达,进而发挥一系列生物学作用[7]。近几年,关于miRNA影响细胞功能的研究逐渐增多,其中LncRNA 核富含丰富的转录本1(NEAT1)引起了关注[8]。研究探讨了LncRNA NEAT1在APAP诱导急性肝损伤过程中的作用。
材料与方法
一、实验材料
6~8周龄雄性C57BL/6小鼠8只,均购于上海斯莱克动物实验中心。实验所需新鲜APAP以及用于气体麻醉的异氟烷购于美国Sigma公司。
二、APAP诱导肝损伤模型建立
将C57BL/6小鼠随机分为实验组和对照组,每组各4只。将新鲜APAP溶解在预热的磷酸盐缓冲液(PBS,pH7.4)中,小鼠禁食过夜后,实验组腹腔注射APAP(300 mg/kg),对照组注射0.9%NaCl溶液。APAP给药后24 h对所有实验小鼠实施安乐死,收集血清和肝脏组织,将一部分肝组织立即甲醛固定,其余组织在液氮中快速冷冻并储存在-80 ℃下备用。
三、小鼠原代肝细胞提取
用含有胶原酶(Sigma,美国)的平衡盐溶液灌注肝脏分离原代细胞。用EGTA缓冲液经门静脉以5 mL/min的速度灌注肝脏8 min。随后,用含有胶原酶的灌注缓冲液以5 mL/min灌注肝脏10 min。然后将肝脏在含有胶原酶的消化缓冲液中解离,用70 μm细胞过滤器过滤。以400 r/min离心5 min收集肝细胞。计数分离的肝细胞并接种在培养板中。在LncRNA NEAT1干预实验中,在APAP(5 mM)加入前48 h,运用转染试剂Lipofectamine 2000 (Invitrogen,美国)将LncRNA NEAT1小干扰RNA(吉玛基因,上海)、相应的阴性对照(吉玛基因,上海)加入到肝细胞培养基中进行转染。
四、血清ALT和AST测量
使用异氟烷麻醉小鼠,抗凝管眼球取血,立即1 500×g,4℃离心,取上清液,应用全自动生化仪检测小鼠ALT和AST。
五、组织学分析
小鼠肝组织用石蜡包埋固定,切成5 μm厚的切片后行苏木精伊红(HE)染色,进行形态学评价。
六、RNA分离和实时荧光定量PCR(qPCR)
使用TRIzol试剂(Invitrogen,美国)从小鼠组织中提取总RNA。用TaqMan miRNA试剂盒(Life Technologies)测定LncRNA NEAT1的表达,以Sno202为内参。用PrimeScript RT试剂盒(Takara,日本)合成cDNA。用SYBR Premix Ex Taq RT-PCR试剂盒(Takara)通过qPCR测定小鼠基因的表达,以GAPDH为内参。
七、统计分析

结 果
一、APAP处理后小鼠肝组织中LncRNA NEAT1表达
如图1所示,HE染色结果表明,APAP处理后对小鼠肝脏实质造成了严重损伤。进一步检测小鼠血清转氨酶变化,结果表明,与对照组相比,APAP处理组小鼠血清中的ALT和AST显著增加,差异有统计学意义(表1)。进一步检测LncRNA NEAT1的表达变化。结果表明,与对照组相比,APAP处理组小鼠肝组织LncRNA NEAT1的表达量增加近3倍,(1.027±0.07823)比(2.825±0.2094)差异有统计学意义,(P<0.05)。
二、体外敲低LncRNA NEAT1的表达加重APAP诱导的肝细胞损伤
分离小鼠原代肝细胞进行体外实验,与体内结果一致,在原代肝细胞培养基加入APAP刺激24 h后提取RNA,与对照组相比,LncRNA NEAT1的表达量增加3倍,(1.131±0.1882)比(3.023±0.3820)差异有统计学意义,P<0.05)。进一步使用siRNA敲低肝细胞LncRNA NEAT1的表达并加入APAP刺激,结果表明,与对照组相比,实验组肝细胞上清的ALT、AST显著增加(表2),差异有统计学意义。
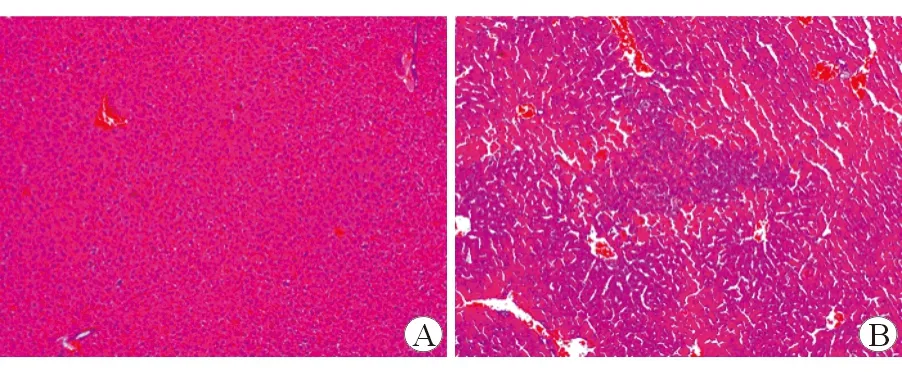
图1 PBS组和APAP组小鼠肝组织光学显微镜下

组别鼠数ALT(U/L)AST(U/L)PBS组442.75 ± 2.345.05 ± 4.1APAP组47565 ± 763.37718 ± 901.6t值9.854P值0.001

表2 siRNA组和LncRNA ENAT1-siRNA组小鼠转氨酶比较(±s)
讨 论
研究表明,核受体亚家族2组E成员3(NR2E3)蛋白可能通过调节损伤诱导lncRNA和P53蛋白之间相互作用在APAP诱导肝损伤中发挥重要作用[9]。Zheng等[10]研究发现,在APAP诱导肝损伤中肝内稳态维持和修复过程中,筛选出的4个lncRNA可能通过代谢和凋亡相关途径发挥调节作用。
本研究结果发现,①在APAP处理后小鼠肝组织以及小鼠原代肝细胞中LncRNA NEAT1表达均明显增加,表明APAP细胞毒性条件下诱导了LncRNA NEAT1表达。同时,LncRNA NEAT1可能参与了APAP诱导肝损伤的过程。②在体外实验中,用小干扰RNA敲低肝细胞LncRNA NEAT1的表达后,加入APAP诱导细胞损伤,通过血清ALT和AST水平验证,LncRNA NEAT1的表达降低促进APAP诱导的肝细胞死亡。以上结果提示LncRNA NEAT1可能在APAP诱导的肝损伤病理生理过程起重要的保护作用,为临床上治疗APAP诱导的肝损伤开辟了新思路。
研究证明,LncRNA与miRNA相互作用,参与靶基因的表达调控从而参与胞内信号通路在人类多个器官的损伤中发挥重要作用[11-12]。在本研究中,LncRNA NEAT1可能通过调节miRNA参与APAP诱导肝损伤过程,其具体分子机制有待进一步研究。LncRNA研究热点越来越倾向于操控miRNA体内表达以达到治疗目的,以及运用循环miRNA作为肝损伤的诊断和衡量预后的生物标志物[13]。今后应进一步研究APAP过量后LncRNA NEAT1随时间的变化关系,来验证LncRNA NEAT1是否可成为肝损伤的新生物标志物。
总之,LncRNA NEAT1在APAP诱导肝损伤中的保护作用,为药物性肝损伤发病机制的提供了新的见解。未来通过增加LncRNA NEAT1表达来调节APAP诱导细胞毒性作用,可能是一种具有前景的治疗策略。
