基于GEO数据库芯片探索miRNA参与肝纤维化的潜在机制
2020-01-13黄翀郑雅慧张巨波
黄翀 郑雅慧 张巨波
肝纤维化是病毒性肝炎、酒精性肝病等各种慢性肝损伤后肝脏的创伤愈合反应,其特征为肝脏中过量细胞外基质蓄积,破坏肝组织结构和功能,是慢性肝病发展至肝硬化的必经病理阶段[1-6]。最新全球疾病负担数据显示,2017年超过132万人死于各种慢性肝病及相关肝硬化,造成了严重的社会经济负担[7]。因此当前亟待阐明肝纤维化的发病机制,制订有效的抗纤维化治疗策略,改善患者预后。
资料与方法
一、数据来源
本研究芯片数据下载自GEO数据库(https://www.ncbi.nlm.nih.gov/pubmed)。GSE19865芯片采用GPL8824平台(Agilent-019119 Mouse miRNA Microarray 1.0 G4472A),包含3只橄榄油处理小鼠及5只四氯化碳处理小鼠。GSE66278芯片采用GPL17017平台(TaqMan Rodent microRNA A array v 2.0),包含2只正常小鼠及6只四氯化碳处理小鼠。
二、芯片分析及差异miRNA筛选
miRNA芯片分析采用数据库自带软件GEO2R(https://www.ncbi.nlm.nih.gov/geo/geo2r)。GSE19865芯片以橄榄油处理组为对照组,四氯化碳处理组为肝纤维化组进行分析。GSE66278以正常小鼠为对照组,四氯化碳处理组为肝纤维化组进行分析。选取P<0.05且差异倍数|logFC|≥0.585为条件筛选差异 miRNA。
三、miRNA靶基因预测
miRNA靶基因预测采用TargetScan(http://www.targetscan.org/vert_72/)及microT-CDS(http://diana.imis.athena-innovation.gr/DianaTools/index.php?r=microT_CDS/index)两款在线软件进行分析,预测结果取交集得到miRNA靶基因。
四、靶基因功能分析
利用Cytoscape 软件(version 3.5.1)的ClueGO插件对靶基因进行功能分析,包括Gene Ontology(GO) biological process, GO molecular function以及Reactome pathway分析,对P<0.05的富集结果通过Cytoscape进行可视化。
结 果
一、差异microRNA
通过GEO2R进行芯片分析,按P<0.05且差异倍数|logFC|≥0.585为条件筛,GSE19865芯片中miRNA上调37个,下调0个;GSE66278芯片中miRNA上调19个,下调18个,见表1。两组芯片中表达均上调的miRNA为mmu-miR-802,见图1A,其在不同芯片中的表达水平见图1B。
二、miRNA靶基因
TargetScan预测得到mmu-miR-802潜在靶基因250个,microT-CDS预测分析显示mmu-miR-802潜在靶基因为666个,通过对两款软件预测结果取交集得到mmu-miR-802靶基因138个,见图2。
三、靶基因Pathway分析及GO分析
通过Cytosccape插件ClueGO对138个靶基因进行功能分析,结果显示上述基因显著富集于22条Reactome pathway,36种生物学过程及21种分子功能,见图3。其中富集最显著的前10位的信号通路为:Mitochondrial biogenesis, Signaling by TGF-beta receptor complex, PKMTs methylate histone lysines, Toll like receptor (TLR) 4 cascade, MyD88:MAL(TIRAP) cascade initiated on plasma membrane, MyD88-independent TLR4 cascade, TLR9 cascade, TLR10 cascade, TLR3 cascade, TLR5 cascade; 富集最显著的前10位生物学过程包括Histone-lysine N-methyltransferase activity, Regulation of nucleobase-containing compound transport, Wnt signaling pathway, calcium modulating pathway, Activation of JUN kinase activity, Response to gamma radiation, Circadian regulation of gene expression, Cellular response to glucose starvation, Protein neddylation, Adipose tissue development, Cellular response to amino acid stimulus; 富集最显著的前10位分子功能包括Protein self-association, Thyroid hormone receptor binding, Positive regulation of lipase activity, Positive regulation of JUN kinase activity, Activation of JUN kinase activity, Poly-Pyrimidine tract binding, Poly(U) RNA binding, Histone methyltransferase activity, Protein-lysine N-methyltransferase activity, Lysine N-methyltransferase activity。
四、靶基因PPI网络分析
将138个靶基因上传至NetworkAnalyst网站(http://www.networkanalyst.ca/),选择STRING数据库进行蛋白相互作用分析,生成蛋白相互作用网络图,见图4。如图所示,根据蛋白相互作用的程度,鉴定出网络中包含8个关键基因:YWHAE,PPP2CA, RHOA, FOS, PSMD2,CDK19,ATF2,PAFAH1B1。
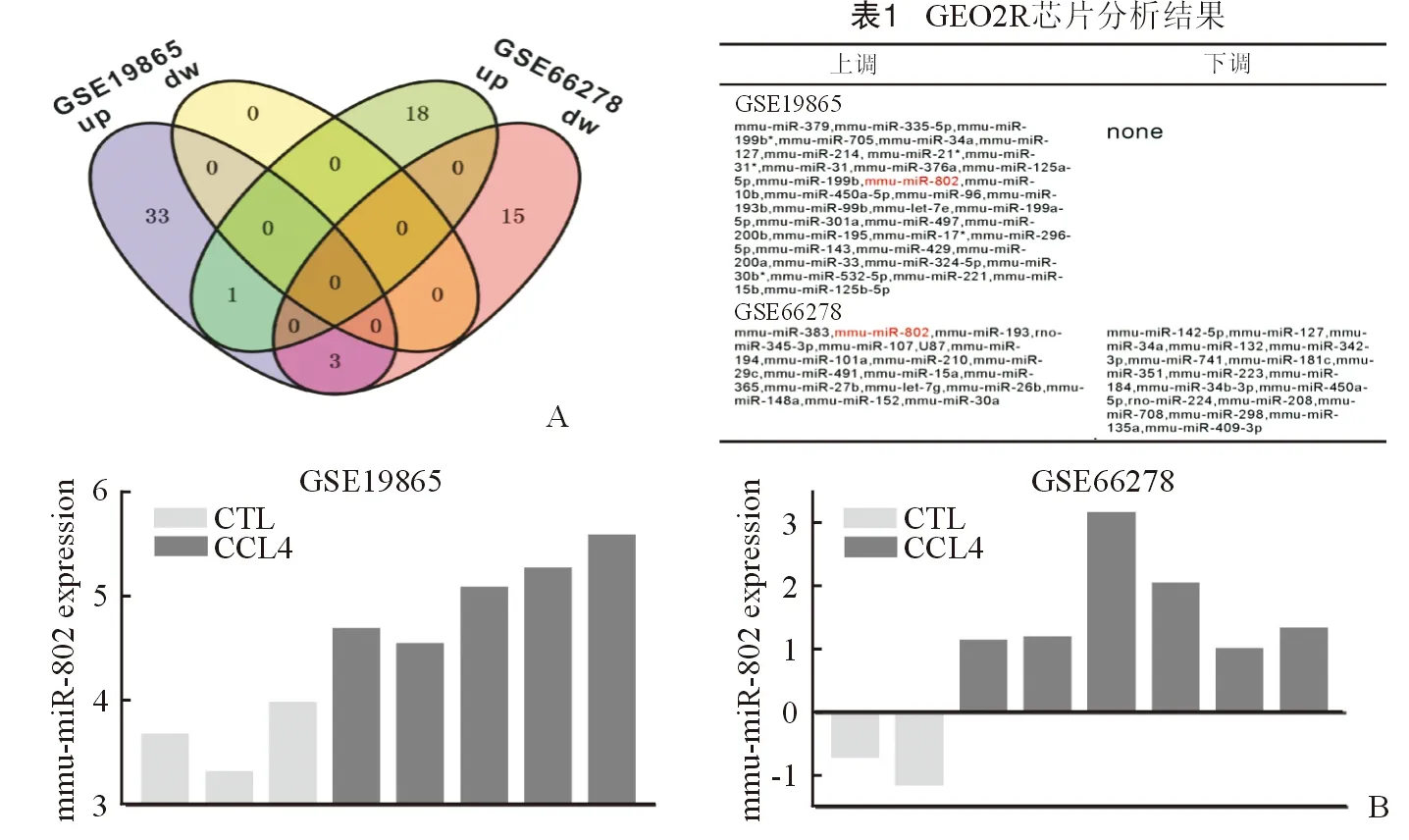
图1A 韦恩图显示基因芯片GSE19865及GSE66278中差异基因分布情况,右侧为具体基因名称,红色标注的miR-802为两组芯片中表达均上调的miRNA B miR-802在两组芯片不同样本中的表达水平
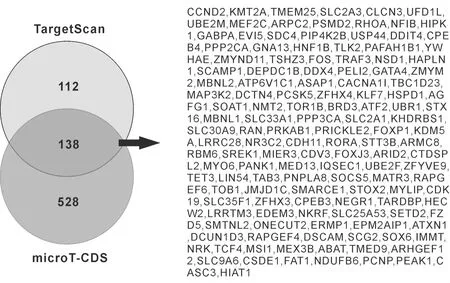
图2 韦恩图显示同时被TargetScan及microT-CDS预测到的miR-802靶基因有138个
讨 论
肝纤维化的发生是促纤维化因子刺激下各种信号通路相互作用的复杂过程,涉及众多基因表达的调控,包括表观遗传学调控[8]。本研究通过GEO数据库获取肝纤维化miRNA芯片GSE19865及GSE66278,利用差异基因在线分析工具GEO2R获取差异表达miRNA,通过取交集得到肝纤维化模型中表达上调的miRNA,即miR-802。通过综合TargetScan及microT-CDS软件预测结果,得到138个靶基因。通路分析显示,这些靶基因主要参与线粒体生成,TGF-beta信号通路,组蛋白赖氨酸甲基化,Toll样受体信号传导等;生物学过程分析提示靶基因主要参与组蛋白赖氨酸甲基化,碱基转运,Wnt及钙调通路,JUN 激酶活化,基因表达的昼夜调控,葡萄糖饥饿的细胞应答, 蛋白类泛素化修饰,脂肪组织发育及细胞对氨基酸刺激的应答;此外分析提示靶基因的分子功能包括结合甲状腺激素受体,正向调控脂肪酶活性,正向调控JUN 激酶活性,组蛋白甲基化等。
通过蛋白间相互作用分析,发现了8个位于调控网络中心的关键蛋白: YWHAE、PPP2CA、 RHOA、FOS、PSMD2、CDK19、ATF2、PAFAH1B1。RHOA是Rho家族一员,属于小分子GTP酶,是信号转导的分子开关之一,在细胞增殖、迁移、黏附等过程中发挥重要作用。已有研究表明,RhoA能够调控潜伏态TGF-β1分泌,并能影响Ⅰ型胶原表达[9,10]。研究发现,活性增强能够促进肝星状细胞活化,加重肝纤维化[11]。YWHAE是信号通路中重要的接头蛋白,通过结合含有磷酸丝氨酸的蛋白介导信号转导。既往研究发现,YWHAE能够调控神经元形态发生[12]。此外,YWHAE能够阻止小鼠受精卵由G2期进入M期[13],YWHAE在肝纤维化中的作用有待进一步研究。PPP2CA是蛋白磷酸酶2 A的催化亚基,蛋白磷酸酶2 A是最主要的丝/苏氨酸磷酸酶之一,参与细胞生长及分化的负向调控。前列腺癌时,PPP2CA能够逆转上皮间质转化,进而抑制肿瘤细胞的生长及转移[14]。PPP2CA能够抑制甲状腺癌细胞的迁移及侵袭[15],PPP2CA在肝纤维化中的作用目前尚未见报道。FOS能够与JUN家族蛋白二聚化形成转录因子复合体,从而调控细胞增殖、分化及转化等过程,此外,某些情况下FOS表达与细胞凋亡相关。早期研究发现,c-FOS能够促进增殖性疾病如肺癌、间皮瘤及肺纤维化等发展,而抑制蛋白激酶C能够减少c-FOS表达,有望阻止疾病进展[16]。c-FOS表达见于丙型肝炎病毒感染患者,且其表达与肝纤维化分期及肝炎症分级相关[17]。高糖可以诱导FOS表达,促进TGF-beta1产生,从而导致腹膜纤维化的发生[18]。在心肌成纤维细胞中,c-FOS能够诱导细胞外基质蛋白过表达,引起心脏纤维化[19],在肝纤维化中FOS是否发挥类似作用有待明确。PSMD2为26S蛋白酶体的非催化亚基之一,蛋白酶体主要参与蛋白质降解。既往研究发现,敲低PSMD2表达能够减弱蛋白酶体活性,抑制肺癌细胞生长,诱导其凋亡[20]。PSMD2通过增强蛋白酶体对p21及p27的降解,促进肿瘤细胞增殖生长[21]。在辐射导致的皮肤纤维化大鼠模型中,通过蛋白组学分析发现,包括PSMD2在内的多个蛋白酶体亚基异常表达,提示靶向泛素-蛋白酶体系统或能有效治疗皮肤纤维化[22]。目前,尚无报道阐明PSMD2在肝纤维化中的作用。CDK19属于周期蛋白依赖性激酶之一,在多种细胞生物学过程中发挥重要作用,包括脂质代谢调控及发育生物学等[23]。CDK19能够促进NF-κB介导的基因转录[24]。在多种肿瘤中,CDK19通过诱导上皮间质转化促进肿瘤侵袭转移[25],然而CDK9介导的上皮间质转化是否参与肝纤维化的发生目前仍不清楚。ATF2为作为转录因子能够结合DNA,该过程依赖于ATF2形成同源二聚体或与c-Jun形成异源二聚体,激活CRE依赖的转录过程。实验发现ATF2还具有组蛋白乙酰转移酶活性,能够特异性介导组蛋白H2及H4乙酰化[26]。早期研究发现,博来霉素能够促进ATF2磷酸化,进而介导肺纤维化的发生[27]。在心脏纤维化中,去甲肾上腺素能够增强TGF-beta1对ATF2的磷酸化作用,促进心脏纤维化进展[28]。ATF2是否影响肝纤维化有待进一步证实。PAFAH1B1是血小板活化因子乙酰水解酶的非催化亚基,又称LIS1,该基因突变或缺失会导致无脑回综合症。研究发现,YWHAE及PAFAH1B1基因微缺失会导致独特的脑白质病变[29]。此外,研究表明PAFAH1B1基因单倍体不足会扰乱齿状回GABA神经元,破坏突触的兴奋/抑制平衡[30]。在肝脏内,PAFAH1B1缺失会诱发脂肪肝,并加速小鼠肝癌的发生[31],但其在肝纤维化中的具体作用有待进一步探索。
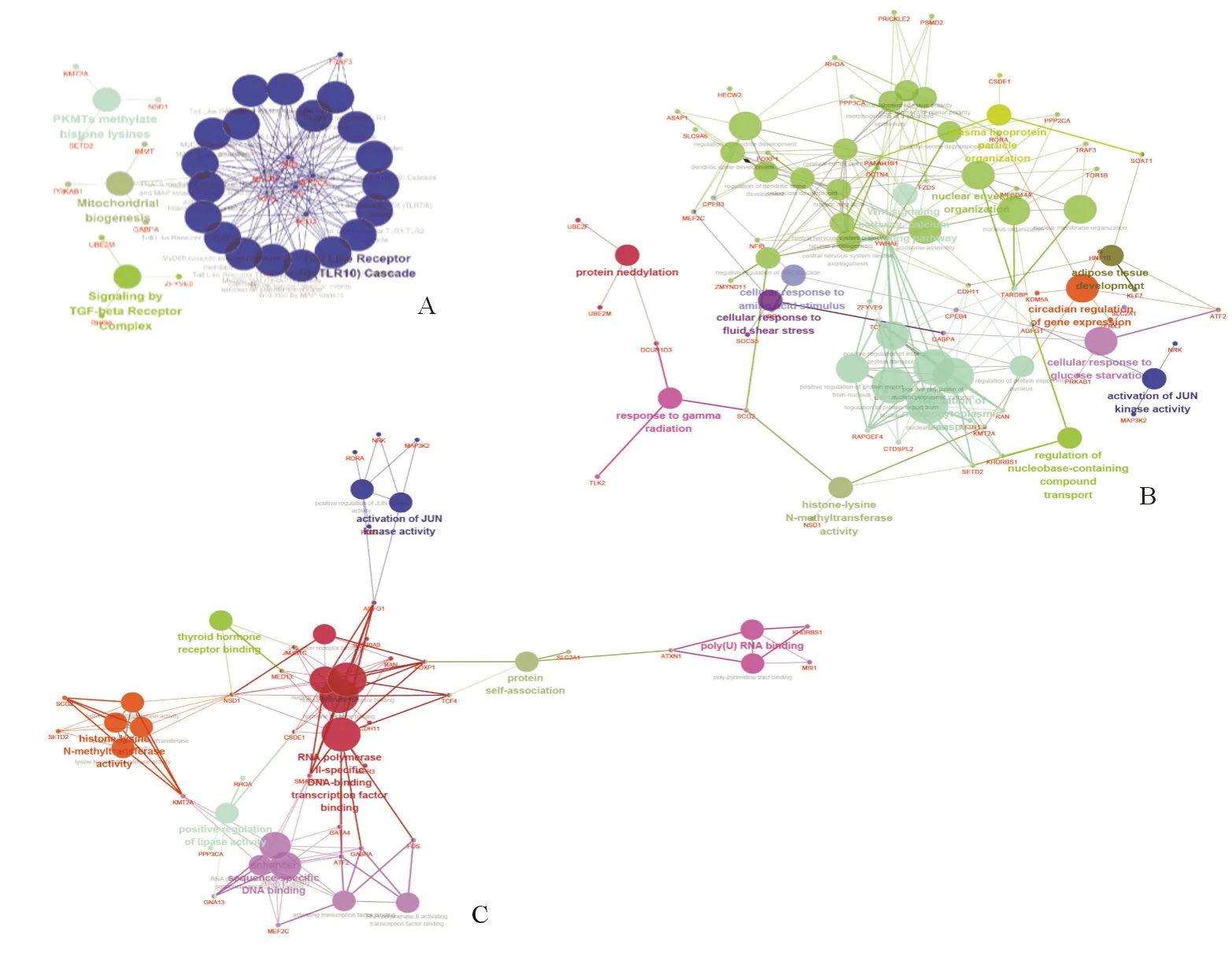
A Reactome 通路分析 B GO生物学过程分析 C GO分子功能分析
图3miR-802靶基因功能分析
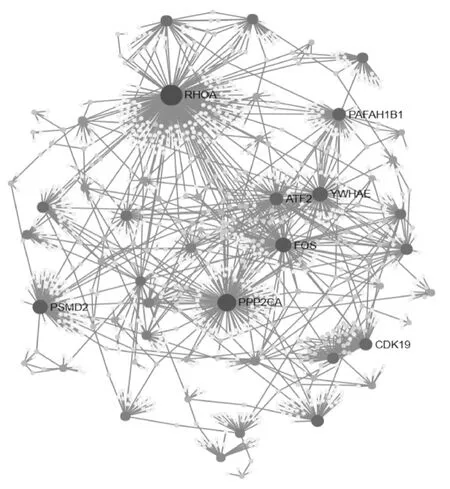
图4 基于STRING数据库的蛋白质相互作用网络分析
本研究从GEO数据库获取不同肝纤维化基因芯片,通过差异表达分析发现miR-802在纤维化组表达显著上调。通过结合不同软件进行靶基因预测,得到了138个潜在的miR-802靶基因。随后,借助生物信息学软件,对这些靶基因的功能进行了富集分析,发现多条信号通路及生物学过程参与了肝纤维化的发生发展。最后,通过蛋白互作网络分析,发现了8个核心基因,其中RHOA能够通过调控潜伏态TGF-beta1分泌及I型胶原表达参与肝纤维化。FOS,ATF2在肺纤维化及心脏纤维化发挥一定作用,PSMD2参与了皮肤纤维化的发生,PAFAH1B1能够诱发脂肪肝的发生,这些基因在肝纤维化中的作用有待进一步阐明,而YWHAE,PPP2CA,CDK19目前尚无纤维化性疾病或肝脏疾病中的相关报道,但其在肝纤维化中的潜在作用值得关注和探索。
