p38 MAPK在腹泻型肠易激综合征大鼠中的变化及其免疫调控作用
2020-01-01郭军雄汪斌马丽康万荣许小敏徐生刚
郭军雄,汪斌,马丽,康万荣,许小敏,徐生刚
(1. 河西学院医学院,河西学院丝绸之路中医药研究中心,河西学院中西医结合研究所,甘肃 张掖 734000; 2. 甘肃中医药大学,兰州 730000)
肠易激综合征(irritable bowel syndrome,IBS)是一种以腹痛或腹部不适并常伴排便习惯改变为特征的慢性肠功能紊乱性疾患,胃肠动力和内脏感知异常是IBS发病的主要病理生理学特征,迄今具体发病机制尚无完全定论[1-2]。近年来,随着生活节奏增快和压力增大,发病率有上升的趋势[3]。而免疫系统作为D-IBS精神-肠道因素互动的关键纽带,其平衡对D-IBS内脏敏感性有重要影响[4]。前期研究表明[5]:慢性束缚(S)联合番泻叶(F)灌服法复建的大鼠Th1促炎因子IL-12的含量升高,Th2 抑炎因子IL-10的含量降低,可能存在Th1/Th2平衡漂移。p38 MAPK是MAPK家族中最重要的成员之一,其作为细胞信号传递的交汇点,能被应激、氧化反应以及炎性细胞因子等多种因素所激活。有研究表明[6-7]:p38 MAPK信号通路系统在疼痛感知、胃肠动力紊乱和免疫炎症异常激活中均有重要作用。本研究旨在通过观察D-IBS模型大鼠结肠组织中p38 MAPK蛋白的表达和血清中IL-1β、IL-6、TNF-α的变化及其相关性,探讨p38 MAPK通路在S+F灌服法诱发的D-IBS“肝郁脾虚证”大鼠模型中的免疫作用。
1 材料与方法
1.1 材料
1.1.1 实验动物
SPF级Wistar大鼠40只(雌雄各半),8~10周龄,体重(180±20)g,购自甘肃中医药大学科研实验中心【SCXK(甘)2015-0002)】。饲养于甘肃中医药大学科研实验动物中心SPF级环境中【SYXK(甘)2015-0005)】。实验动物所有操作取得了甘肃中医药大学实验动物伦理委员会批准(伦理审批号:2016-025)。
1.1.2 主要试剂和仪器
大鼠 IL-1β ELISA检测试剂盒(货号:MM-0047R1)、大鼠 IL-6 ELISA 检测试剂盒(货号:MM-0190R1),大鼠 TNF-α ELISA 检测试剂盒(货号:MM-0180R1),均购自江苏酶免实业有限公司。p38MAPK抗体试剂盒(批号:40100),购自 GeneTex 公司;SP-9001生物素标记山羊抗兔IgG免疫组化检测试剂盒(批号:K186613C),DNA显色试剂盒(批号:K186916P)。以上测试盒均购自北京中杉金桥公司。番泻叶中药饮片,由康美药业股份有限公司(批号:170302511)。
酶标仪(iMark,Bio-Rad,美国);台式高速离心机(18R,Dynamica Velocity,德国);显微镜(BX43,Olympus,日本);自动真空组织脱水机(ASP200S,Leica,德国);图像分析软件(Image-Pro Plus 6.0,Media Cybemetics,美国)。
1.2 方法
1.2.1 复建D-IBS“肝郁脾虚证”大鼠模型
实验时先将番泻叶水浸泡5 h,煎煮8 min、纱布两层过滤取上清液,常规浓缩,最终浓度相当于含生药0.4 g/mL药液,待用。
40只雌雄各半SPF级Wistar大鼠称重后,随机分为D-IBS模型I(造模7 d)、II(造模14 d)、III(造模21 d)组及空白对照组,每组10只。参考文献方法[8-9],采用慢性束缚应激加番泻叶水煎剂灌服二因素法复建D-IBS“肝郁脾虚证”大鼠模型。模型各组大鼠实验前10 h禁食不禁水,予以番泻叶水煎剂4 g/(kg·d)灌服,每日1次,灌服番泻叶水煎剂后用宽透明胶带束缚大鼠肩部及前肢和胸腹部,使大鼠无法用前肢抓搔头面,每天定时约1 h,分别连续建模7、14、21 d。空白对照组大鼠予等体积蒸馏水灌服21 d。
1.2.2 血清/结肠组织的处理
分别于建模结束后第2天,大鼠称重麻醉,仰卧并铺巾,沿大鼠腋窝下皱襞做一垂直于左腋前线与前正中线的连线,在连线中点处行心脏采血约5 mL,室温静置20 min,3000 r/min 离心15 min,取上层血清,-80℃保存;剖腹截取距肛门5~8 cm 处结肠组织,生理盐水洗净肠内容物,4%多聚甲醛固定,常规切片染色,并行免疫组化检测。空白对照组和模型Ⅲ组同时取材。
1.2.3 ELISA法检测大鼠血清中IL-1β、IL-6、TNF-α的水平
取原倍标准品稀释、加样、37℃温育30 min、洗板5次,加入酶标试剂,37℃温育30 min,洗板5次,加入显色液,37℃显色10 min,加入终止液,15 min内读OD值。
1.2.4 免疫组化法观察大鼠结肠 p38 MAPK蛋白表达
常规切片,二甲苯脱蜡,10 min × 2 次,(梯度乙醇脱水)而后依次置于无水乙醇I、II、95%、80%酒精中各5 min,置于H2O2室温20 min,以灭活内源性过氧化物酶。PBS冲洗3 min × 3次,枸橼酸钠高压锅热修复后冷却,PBS 洗3 min × 3次。滴加一抗p38 MAPK (1∶100) 于湿盒中4℃过夜,37℃复温1 h;PBS洗3 min × 3次后加二抗,室温30 min;PBS洗3 min × 3次。滴加SP(链霉亲和素-过氧化物酶),37℃孵育20 min;PBS洗3 min × 3次,滴加DAB显色剂;自来水冲洗、苏木素复染、盐酸酒精分化、脱水、透明、中性树胶封片。每组选取8张切片,在显微镜高倍视野(10×20 倍)下每张切片选取6个视野,采用Imagine-Pro-Plus分析系统进行图像采集和定量分析,计算所选择区域内的平均吸光度,平均吸光度=累积吸光度/有效统计区域面积,并取平均值。
1.3 统计学分析

2 结果
2.1 各组大鼠结肠黏膜组织病理学观察
空白对照组结肠黏膜上皮较完整,细胞排列规整,未见肠黏膜上皮细胞坏死脱落,固有层腺体亦无萎缩,黏膜下层未见明显改变。模型I、II组黏膜上皮细胞部分坏死脱落,固有层腺体萎缩,可见血管充血,间质水肿,有少量炎性细胞浸润;模型 III 组黏膜上皮细胞坏死脱落,固有层腺体萎缩减少,黏膜下层结构疏松水肿充血,有较多炎性细胞浸润,见图1。
2.2 各组大鼠结肠组织p38 MAPK免疫组化染色
显微镜下观察结肠中p38 MAPK蛋白表达,呈现棕黄色者为阳性表达,无着色则为阴性表达。研究结果表明,p38 MAPK蛋白在肌层、黏膜层、黏膜下层均有不同程度的表达。与空白对照组相比,模型各组大鼠结肠p38 MAPK蛋白表达IOD值显著升高(P<0.05),尤以造模14 d和21 d最为显著(P<0.01),见图2和图3。
2.3 各组大鼠血清IL-1β、IL-6和TNF-α的检测结果
与空白对照组比较,模型I组、模型II组、模型III组大鼠血清IL-1β、IL-6、TNF-α含量显著升高(P<0.05,P<0.01),见表1,图4。
2.4 各组大鼠p38 MAPK与IL-1β、IL-6和TNF-α相关性分析
Pearson相关系数均为正值,提示p38 MAPK与IL-1β、IL-6、TNF-α呈正相关,尤以D-IBS大鼠模型 II、 III组最为显著(P<0.05),见表2,图5。
3 讨论
IBS 临床症状多样,病因及发病机制复杂。但应激在IBS发病发展中的作用越来越受到人们的重视。应激可通过塑造内脏高敏感性、促进肠道低度炎症等参与IBS的发生与发展[10]。有文献证实[11],
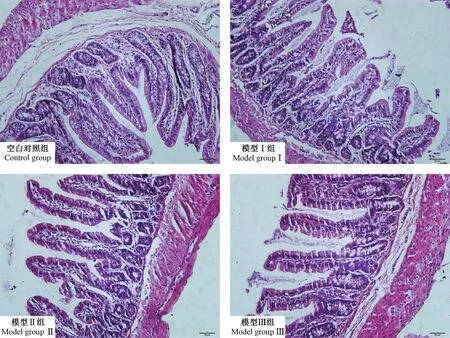
图1 各组大鼠结肠组织病理学变化(HE染色,标尺=50 μm)Figure 1 Pathological changes of colon tissue in the rats of each group (HE staining, Bar=50 μm)
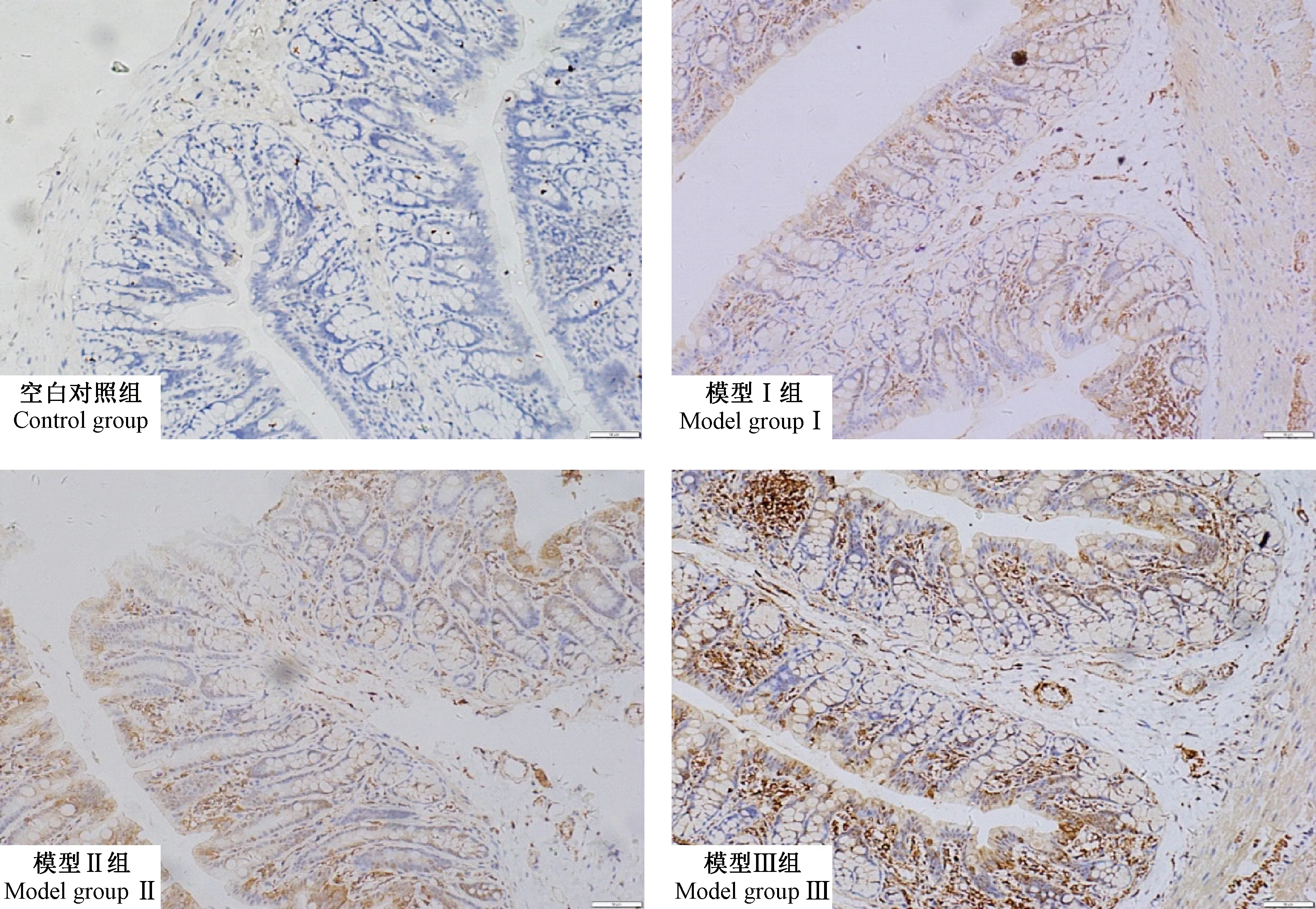
图2 各组大鼠结肠组织中p38 MAPK的表达(免疫组化染色,标尺=50 μm)Figure 2 p38 MAPK expression in colon tissue of the rats in each group (Immumohistochemical staining, Bar=50 μm)
表 1 各组大鼠血清IL-1β、IL-6和TNF-α的含量Table 1 Changes of serum expression of IL-1β,IL-6 and TNF-α in the rats of each s)
注:与空白对照组对比,☆P<0.05,★P<0.01;与模型Ⅰ组对比,△P<0.05,▲P<0.01;#造模第17天大鼠死亡1只。
Note. Compared with the control group,☆P<0.05,★P<0.01. Compared with the model group I,△P<0.05,▲P<0.01.#One rat died on the 17th day.
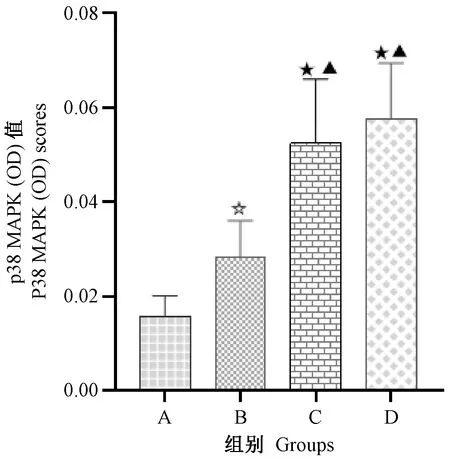
注:A:空白对照组;B:模型Ⅰ组;C:模型Ⅱ组;D:模型Ⅲ组。与空白对照组相比,☆P<0.05,★P<0.01;与模型Ⅰ组相比,△P<0.05,▲P<0.01。下图同。图3 各组大鼠结肠组织中p38 MAPK表达OD值Note. A, Control group; B, Model group I; C, Model group II; D, Model group III. Compared with the control group,☆P<0.05,★P<0.01. Compared with the model group I,△P<0.05, ▲P<0.01.The same in the following figures.Figure 3 OD value of p38 MAPK expression in colon tissues of the rats in each group
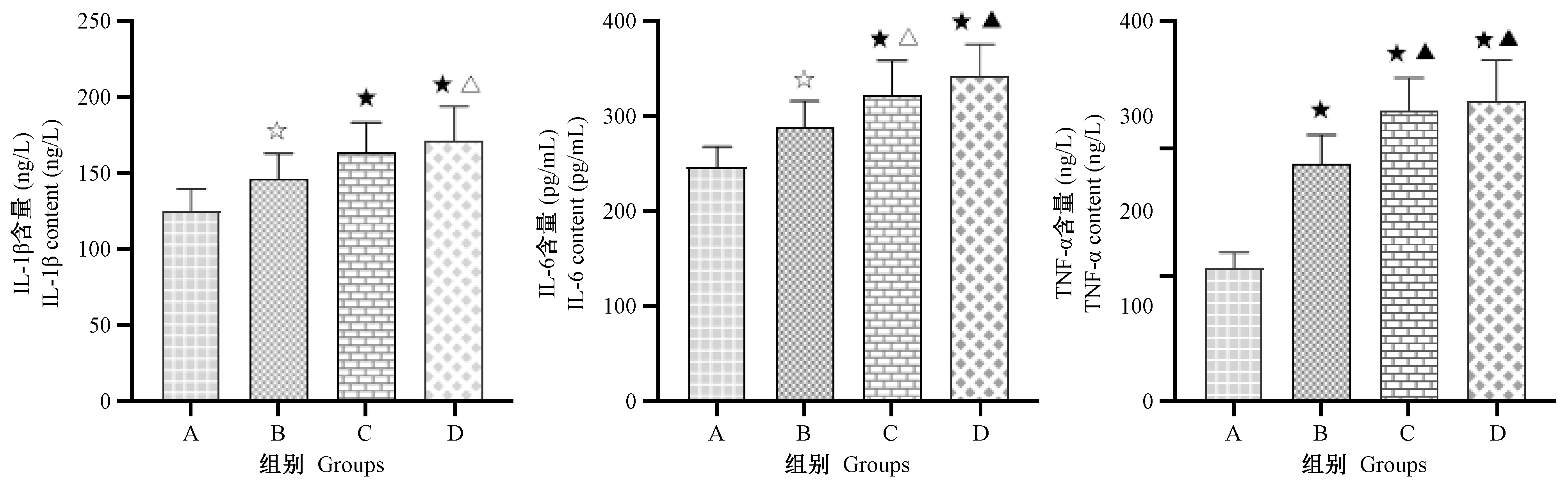
图4 各组大鼠血清IL-1β、IL-6和TNF-α含量Figure 4 Contents of IL-1β, IL-6 and TNF-α expression in the serum of each group

表2 各组大鼠p38 MAPK与IL-1β、IL-6和TNF-α 的相关性分析Table 2 Correlation analysis between p38 MAPK and IL-1β, IL-6, TNF-α in the rats
注:与同组p38 MAPK的相关性,☆P<0.05。
Note. Correlation with p38 MAPK in the same group,☆P<0.05.

图5 p38 MAPK与IL-1β、IL-6和TNF-α的相关性Figure 5 Correlation of p38 MAPK with IL-1β, IL-6 and TNF-α
IBS患者存在着肠道低度炎症,而多种肠道黏膜炎症又可以致使胃肠动力和内脏感觉异常。而p38 MAPK通路是目前已鉴定出的经典MAPK信号转导路径之一,是细胞外信号引起细胞反应的一个共同通路,它几乎参与了机体内所有的生理及病理过程,而它在介导炎症、应激等细胞反应中的作用尤其引人关注[12]。p38 MAPK主要位于细胞浆内,其活性在生理情况下是很低的。一旦被特定因素如细胞因子(TNF-α、IL-6、IL-1β)、细菌病原体及其产物、紫外线照射、细胞外高渗等刺激均可激活p38 MAPK,所有被激活的p38 MAPK成员都具有苏氨-甘氨酸-酪氨酸(Thr-Gly-Tyr,TGY)双位点磷酸化模块,即p38 MAPK需在Thr180和酪氨酸182两个位点经过两步磷酸化实现激活。活化后p38 MAPK调控下游多种酶及转录因子的基因表达活性,进而调节细胞功能,释放炎性因子,而炎性因子又对细胞形成新的刺激,导致MAPK信号通路的再次激活,从而形成正反馈调节,最终导致炎症因子的过量表达。研究表明[13-16],用细菌内毒素脂多糖刺激大鼠巨噬细胞后,可致巨噬细胞内p38 MAPK磷酸化,而抑制此阶段的p38 MAPK磷酸化可减轻甚至完全阻断巨噬细胞内TNF-α的产生,说明炎性反应中TNF-α的产生与p38 MAPK 激活密切相关,而且p38 MAPK的激活除能促进单核巨噬细胞产生TNF-α、IL-1、IL-6等炎症因子,影响炎症进程。所以,在调控细胞因子产生的机制中,p38 MAPK 起着类似“开关”的作用。IL-1β是由激活的单核巨噬细胞和上皮细胞分泌产生的炎症介质,可引发一系列的肠道炎症和黏膜损伤。IL-1β还能增加肠上皮细胞紧密结合部的通透性,抑制钠-钾-ATP酶活性,进而导致水、钠的吸收障碍,产生腹泻及肠道运动功能紊乱[17]。IL-6是一种多功能复杂的细胞因子,在炎症过程中,IL-6 可以促进中性粒细胞和单核细胞在炎症及感染部位的聚集,防止组织的过度损伤,IL-6还可通过神经内分泌调节作用于肠道神经元和平滑肌细胞,导致胃肠道动力系统的变化,引起肠道运动和感知的改变[18-19]。TNF-α具有广谱生理和病理效应的炎性细胞因子,被认为是肠黏膜屏障损伤的重要启动因子[20]。已有研究阐明[21-22],TNF-α一方面可改变肠道组织紧密连接蛋白ZO-1和occludin的表达和分布、重组肌动蛋白骨架;另一方面可通过激活 NF-κB,诱导产生多种炎性因子如IL-1β、IL-6等,进而加重对肠黏膜屏障的损伤。
制备符合人类D-IBS发病机制的动物模型是研究D-IBS发病机制、病理生理和探索新型治疗策略的工作基础,而现有的文献报道的造模方法中,新生母子分离联合慢性束缚加番泻叶灌胃模型耗费时间长,死亡率高,乙酸灌肠合并束缚模型肠道黏膜损伤,基因模型技术高,费用贵,且不易获得。唯有番泻叶联合传统束缚应激法能更好得模拟人的D-IBS发病,番泻叶提取物灌服小鼠后无可见的光镜变化,慢性束缚应激过程为非损伤刺激且更接近人的心理应激[5,23],符合D-IBS的发病机制。
本研究结果显示,以番泻叶联合传统束缚应激法复建的D-IBS“肝郁脾虚证”大鼠模型结肠组织中p38 MAPK蛋白表达和血清IL-1β、IL-6、TNF-α的显著含量升高(P<0.05,P<0.01),尤以模型Ⅱ、Ⅲ组最为显著(P<0.01),表明番泻叶灌胃联合传统束缚应激法复建 D-IBS“肝郁脾虚证”大鼠模型存在一定的时效关系。HE染色表明各组大鼠结肠组织黏膜未见糜烂或溃疡,结肠组织形态学无明显病理变化,符合D-IBS属于功能性肠紊乱性疾病的特征。本研究进一步通过相关性分析发现,D-IBS大鼠中IL-1β、IL-6、TNF-α的含量与p38 MAPK的表达呈正相关性,且以模型Ⅱ、Ⅲ组尤为显著(P<0.05),从一定程度上说明这些免疫指标异常与p38 MAPK通路有关,这将对于探索D-IBS发生的作用机制具有一定的意义。然由于实验条件所限,本研究仅选择了免疫组化测定结肠组织中p38 MAPK的蛋白阳性表达,未能结合real-time PCR和Westem blot方法对p38 MAPK的基因和蛋白作进一步细致评估,这是本研究的局限之处,p38 MAPK从哪一个上游靶点,促进IL-1β、IL-6和TNF-α的释放都尚待进一步研究探索。
