硼替佐米联合自体造血干细胞移植治疗多发性骨髓瘤临床疗效及预后因素分析
2019-12-30许晓东曹俊杰裴仁治
许晓东 曹俊杰 裴仁治


[摘要] 目的 探討硼替佐米联合自体造血干细胞移植(autologous hematopoietic stem cell transplantation,auto-HSCT)治疗多发性骨髓瘤(multiple myeloma,MM)临床疗效及预后影响因素。 方法 自2011年1月~2018年2月,我院对53例MM患者行硼替佐米为基础诱导化疗,应用大剂量马法兰(MEL200)±硼替佐米(BOR)方案预处理,随访分析移植后反应率及长期生存情况,并对预后相关因素进行分析。 结果 诱导治疗后18例(34.0%)患者达到完全缓解(complete remission,CR)(预处理方案:均为MEL200方案),35例(66.0%)患者未达CR(预处理方案:MEL 200方案17例,MEL200+BOR方案18例)。对诱导治疗后未达CR患者,移植后MEL200+BOR组CR率高于MEL200组(55.6% vs 17.6%,P<0.05)。单因素分析显示,移植前获得CR、mSMART分期高危、初诊时ECOG评分≥2分为影响患者无进展生存期(progression free survival,PFS)的因素。移植前获得CR、mSMART分期高危、初诊时β2微球蛋白≥3.5 mg/L、初诊时体重指数(Body Mass Index,BMI)<20 kg/m2为影响患者总生存期(overall survival,OS)的因素。多因素分析显示,移植前获得CR为影响患者PFS的独立预测因素,mSMART高危、移植前未获得CR为影响患者OS的独立预测因素。 结论 硼替佐米联合自体造血干细胞移植治疗MM的疗效良好,预处理方案中加入硼替佐米可进一步提高CR率,移植前的状态、初诊时ECOG评分、初诊时β2微球蛋白浓度、mSMART分期与移植患者的预后密切相关。
[关键词] 多发性骨髓瘤;硼替佐米;造血干细胞移植;预后因素
[中图分类号] R733.3 [文献标识码] A [文章编号] 1673-9701(2019)30-0014-05
Clinical efficacy and prognostic factors of bortezomib combined with autologous hematopoietic stem cell transplantation in the treatment of multiple myeloma
XU Xiaodong1 CAO Junjie2 PEI Renzhi1, 2 LU Ying2
1.Ningbo University Medical College, Ningbo 315000, China; 2.Yinzhou People's Hospital Affiliated to Medical College of Ningbo University, Ningbo 315000, China
[Abstract] Objective To investigate the clinical efficacy and prognostic factors of multiple myeloma(MM) in the treatment of multiple myeloma(MM) with bortezomib combined with autologous hematopoietic stem cell transplantation(auto-HSCT). Methods 53 patients with MM underwent bortezomib-based induction chemotherapy from January 2011 to February 2018, and given pretreatment with high-dose melphalan(MEL200)±bortezomib(BOR) protocol. Response rate and long-term survival were followed up and analyzed. And the prognostic factors were analyzed. Results 18 patients(34.0%) achieved complete remission(complete remission, CR) after induction therapy(pretreatment protocol: all were MEL200 regimen), and 35 patients(66.0%) did not reach CR(pretreatment protocol: 17 cases of MEL200 regimen, 18 cases of MEL200+BOR program). For patients who did not reach CR after induction therapy, the CR rate in the MEL200+BOR group after transplantation was higher than that in the MEL200 group(55.6% vs 17.6%, P<0.05). Univariate analysis showed that gaining CR before transplantation and high risk of mSMART staging was high before transplantation, and the ECOG score ≥2 at the time of initial diagnosis were factors affecting progression free survival(PFS). The CR before transplantation and high risk of mSMART staging, β2 microglobulin ≥3.5 mg/L at the time of initial diagnosis, and BMI(Body Mass Index) <20 kg/m2 at the time of initial diagnosis were factors affecting the overall survival(OS). Multivariate analysis showed that CR before transplantation was an independent predictor of PFS in patients, and high risk of mSMART, and no CR before transplantation were independent predictors of OS. Conclusion Bortezomib combined with autologous hematopoietic stem cell transplantation is effective in the treatment of MM. The addition of bortezomib in the pretreatment regimen can further increase the CR rate. The pre-transplant status, the ECOG score at the initial diagnosis, the β2 microglobulin concentration at the initial diagnosis, and the mSMART staging are closely related with the prognosis of transplant patients.
[Key words] Multiple myeloma; Bortezomib; Hematopoietic stem cell transplantation; Prognostic factors
多发性骨髓瘤是一种浆细胞恶性增殖性疾病,在传统化疗年代,患者中位生存时间不超过3年[1],大剂量化疗联合自体干细胞移植(auto-HSCT)治疗能改善MM患者预后,是年轻患者的一线治疗方案[2],新型药物如硼替佐米、卡非佐米、来那度胺的出现,使MM患者移植前诱导治疗、预处理方案等发生了改变。本研究回顾性分析接受auto-HSCT治疗的53例MM患者的临床资料,评价硼替佐米联合auto-HSCT治疗MM的疗效,并探讨影响MM患者预后的危险因素。
1 资料与方法
1.1 一般资料
选择2011年1月~2018年2月在我院行auto-HSCT的MM患者53例,其中男30例,女23例,中位年龄59岁(36~70岁)。所有患者均符合 2017年美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南[3]中的诊断标准,其中IgG型20例,IgA型13例,κ轻链型7例,λ轻链型13例,采用DS(Durie-Salmon)分期:Ⅱ期 5 例,Ⅲ期 48 例。采用国际分期体系(international staging system,ISS)分期:Ⅰ期14例,Ⅱ期20例,Ⅲ期19例。采用梅奥骨髓瘤分层与风险调整治疗(Mayo stratification for myeloma and risk-adapted therapy,mSMART)分期分危险度,高危组14例,中危组19例,标危组20例。含硼替佐米化疗的诱导治疗患者53例。53例患者初诊时实验室相关资料, BMI 22.6(17.0~31.1)kg/m2,血清乳酸脱氢酶(lactate dehydrogenase,LDH)158(117~304)U/L,血红蛋白(hemoglobin,Hb)98(53~145)g/L,β2微球蛋白 4.4(0.1~12.2)mg/L,血钙2.34(1.78~2.98)mmol/L,血小板(platelet,PLT)227(87~430)×109/L,血白蛋白35.1(21.0~47.1)g/L,C反应蛋白(C-reactive protein,CRP)3.09(0.53~27.3)mg/L,骨髓浆细胞数30%(12.0%~76.0%)。
1.2 治疗方案
给予含硼替佐米的方案,如PD方案(硼替佐米+地塞米松)、PAD方案(硼替佐米+阿霉素+地塞米松)、PCD方案(硼替佐米+环磷酰胺+地塞米松)等化疗方案。
移植患者采用环磷酰胺2 g/m2×2 d化疗动员外周血造血干细胞。连续采集1~3次外周血自体干细胞,获得CD34+细胞数>2×106/kg。
预处理采用大剂量马法兰(Melphalan 200,MEL 200)±硼替佐米(Bortezomib,BOR)的方案。
9例患者未接受维持治疗,44例患者接受维持治疗。其中28例接受沙利度胺维持治疗,16例接受含硼替佐米或来那度胺维持治疗。
1.3 疗效观察
移植后每3个月行骨髓穿刺、免疫球蛋白+血尿轻链、免疫固定电泳、微小残留病灶检查,经济许可患者行PET-CT检查,评估患者治疗疗效;疗效评价参照2017年NCCN制定的MM 疗效评价国际统一标准[3]。将疗效分为:完全缓解(CR)、非常好的部分缓解(very good partial response,VGPR)、部分缓解(partial response,PR)、病情稳定(stable disease,SD)、疾病进展(progressive disease,PD)。
1.4 随访
OS定义为患者确诊之日起至死亡或随访截止时间,PFS定义为诱导治疗开始时至随访截止时间或复发或进展时间;所有患者随访至2018年12月,中位随访时间为56(10~93)个月。
1.5 统计学处理
采用SPSS 17.0统计软件进行分析。计数资料以率表示,组间比较采用 Fisher确切概率法检验;生存分析比较采用Kaplan-Meierqu法,单因素生存比较采用Log-rank检验,多因素分析采用Cox回归模型,P<0.05为差异有统计学意义。
2 结果
2.1 移植治疗疗效
53例患者移植前接受4个疗程硼替佐米为基础化疗,18例(34.0%)患者达到CR,auto-HSCT后3个月复查骨髓及血液生化指标,31例(58.5%)患者达到CR(包括18例移植前为CR和13例移植前为PR的患者),另有22例(41.5%)达PR。移植后的CR率较移植前明显增高(P<0.05)。
2.2 预处理方案对移植疗效的影响
18例诱导化疗后获得CR的患者在MEL200方案预处理化疗后维持CR。35例移植前未获得CR的患者,17例患者采用MEL200方案预处理,其中3例(17.6%)患者在移植后获得CR,18例采用MEL200+BOR方案预处理方案,其中10例(55.6%)患者在移植后获得CR。对于诱导治疗后未获得CR的患者,预处理方案中加入硼替佐米可进一步明显提高CR率(P<0.05)(表1)。
2.3 移植前狀态对生存的影响
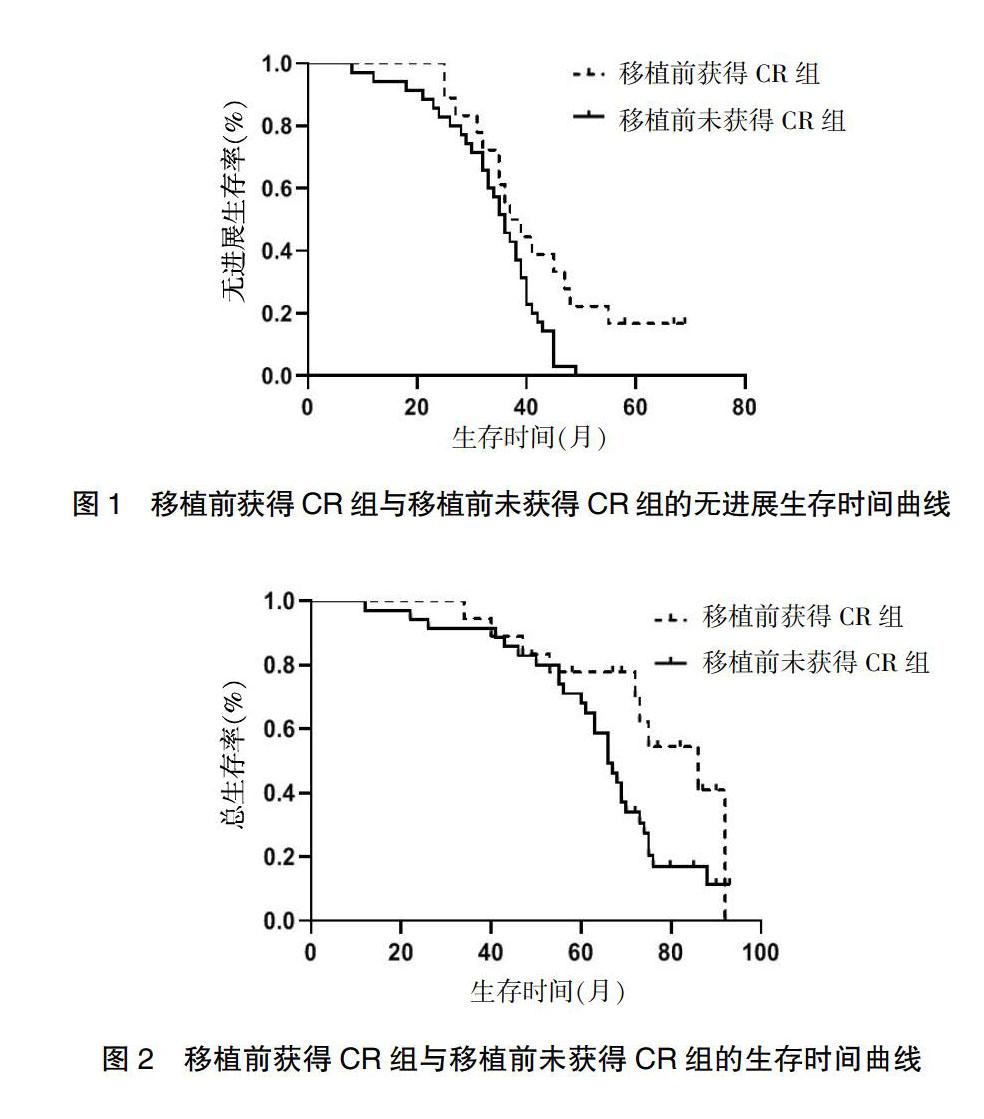
移植前18例患者获得CR,35例患者未获得CR。移植前获得CR组的平均PFS和平均OS分别为38.9个月和76.1个月。移植前未获得CR的平均PFS和平均OS分别为26.1个月和64.3个月。移植前获得CR组患者的平均PFS和平均OS均优于移植前未获得CR组(P<0.05)(图1、2)。
2.4 BMI对生存的影响
初诊时7例患者BMI<20 kg/m2、46例患者BMI≥20 kg/m2。BMI<20 kg/m2组的平均PFS和平均OS分别为24.9个月和52.3个月。BMI≥20 kg/m2组的平均PFS和平均OS分别为38.7个月和70.8个月。两组PFS时间无明显统计学差异,BMI<20 kg/m2组OS短于BMI≥20 kg/m2组(P<0.05)(图3、4)。
2.5 相关预后因素分析
对53例患者的PFS、OS相关预后因素进行单因素分析。PFS相關预后因素分析显示:①mSMART高危组患者的PFS时间缩短(P<0.05)。②移植前获得CR的患者的PFS延长(P<0.05)。③初诊时东部肿瘤协助组(eastern cooperative oncology group,ECOG)评分≥2分的患者的PFS时间缩短(P<0.05)。OS相关预后因素分析显示,①mSMART高危组患者的OS时间缩短(P<0.05)。②初诊时β2微球蛋白≥3.5 mg/L的患者OS时间缩短(P<0.05)。③移植前获得CR的患者的OS时间延长(P<0.05)。④初诊时BMI<20 kg/m2的OS时间缩短(P<0.05)。其他临床一般指标如性别、ISS分期、DS分期等与PFS及OS无相关性。对53例患者的PFS、OS相关预后因素进行多因素分析显示:移植前未获得CR为影响患者PFS的独立预测因素,mSMART高危、移植前未获得CR为影响患者OS的独立预测因素(表2、3)。
3 讨论
MM被认为是一种难以治愈的血液系统肿瘤,由于该类患者大多年龄大,在传统化疗年代,单纯化疗的缓解率低,缓解质量差,疗效并不尽人意。随着新药如硼替佐米、来那度胺、伊沙佐米[4]等应用于多发性骨髓瘤的治疗,使MM患者的病情得到了有效的控制,中位生存时间明显延长[5-6],但离长期无病生存甚至彻底治愈仍有一定距离,造血干细胞移植治疗可在化疗基础上显著提高MM患者的治疗反应率,延长其生存期,提高生活质量[7-8]。
移植前的疾病状态影响移植后的疗效,移植前获得CR的患者在PFS及OS上要优于移植前未达到CR的患者。目前研究表明,治疗的反应程度及治疗后的缓解情况与患者的生存密切相关,高质量的治疗反应可以显著延长PFS甚至OS时间[9-11]。特别是移植后获得CR的患者能够获得更长的无病生存,且被治愈的可能性很大。本研究发现移植前获得CR的患者的平均PFS及平均OS明显优于移植前未获得CR组,并且移植前获得CR为OS及PFS的独立预测因素,进一步验证了移植前缓解程度的提升能改善患者预后。
auto-HSCT治疗可在诱导化疗的基础上进一步提高CR率。隋伟薇等[12]分析144例行auto-HSCT治疗的MM患者,CR率auto-HSCT前为36%,移植后再次评估疗效CR率升高至63%,auto-HSCT治疗后CR率明显增高。本研究53例MM患者年龄较小,对化疗较为敏感,34.0%患者在auto-HSCT前就达到了CR,auto-HSCT后58.5%患者达到CR,说明auto-HSCT可在传统化疗的基础上进一步提高缓解率和缓解程度。
初诊时的BMI是一个预测MM患者预后的指标。Jung等[13]纳入193例MM患者,根据初诊时的BMI,分为BMI<20、20~24.9和≥25 kg/m2三组,三组中位生存时间分别为25.5、56.8、76.8个月(P=0.001),并且BMI<20 kg/m2组体能状况更差、血红蛋白水平更低,更易合并肾功能衰竭。本研究发现初诊时BMI<20 kg/m2的患者PFS及OS明显短于BMI≥20 kg/m2的患者,这些患者体能状态差,对化疗耐受性差,白蛋白水平低下,更易感染,导致患者生存时间下降,本研究中BMI<20 kg/m2的患者有相当一部分存在p53基因缺失等遗传学高危因素,这也是导致这部分患者OS缩短的原因。预处理方案的选择与治疗效果密切相关。目前MEL200方案是应用最广的 MM 患者 auto-HSCT的预处理方案[14]。随着新药硼替佐米[15]、卡非佐米[16]等在临床的广泛应用,经典的MEL200方案也开始被改良。在众多新的预处理方案中研究较多的是大剂量马法兰联合硼替佐米。Palma 等[17]纳入48例患者,患者预先接受3个疗程VTD(硼替佐米+沙利度胺+地塞米松)方案诱导治疗,其中28例患者接受MEL 200+BOR预处理化疗,20例患者接受大剂量马法兰(MEL200)预处理化疗。结果自体造血干细胞移植后,联合组及MEL200组的CR率分别为56%及17%(P=0.0075),MEL200+BOR 组患者耐受性良好,神经病变发生率无增加。硼替佐米加马法兰的预处理方案可进一步提高auto-HSCT的疗效。本研究发现对于诱导化疗后未获得CR的患者,预处理方案中加入硼替佐米能进一步提高这一部分患者的CR率,进一步证实了硼替佐米应用于MM患者自体干细胞移植的预处理是可行且有效的,值得临床应用。关于影响自体移植预后的因素,Nemec等[18]对纳入自体干细胞移植的MM患者运用多因素分析,结果显示复杂核型、t(4;14)和高β2微球蛋白是影响移植治疗MM后的不良预后因素;Mayo诊所提出的MM危险分层(mSMART分期)[19]提出高危患者包括17p缺失、t(14;20)、t(14;16)和基因表达谱(gene-expression profiling,GEP)确定的高危基因。Shah等[20]荟萃分析了数个Ⅳ期临床试验进一步证实了t(14;16)、t(14;20)、17p缺失是多发性骨髓瘤预后的独立危险因素,本研究发现,mSMART分期高危患者OS、PFS均缩短,并且是影响OS的独立预测因素。本研究发现移植前获得CR、mSMART分期高危、初诊时ECOG评分≥2分为影响患者的PFS的因素。移植前获得CR、mSMART分期高危、初诊时β2微球蛋白≥3.5 mg/L、初诊时BMI<20 kg/m2为影响患者OS的因素。按DS、ISS分期分层的PFS、OS无明显统计学意义,ISS、DS分期对预后无显著相关性,这在一定程度上验证了mSMART分期对预后分层的意义优于DS分期和ISS分期,并且适用于中国人群。因此,对于初诊MM患者,完善骨髓荧光原位杂交(fluorescence in situ hybridization,FISH)和染色体分型等遗传学检查是十分必要的。
结合我院单中心、小样本结果,在新药时代,auto-HSCT的一线治疗地位不可动摇,是治疗MM安全有效的方法,移植能提高患者的CR率,移植前获得CR的患者预后更佳,含有硼替佐米的预处理方案能进一步提高患者的CR率。mSMART分期在预后分层及治疗指导中的意义上优于 DS 分期及 ISS分期, 值得在临床上进一步推广应用。BMI对MM患者的预后也有一定的指导意义。关于其他影响多发性骨髓瘤的预后因素仍需进一步研究。
[参考文献]
[1] 马李洁,李莉娟,张连生. 多发性骨髓瘤治疗现状及前景[J]. 临床荟萃,2015,(4):476-480.
[2] Rajkumar,Vincent S. Multiple myeloma:2016 update on diagnosis, risk-stratification, and management[J]. American Journal of Hematology,2016,91(7):719-734.
[3] Kumar SK,Callander NS,Alsina M,et al. Multiple myeloma,version 3.2017,NCCN clinical practice guidelines in oncology[J]. Journal of the National Comprehensive Cancer Network,2017,15(2):230-269.
[4] Avet-Loiseau H,Bahlis N,Chng W,et al. Ixazomib significantly prolongs progression-free survival in high-risk relapsed/refractory myeloma patients[J]. Blood,2017,130(24):260-261.
[5] Moreau P. How I treat:New agents in myeloma[J]. Blood,2017,130(13):1507-1513.
[6] Kumar SK,Dispenzieri A,Lacy MQ,et al. Continued improvement in survival in multiple myeloma:Changes in early mortality and outcomes in older patients[J]. Leukemia,2014,28(5):1122-1128.
[7] Gay F,Oliva S,Petrucci M,et al. Chemotherapy plus lenalidomide versus autologous transplantation,followed by lenalidomide plus prednisone versus lenalidomide maintenance,in patients with multiple myeloma:A randomised,multicentre,phase 3 trial[J]. The Lancet Oncology,2015,16(16):1617-1629.
[8] Palumbo A,Cavallo F,Gay F,et al. Autologous transplantation and maintenance therapy in multiple myeloma[J].New England Journal of Medicine,2014,371(10):895-905.
[9] Martinezlopez J,Blade J,Mateos MV,et al. Long-term prognostic significance of response in multiple myeloma after stem cell transplantation[J]. Blood,2011,118(3):529-534.
[10] Harousseau JL,Attal M,Moreau P,et al. The prognostic impact of completeremission plus very good partial remission in a double transplantation program fornewly diagnosed multiple myeloma[J]. Blood,2006,108(5):266-273.
[11] Kyle RA,Leong T,Li S,et al. Complete response in multiple myeloma:Clinical trial E9486,an eastern cooperative oncology group study not involving stem celltransplantation[J].Cancer, 2006,106(9):1958-1966.
[12] 隋偉薇,德慧,邱录贵,等. 多发性骨髓瘤患者自体造血干细胞移植后长期随访的单中心结果[J]. 中华血液学杂志,2017,38(6):499-504.
[13] Jung SH,Yang DH,Ahn JS,et al. Decreased body mass index is associated with poor prognosis in patients with multiple myeloma[J]. Annals of Hematology,2014,93(5):835-840.
