多发性骨髓瘤伴椎管浸润2例
2015-09-11宋敏王建宁孟庆齐等
宋敏 王建宁 孟庆齐等

[摘要] 多发性骨髓瘤(MM)伴椎管浸润临床罕见,治疗困难,目前国内外尚无推荐的标准治疗方案,仅见个案报道,预后差。化疗、手术、放疗为基本的治疗手段。本文总结分析2例MM伴椎管浸润病例的临床诊疗过程、疗效及病程的进展情况,并复习相关文献,进一步加深对MM伴椎管浸润的诊疗认识。及早发现、诊断和个体化治疗是改善预后的关键,患者一旦出现截瘫,治疗效果差,进展迅速,预后极差。
[关键词] 多发性骨髓瘤;椎管浸润;化疗;手术;放疗
[中图分类号] R733.3 [文献标识码] A [文章编号] 1673-7210(2015)08(c)-0153-05
[Abstract] Multiple myeloma (MM) with intraspinal invasion is very rare in clinic, which is difficult to treat. No standard treatments are recommended at home and abroad, and only case report can be found, which is poor prognostic. Chemotherapy, operation and radiotherapy are the basic treatments. To further deepen the understanding of the diagnosis and treatment of MM complicated by spinal infiltration, clinical practice, curative effect and course of disease progression of two cases of MM complicated with spinal infiltration are summarized and analyzed, and pertinent literature is reviewed. Early detection, diagnosis and individualized treatment are thought to be critical in improving prognosis. Once paraplegia happened in patients, the therapeutic efficacy and prognosis would be very poor, and the disease progression would be rapid.
[Key words] Multiple myeloma; Spinal infiltration; Chemotherapy; Operation; Radiotherapy
多发性骨髓瘤(multiple myeloma,MM)是一种浆细胞的恶性克隆性增殖性疾病,约占血液系统恶性肿瘤的10%。随着社会老年化进程,其发病率逐渐上升。绝大多数MM患者骨髓瘤细胞局限于骨髓和骨,临床上常表现为广泛的溶骨性病变或骨质疏松、高钙血症、肾功能损害和贫血等,但临床上可见疾病初发或疾病过程中时有髓外浸润的表现[1-2],是MM预后不良的独立预后因素[3]。MM伴椎管浸润的病例非常罕见[4],预后极差。及早发现、诊断和个体化治疗是改善预后的关键,患者一旦出现截瘫,治疗效果差,进展迅速,预后差。本文报道2例MM伴椎管浸润病例的临床表现、相关治疗过程及疾病的进展情况,希望能为临床工作者的诊治带来一定的启发。
1 临床资料
病例1:患者,女性,62岁,主因“乏力、骨痛3年,双下肢瘫5个月,上腹痛3个月”于2013年11月1日入院。患者入院3年前无明显诱因出现乏力、胸壁骨痛渐加重,2011年3月28日入南京医科大学第二附属医院(以下简称“我院”)消化科查胸部CT+上腹部CT示:两侧多发肋骨破坏、骨折,胸骨及胸椎、肩胛骨骨质破坏改变,转入我院血液科(以下简称“我科”)。血常规示:白细胞计数(WBC)4.1×109/L,血红蛋白(HB)71.0 g/L,血小板计数(PLT)181×109/L。球蛋白:29.2 g/L,乳酸脱氢酶(LDH):245 U/L,肾功能正常。IgA:0.26 g/L,IgG:9.47 g/L,IgM:0.24 g/L。血清轻链κ:2.51 g/L,血清轻链λ:1.15 g/L。尿轻链κ:7.76 mg/L,尿轻链λ < 3.66 mg/L。免疫固定电泳提示KAP链阳性。骨髓细胞学示:粒系、红系、巨核系三系增生骨髓象,浆细胞占1.2%,异形性明显,可见三核浆细胞,网状细胞易见,成熟红细胞轻度缗钱状。骨髓活检:骨髓增生活跃,网染轻度纤维组织增生,局灶浆细胞聚集。左侧第10肋骨病灶活检病理免疫组化:CD38+,CD138+,LCA+,CD3-,CD20-,CD45RO灶性+,CD79α-,PAX5-,MPO-,TDT-,CD99-,CKpan-,EMA-,S-100-,DES-,VIM+-,MyoD1-,间皮细胞-,Syn-,CgA-。PET-CT提示多发性骨破坏。诊断:多发性骨髓瘤κ轻链型Ⅲ期A组,于2011年4月22日、5月13日、6月7日、7月6日应用硼替佐米+地塞米松(PD)方案化疗4个疗程,具体:地塞米松20 mg,第1~4、8~11天;硼替佐米2 mg,第1、4、8、11天。然后检查免疫固定、血清蛋白电泳、PET-CT等达CR,因经济原因未再予以硼替佐米治疗,予干扰素维持治疗。2013年2月出现左下肢疼痛麻木渐加重,住院查尿轻链κ 8.74 mg/L,尿轻链λ < 3.66 mg/L。IgA 1.53 g/L,IgG 11.70 g/L,IgM 0.61g/L。血轻链κ 3.17g/L,轻链λ 1.21 g/L。免疫固定电泳:IgG阴性、IgA阴性、IgM阴性、κ阴性、λ阴性。但CT提示骨质密度异常,左侧腹膜后及盆腔内占位,浆细胞瘤?考虑MM髓外复发,2013年3月11日开始局部放疗,总照射剂量为45 Gy,放疗结束后予以复查PET-CT:局部肿块消退,腹腔脏器见多发高代谢影。2013年4月24日、5月14日再次应用PD方案化疗。2013年5月23日突发双下肢瘫痪,大小便不能控制,复查椎体磁共振示胸9~腰4肿块,压迫脊髓,考虑骨髓瘤椎管内浸润,暂停化疗,放疗科会诊后行局部放疗:胸9~腰4髓内病灶区域,总剂量:36 Gy。2013年6月15日(图1)复查磁共振提示:椎管内肿块范围较前2013年5月24日范围略有缩小。放疗期间出现上腹痛渐加重及上消化道出血,CT示:胃壁弥漫性、均匀性增厚。2013年7月2日予以胃镜检查示:胃底黏膜僵硬,可见黏膜溃烂,胃体大弯侧黏膜僵硬伴溃烂,质脆易出血,胃窦黏膜充血水肿,黏膜面稍粗,欠平整。免疫组化:Ki-67 90%+,CD38+,CD138+,LCA-,CD3-,CD5-,CD20-,CD45RO-,CD79α-,PAX5-,BCL-2+,BCL-6-,Mum-1+,Syn-,CgA-,CD30-,CD10-,CynlinD-(胃体黏膜)结合免疫组化,示浆细胞肿瘤。与家属沟通,因患者一般情况欠佳,截瘫,长期卧床,家属拒绝手术治疗,自2013年7月9日开始应用2个疗程硼替佐米+地塞米松+吡柔比星(TPD)方案化疗,骨髓抑制明显,患者化疗开始后曾有下肢、臀部浅表感觉(疼痛、麻木感)出现,然后再次消退。但两次复查CT示胃壁弥漫性、均匀性增厚未见明显好转,效果欠佳,2013年9月予以胃区局部放疗,总剂量为36 Gy。2013年10月6日,患者渐出现臀部,继背、胸部等全身多发无痛性皮下结节并进行性增大,病理仍为骨髓瘤浸润。2013年10月12日行雷那度胺+地塞米松(RD)方案化疗,效果欠佳。继予以小肠内插管肠内营养,长期导尿。病程中反复肺部感染、尿路感染,抗感染治疗好转并止痛对症处理。患者最后一次于2013年11月1日入院时体格检查:神清,精神萎,贫血貌,全身皮肤黏膜未见明显黄染及出血点,臀部可见两处皮下结节。巩膜无黄染,胸廓无畸形,两侧肋骨有压痛,左侧为著,腹膨隆,剑突下压痛+,肝脾肋下未及,两下肢Ⅱ度可凹性水肿。双下肢瘫痪,肌力0级。入院诊断:MM;椎管内、腹腔内、胃、皮下浸润;截瘫,低蛋白血症。患者入院后继续对症支持治疗,2013年11月2日起出现持续发热,予以抗感染、抗真菌、止痛、补液等对症处理效果欠佳,于2013年11月13日终因循环呼吸衰竭死亡。
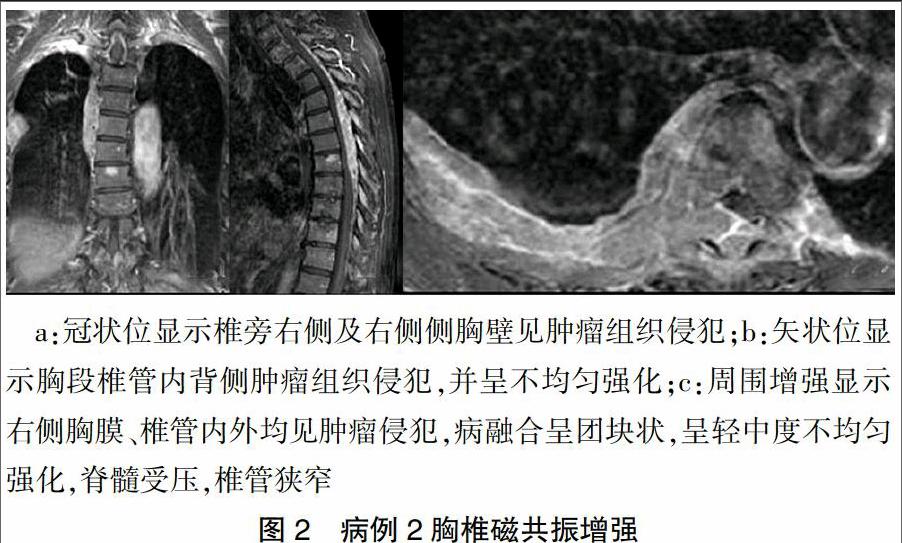
病例2:患者,男性,77岁,主因“反复双下肢乏力1年余,双下肢瘫5个月”于2010年3月22日入院。患者2009年2月因外伤出现背部疼痛,双下肢乏力、麻木,后症状逐步加重。2009年4月来我院行胸椎磁共振平扫:胸2~7椎体水平椎管内硬膜外、右侧椎旁、胸腔肿块。胸3~10、12椎异常信号。腰椎平扫:①腰椎退行改变,②腰4~5椎间盘突出,③腰3~4、腰5、骶1椎间盘膨隆,④腰4椎体滑脱。胸椎磁共振增强(图2):胸2~7椎体水平椎管内硬膜外,胸2~4椎体水平胸腔后壁、胸5~11椎体,部分胸椎、肋骨异常信号,考虑转移瘤可能,建议穿刺活检。于2009年5月14日在全身麻醉下行椎管减压和占位切除术。术中见肿块呈长条形约1.5 cm×10 cm,暗褐色,血供丰富,边界清,包膜尚完整,位于硬膜外,压迫胸3~7节段脊髓,使之变扁。手术完整摘除肿块,见受压脊髓隆起。术后病理示:浆细胞骨髓瘤,免疫组化CD38+、CD138+,ECT示多处骨破坏。骨髓浆细胞10.8%,幼稚浆细胞易见。血常规:WBC 3.9×109/L、HB 119.0 g/L、PLT 187×109/L。β-MG:4.46 mg/L,尿轻链正常。IgA:11.6 g/L,IgG:3.55 g/L,IgM:0.28 g/L。轻链κ增高为主,免疫固定电泳示IgA、κ阳性,诊断“多发性骨髓瘤IgA、κ型Ⅲ期A组,伴胸椎椎管内、胸腔后壁、右侧胸壁浸润”。因经济原因未能使用硼替佐米及其他强烈的静脉用药全身化疗,分别于6、7月予以TMD方案化疗,具体为:沙利度胺200 mg,1次/d,马法兰10 mg/d,第1~4天,地塞米松20 mg,第1~4天。患者双下肢乏力好转,后患者家属未同意继续联合化疗。2009年10月患者再次出现双下肢乏力,椎体磁共振胸椎平扫:第6、8、9、10胸椎椎体内见多发小圆形异常信号,胸8~10椎水平椎管内脊髓后方见条形等T1等T2信号,相应水平胸髓受压;诸椎间盘未见膨隆或突出;椎间隙不窄;骨性椎管无狭窄。印象:胸椎多发异常信号伴椎管内占位,符合MM表现。2009年10月19日在全身麻醉下行胸椎管内骨髓瘤摘除术,术中见胸8~10椎椎板多发性“鱼肉样”病灶,该节段椎管内见5 cm ×2.5 cm ×2 cm大小、不规则肿块,位于硬膜背侧,呈暗红色,未见明显包膜,边界尚清楚,与硬膜轻度粘连,压迫胸段脊髓。手术沿肿块分离粘连,完整摘除肿块。见脊髓减压充分。手术顺利,但术后出现下肢瘫痪,予以抗感染、补液、消肿、营养神经及高压氧等对症处理,并于2009年11月24日~12月21日予胸1~12椎放疗,40.5 Gy(20次)。双下肢肌力1~2级,足趾活动可,出院。术后病理仍示浆细胞骨髓瘤。后未继续治疗在家。2010年3月22日入院时一般情况差,进食少,消瘦明显。大小便失禁。查体:神清,恶液质,臀部压疮,双下肢肌力0级。血常规:WBC 5.3×109/L,HB 64.0 g/L,PLT 80×109/L。球蛋白> 60 g/L,IgA 28 g/L,诊断:MM,截瘫,2型糖尿病,恶病质,压疮。一般情况差,不能耐受化疗,家属放弃积极治疗,于2010年4月4日终因循环呼吸衰竭死亡。
2 讨论
MM是浆细胞在骨髓中呈恶性克隆增生的疾病,合并有髓外浸润的MM患者治疗困难,预后差,尤其在使用造血干细胞移植、沙利度胺治疗后[5-7]。合并有椎管浸润的患者,非常罕见,常见于伴其他部位髓外浸润者,治疗更棘手,预后更差,对这类患者目前国内外尚无标准的治疗方案[8-10]。
钟玉萍等[11]分析2007~2009年北京朝阳医院10例MM伴椎管浸润住院患者中有8例患者在诊断MM时就是以髓外浆细胞瘤为主要表现,主要采取的方法为手术及化疗。2例患者行手术治疗后再进行化疗(1例硼替佐米+VAD方案,1例MP+雷利度胺),8例患者单纯接受化疗(DECP方案),他们认为尽早手术对患者的神经功能恢复有一定的帮助,但一旦出现脊髓压迫截瘫,即使手术取出肿物,完全恢复的可能性也很小。主要治疗以全身化疗为主。对于疾病进展后出现髓外浸润的患者,传统化疗方案往往难以奏效,而要选择二线药物或新的药物。国外有类似报道,以PD方案治疗MM伴髓外浸润取得了较好的疗效[12]。Li等[13]研究早期诊断的重要性,治疗对传统药物疗效不佳,而对包括新药方案,如含硼替佐米的方案等有较好的反应。对有累及神经根症状的患者,建议尽可能早期实行手术切除肿块,解除脊髓受压,改善患者预后和生活质量。
复习文献,目前关于椎管减压术治疗MM合并脊髓压迫症多为个案报道,对于其预后及生活质量改善的研究分析较少且无统计数据支持[14-15]。石磊等[16]总结北京2006~2012年积水潭医院MM合并脊髓压迫症患者28例,患者均行化疗,其中以硼替佐米为主的方案联合化疗10例,阿霉素/吡喃阿霉素+长春新碱/长春地辛+地塞米松(NCP)方案化疗11例,以马法兰为主的方案联合化疗7例,其中7例在化疗后进行脊髓压迫部位的放疗。根据是否进行椎管减压术分为椎管减压术组13例、非手术组15例,随访12个月,椎管减压术组与非手术组的Frankel分级和美国东部肿瘤协作组体能状态评分标准(ECOG-PS)的生活质量明显改善率比较,差异无统计学意义。他们认为,椎管减压术虽能在术后缓解患者的脊髓压迫症状,但并不能使联合化疗的MM合并脊髓压迫症患者预后及生活质量得到进一步改善,且椎管减压术及其并发症有可能导致延误放、化疗时机,增加感染风险;以急性脊髓压迫症初诊者在未明确MM诊断前,进行以肿物切除明确病理诊断同时进行减压治疗为目的的手术,可作为确诊及缓解急性压迫的手段,可先于联合化疗进行;明确诊断MM合并脊髓压迫症的初治病例和由于MM病情进展而造成的脊髓压迫症复发患者,则应首选联合化疗作为治疗方案。本组病例2为首诊因出现早期脊髓压迫症状就诊,即发现椎管内肿块,胸外科行椎管减压和占位切除术,结合术后病理、影像学、骨髓细胞学、血清学等相关检查诊断:多发性骨髓瘤IgA、κ型,予TMD方案化疗2个疗程,效果佳,经济原因未能坚持治疗。从病程开始发现早期的脊髓压迫症状始至死亡总病程约13个月,手术联合全身化疗2个疗程,治疗效果佳,蜜月期持续达5个月,再次出现脊髓压迫症状,椎管内新病灶,手术治疗辅以局部放疗,效果差,5个月后死亡。
MM伴椎管内浸润,预后差,进展快,治疗困难,诊治过程中应密切观察、询问患者的不适症状,尤其神经系统的表现,部分患者早期或仅有腰背部不适等主述,应引起重视,早期予以影像学检查发现病灶,早期积极治疗,尽可能地提高患者的生活质量,通过积极、多方案的联合治疗,延长患者生存期。部分MM患者出现椎管内浸润的临床表现常为急性脊髓压迫症状加重的出现,迅速出现截瘫,出现肢体感觉的异常,24 h内即出现截瘫,发展非常迅速。本组病例1即为出现肢体感觉的异常迅速出现截瘫。该患者为多发性骨髓瘤轻链κ型Ⅲ期A组,行PD方案治疗达完全缓解(CP)后予干扰素维持,随访,免疫固定电泳阴性。患者PD方案治疗后1.5年始出现髓外浸润,首先发现腹腔肿块,予局部放疗后再次PD方案化疗,化疗过程中出现突发截瘫,大小便失禁,磁共振提示胸椎和腰椎椎管内浸润,压迫脊髓,家属放弃手术治疗,予放疗效果欠佳,放疗中、后相继出现胃部及皮下骨髓瘤浸润,予TPD、RD等方案化疗效果欠佳。患者总体病程近3年,出现截瘫至死亡时间恰为5个月。
此外,笔者还收治1例67岁男性患者,为轻链型复发患者,M2方案治疗达CR,随诊半年后复发,复发后治疗过程中,一出现下肢麻木立即出现双下肢截瘫,因该患者曾行心脏支架术(Firebird2),该支架类型不能行磁共振检查,仅予以CT检查,因CT对椎管内浸润影像学诊断的敏感性较差,未能发现有椎管内的占位表现,但该患者疾病进展迅速,数天内即因心力衰竭死亡。尽管没有影像学的诊断依据,结合病史及临床,仍应考虑患者椎管内占位引起的截瘫可能。亦符合MM伴椎管内浸润一旦出现截瘫预后极差,治疗效果差。同时提示考虑椎管内占位检查应以磁共振为主,CT可能不能完全反映椎管内占位的情况。
总之,对MM患者应密切观察病情变化,如早期的神经系统症状等,及早发现MM髓外浸润的可能,并及早发现椎管内浸润的可能性,早期根据患者的具体情况,制订相应的治疗方案,以改善患者预后[17]。MM髓外复发治疗仍无标准方案,有报道,含来那度胺、硼替佐米等多药联合方案可能对髓外复发的MM患者治疗有效[3,18-19],但都基于个案报道。早期使用含硼替佐米的治疗方案并不能降低髓外复发率[20-22],本组病例结果与之符合。MM伴椎管内浸润目前的研究都基于个案报道和回顾性分析,因此更多的前瞻性临床研究将有助于探索最合适的治疗方案。
[参考文献]
[1] Varettoni M,Corso A,Pica G,et al. Incidence,presenting features and outcome of extramedullary disease in multiple myeloma:a longitudinal study on 1003 consecutive patients [J]. Ann Oncol,2010,21(2):325-330.
[2] Katodritou E,Terpos E,Symeonidis AS,et al. Clinical features,outcome,and prognostic factors for survival and evolution to multiple myeloma of solitary plasmacytomas:a report of the Greek myeloma study group in 97 patients [J]. Am J Hematol,2014,89(8):803-808.
[3] Bladé J,de Larrea CF,Rosinol L. Extramedullary involvement in multiple myeloma [J]. Haematologica,2012,97(11):1618-1619.
[4] Repko M,Chaloupka R,Grosman R,et al. Surgical options in the treatment of myeloma of the spine [J]. Vnitr Lek,2006, 52(12):32-40.
[5] Katodritou E,Gastari V,Verrou E,et al. Extramedullary(EMP)relapse in unusual locations in multiple myeloma:is there an association with precedent thalidomide administration and a correlation of special biological features with treatment and outcome?[J]. Leuk Res,2009,33(8):1137-1140.
[6] Lee SE,Kim JH,Jeon YW,et al. Impact of extramedullary plasmacytomas on outcomes according to treatment approach in newly diagnosed symptomatic multiple myeloma [J]. Ann Hematol,2015,94(3):445-452.
[7] Billecke L,Murga Penas EM,May AM,et al. Cytogenetics of extramedullary manifestations in multiple myeloma [J]. Br J Haematol,2013,161(1):87-94.
[8] Shin HJ,Kim K,Lee JW,et al. Comparison of outcomes after autologous stem cell transplantation between myeloma patients with skeletal and soft tissue plasmacytoma [J]. Eur J Haematol,2014,93(5):414-421.
[9] Kumar AK,Dakhil C,Teeka Satyan M,et al. Extramedullary progression of multiple myeloma despite concomitant medullary response to multiple combination therapies and autologous transplant:a case report [J]. J Med Case Rep,2014,8(8):299.
[10] Pour L,Sevcikova S,Greslikova H,et al. Soft-tissue extramedullary multiple myeloma prognosis is significantly worse in comparison to bone-related extramedullary relapse [J]. Haematologica,2014,99(2):360-364.
[11] 钟玉萍,陈世伦,李新,等.多发性骨髓瘤伴椎管浸润10例临床分析[J].中国实验血液学杂志,2010,18(2):466-468.
[12] Dytfeld D,Matuszak M,Lewandowski K,et al. Bortezomib in combination with thalidomide and dexamethasone—a successful treatment regimen in refractory extram edullary multiple myeloma [J]. Ann Hematol,2008,87(3):253-254.
[13] Li X,Sun WJ,Chen SL,et al. Clinical analysis of multiple myeloma with extramedullary plasmacytomas [J]. Zhonghua Yi Xue Za Zhi,2012,27,92(12):838-841.
[14] Pan J,Qian ZL,Sun ZY,et al. Open kyphoplasty in the treatment of a painful vertebral lytic lesion with spinal cord compression caused by multiple myeloma:a case report [J]. Oncol Lett,2013,5(5):1621-1624.
[15] Papanastassiou ID,Eleraky M,Murtagh R,et al. Comparison of unilateral versus bilateral kyphoplasty in multiple myeloma patients and the importance of preoperative planning [J]. Asian Spine,2014,8(3):244-252.
[16] 石磊,肖斌,左杏果,等.椎管减压术对多发性骨髓瘤合并脊髓压迫症患者生活质量的影响[J].山东医药,2013,53(48):43-44.
[17] Mont′ Alveme F,Vallée JN,Guillevin R,et al. Percutaneous vertebroplasty for multiple myeloma of the cervical spine [J]. Neuroradiology,2009,51(4):237-242.
[18] Kumar SK,Flinn I,Noga SJ,et al. Bortezomib,dexamethasone,cyclophosphamide and lenalidomide combination for newly diagnosed muhiple myeloma:phase 1 results from the multicenter evolution study [J]. Leukemia,2010,24(7):1350-1356.
[19] Ito C,Aisa Y,Mihara A,et al. Lenalidomide is effective for the treatment of bortezomib-resistant extramedullary disease in patients with multiple myeloma:report of 2 cases [J]. Clin Lymphoma Myeloma Leuk,2013,13(1):83-85.
[20] Calvo-Villas JM,Alegre A,Calle C,et al. Lenalidomide is effective for extramedullary disease in relapsed or refractory multiple myeloma [J]. Eur J Haematol,2011,87(3):281-284.
[21] Weinstock M,Ghobrial IM. Extramedullary multiple myeloma [J]. Leuk Lymphoma,2013,54(6):1135-1141.
[22] Papanikolaou X,Repousis P,Tzenou T,et al. Incidence,clinical features,laboratory findings and outcome of patients with multiple myeloma presenting with extramedullary relapse [J]. Leuk Lymphoma,2013,54(7):1459-1464.
(收稿日期:2015-04-14 本文编辑:李亚聪)
