腹腔镜下治疗脾动脉瘤4例疗效分析*
2019-12-26冯善龙刘振忠
冯善龙 杨 阳 刘振忠
山东第一医科大学第二附属医院,山东 泰安 271000
脾动脉瘤是最常见的内脏动脉瘤,其发病率约占内脏动脉瘤的60%[1]。脾动脉瘤多无典型症状,患者多是在行上腹部影像学检查时偶然发现[2]。脾动脉瘤的治疗包括开放手术,脾动脉瘤腔内治疗和腹腔镜微创治疗。自2016年1月至2019年1月,山东省泰山医学院附属医院采用腹腔镜的办法成功治疗脾动脉瘤4例。现总结如下。
1 临床资料
1.1一般资料 本组病人男1例,女3例,年龄38~65岁,平均(54.0±6.7)岁。主要临床症状:伴有腹部不适、腹胀者3例,有上消化道出血病史1例,无症状意外发现者1例。4例病人均为单枚脾动脉瘤,动脉瘤位于脾动脉中段2例,脾门附近2例。2例合并肝硬化并脾功能亢进,1例合并胰腺囊性肿瘤。
1.2检查方法 所有病人均于术前行超声、增强CT或磁共振明确诊断,明确脾动脉瘤的数量、大小、位置、形状及脾动脉直径。所有病人术前行血常规、血淀粉酶、凝血分析、肝功、肾功、心肺功能等常规检查。
1.3手术方法 4例病人均为择期手术,采用腹腔镜下手术治疗。术前常规准备,患者全麻,取平卧位,采用5孔法,戳卡布局类似腹腔镜胰腺手术,右侧腹直肌外缘脐水平线以上约1~2 cm放置12 mm Trocar作为主操作孔,左侧对应位置同样放置12 mm Trocar作为辅助孔。其优势在于两侧均可使用10 mm器械。腹腔镜下完成手术操作。行腹腔镜下动脉瘤体近远端动脉结扎术1例,动脉瘤联合胰体尾部切除1例,脾动脉瘤联合脾脏切除2例。
2 结 果
所有患者均顺利完成手术,无中转开腹病例。手术平均时间为(2.5±1.2)h,术中平均出血量(80±15.5)ml,术后均在左上腹部放置腹腔引流管一根,术后第二天进流质饮食。1例门静脉高压患者术后出现腹水,给予纠正低蛋白血症及利尿治疗,合并胰体尾切除患者术后给予奥曲肽药物抑制胰酶分泌,1例联合脾脏切除患者术后出现血小板升高,达640×109/L,给予祛聚,抗血小板治疗。所有患者无重大并发症发生,无围术期死亡,出院平均天数为7 d,最长的14 d,最早6 d出院。本组4例病人均获得随访,时间为6个月至2年,随诊时复查上腹部强化CT、血常规及腹部彩超。1例脾切除患者口服阿司匹林后血小板恢复正常。随访期间内未发现脾动脉复发者。

图1 脾动脉瘤合并脾肿大的CT影像
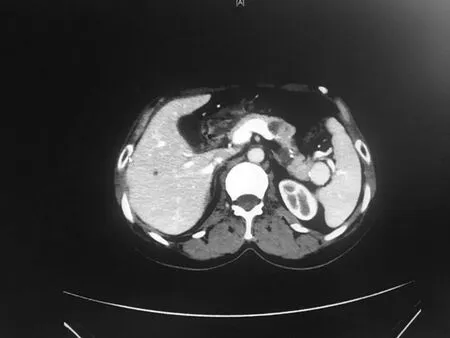
图2 脾动脉瘤合并胰腺体尾肿瘤的CT影像
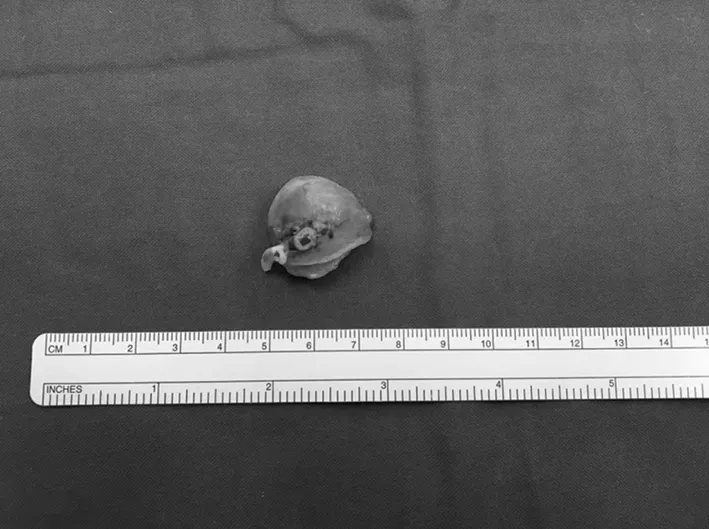
图3 切除后的脾动脉瘤标本
3 讨 论
脾动脉瘤的发病原因尚不十分明确,可能与门静脉高压、外伤、脾动脉周围炎症、多次妊娠、动脉粥样硬化、高血压等有关[3]。女性更易罹患,男女比例为1∶4。随着人们查体的普及及影像学技术的进步,临床上无症状性脾动脉瘤的发现也越来越多。对于治疗脾动脉瘤的干预指征,现在仍未有统一定论[4]。脾动脉瘤一旦发生破裂,可导致腹腔内大出血而危及生命,需急症处理。笔者认为,对于直径大于2 cm的脾动脉瘤患者,如病人一般情况允许,均应考虑手术治疗。进行何种治疗依据病人的一般情况、是否合并疾病、脾血管瘤的位置、与周围脏器的关系等因素综合决定[5]。手术的方式可以选择介入手术、开腹手术,及腹腔镜微创手术治疗。
近年来,随着微血管技术的不断发展,已经将内脏动脉瘤的治疗模式从传统的外科手术转变为用线圈或覆盖支架进行的微创血管内治疗[6]。但外科手术仍具有自身的优势,如可以彻底切除肿瘤,同时还可以对合并症进行处理,对于靠近脾门区或瘤体弯曲度大而无法行介入治疗的病人仍需选择外科手术[7]。动脉瘤的腹腔镜下手术方式取决于脾动脉瘤的部位[8],如瘤体位于脾动脉近端,可采取动脉瘤近端和远端给予Homlock夹夹闭,保留脾脏。如瘤体位于脾动脉远端,与胰腺尾部有粘连时,可以同时性胰体尾切除,这类患者往往也可以保留脾脏。对于门静脉高压症合并脾动脉动脉瘤时,动脉瘤往往位于脾门处,可能是高血流动力学导致的结果,这类病人还伴有脾动脉迂曲,脾脏增大,脾脏周围血管曲张增粗,脾功能亢进等,切除动脉瘤的同时应处理门静脉高压症的并发症,如腹腔镜下同时切除脾脏,必要时需要行贲门周围血管离断术或分流手术等。腹腔镜下手术较开腹手术有创伤小、恢复快等优点,可以探查整个腹腔内情况,可以观察到动脉瘤的大小,形态,与脾脏及周围脏器的关系。对于瘤体紧靠脾门,与脾门周围明显粘连者,须做好脾切除术准备。腹腔镜手术需要娴熟的腔镜技术及团队的配合能力,具备腹腔镜下脾切除、胰腺切除术操作能力,术中瘤体破裂大出血须及时中转开腹手术[9]。本组病人术中平均出血量100 ml左右,术后病人能早期下床活动,住院时间短。
总之,腹腔镜下行脾动脉瘤手术是安全、有效、微创的治疗手段,特别是合并有门静脉高压及胰腺体尾部病变的病人,腹腔镜手术是首选治疗方法。
