慢性胰腺炎脾门假性囊肿分类及其与SPH 关系的影像学研究
2023-12-21徐浩铜徐万宇吴毅何明静雷秀兵田伏洲
徐浩铜,徐万宇,吴毅,何明静,雷秀兵,田伏洲*
1.攀枝花学院基础医学院解剖学教研室,四川 攀枝花 617000; 2.西部战区总医院全军普外中心,成都 610083;3.陆军军医大学生物医学工程与影像医学系数字医学教研室,重庆 400038
发生于脾门的胰周积液和脾门假性囊肿是慢性胰腺炎胰尾外侧的常见并发症[1,2]。学者们认为脾门假性囊肿的形成机制一方面是胰尾假性囊肿发展至脾门区并进一步累及脾实质,另一方面是胰尾的炎性渗出物扩散入脾门区导致脾撕裂[3,4]。有些学者将这类假性囊肿命名为脾内假性囊肿[5,6]。而Mortelé 等[7]将脾门部慢性积液定义为慢性脾周积液。研究者对慢性胰腺炎脾门假性囊肿的命名及其分类尚未达成共识,对选择传统内镜引导下穿胃壁引流、超声内镜引导下引流,亦或经十二指肠大乳头行内镜逆行胰管内引流的治疗方法带来困惑[8]。继发于左侧区域性门静脉高压症(sinistral portal hypertension,SPH)的上消化道出血是源自胰腺炎的最快速致命的并发症,其死亡率可达14.5%[9]。目前鲜有脾门假性囊肿与SPH之间潜在关系的研究。本研究运用2 号中国可视人(second Chinese Visible Human,CVH2)数据库和影像学资料探究脾门假性囊肿分类,以及脾门假性囊肿与SPH 之间的潜在关系。
1 材料与方法
1.1 临床资料
本研究通过攀枝花学院伦理委员会审查(PZHU-2018-0032)。选取2019 年1 月至12 月攀枝花学院附属医院收治的291 例慢性胰腺炎患者进行研究。其中 男185 例,女106 例;年 龄21~89 岁,平 均(49.2±15.5)岁。纳入标准:根据美国胰腺协会诊断指南诊断为慢性胰腺炎者[10];具备慢性胰腺炎临床表现;具备胰腺实质或/和胰管的明确影像学改变[1];既往无腹部手术史者;无合并腹部其它疾病者;对位于脾门的囊性病灶行囊肿空肠吻合术,术中提取部分囊壁组织做病理学检查,如囊壁内衬为炎性纤维结缔组织,而非垫衬上皮细胞层[11],则被诊断为脾门部假性囊肿。
1.2 研究方法
所有患者入院及随访接受腹部CT 或MRI 扫描。将所有的CT/MRI 图像导入Amira 5.2.2 软件进行图像观察和多平面重建(multiplane reconstruction,MPR)。
1.2.1 CT 扫描 其中193 位患者入院后48 h 内接受美国通用公司Light speed 128 排螺旋CT 扫描:层厚及层间距为5.0 mm,管电压120 kVp,管电流300 mAs,重建层厚0.625 mm,层间距0.625 mm,标准重建算法。扫描范围从膈顶到肾下极下方2 cm。先行常规平扫后行CT 增强扫描(contrast enhanced CT,CECT),以高压注射器经右肘正中静脉注入碘对比剂(碘氟乙醇,浓度320 mg/kg,注射速度4.0 mL/s)。分别在注射后20~25 s、45~55 s、80 s 进行动脉期、动脉晚期和门静脉期扫描。
1.2.2 MRI 扫描 另98 位患者入院后48 h 内接受通用公司Discovery 750 3.0T MRI 扫描,扫描中采用体部射频线圈装置。首先,采集轴位梯度回波T1 加权(gradient-echo T1 weighted,GRE T1WI)脂肪抑制序列。扫描参数:TR/TE=195~200 ms/1.3~1.5 ms,层厚6.0 mm,层间距1 mm,扫描矩阵256×192,扫描视野34 cm×34 cm。其次,采集轴位和冠状位T2 加权快速恢复快速自旋回波(fast recovery fast spin-echo,FRFSE)呼吸门控成像序列。扫描参数:TR/TE=2500~3000 ms/90~110 ms,层厚6.0 mm,层间距1 mm,扫描矩阵384×384,扫描视野34 cm×34 cm。最后,采集轴位T1 加权肝三维容积超快速采集(1iver acquisition with volume acceleration-flexible,LAVAflexible)成像序列,且分别在注射前、注射后20~25 s、45~55 s、80 s 进行动脉期、动脉晚期和门静脉期扫描。扫 描 参 数:TR/TE=3.6~4.4 ms/1.7~1.9 ms,层 厚5.2 mm,层间距0,扫描矩阵224×192,扫描视野36 cm×36 cm。在MRI 动态增强时,以高压注射器经右肘正中静脉注入磁共振造影剂(钆喷酸葡胺,剂量20 mL,注射速度3.0 mL/s),随后注入20 mL 生理盐水。
1.2.3 影像观察指标 所需观察并统计的影像征象如下:胰尾假性囊肿,脾门假性囊肿,胰尾瘘,慢性胰腺炎继发的SPH。由2 名从事腹部影像学诊断工作15 年以上的医师采用双盲法评价、统计所有影像检查结果,尤其是脾门假性囊肿的分类,基于2014 年美国胰腺协会就慢性胰腺炎的诊断指南,对观察指标达成一致性评价结果[10]。
1.2.4 CVH2 虚拟显示远端假性囊肿分类 选取一位22 岁女性CVH2 数据库的上腹部数据[12]。入选数据集为从膈顶到左肾下极范围层厚170 mm 的断层解剖数据集,该数据集的薄层横断面图像的层厚及层间距均为0.5 mm,空间分辨率为3072×2048。将来自CVH2 的340 层上腹部断层图像导入Amira 5.2.2 软件,按照解剖结构的自然颜色差异对胰腺进行准确分割。分割后得到胰腺的轮廓线数据,利用Amira 的SurfaceGen 命令对胰腺进行三维重建,constrained smoothing 命令对三维重建结构进行平滑处理。此外,虚拟重建胰尾瘘、胰尾假性囊肿和脾门假性囊肿的三维模型以便后续研究。随后在Amira 软件内,经MPR 获得基于CVH2 数据库的上腹部冠状位图像。基于前述影像图像上对脾门假性囊肿分类的统计结果,采用Transform 命令将重建的胰腺三维模型与CVH2 的MPR 图像进行配准、重合,对脾门假性囊肿的分类进行三维可视化虚拟显示。
1.3 统计学分析
以SPSS25.0 软件进行统计学分析,计数资料以率%(n)表示,采用优势比(odds ratio,OR)的χ2检验分析脾门假性囊肿对SPH 的预测价值,P<0.05 为差异有统计学意义。
2 结果
2.1 基于影像学资料归纳脾门假性囊肿分类
研究结果显示24.1%(70/291)的慢性胰腺炎患者伴发胰尾假性囊肿(图1A);18.6%(54/291)的患者伴发脾门假性囊肿,这些假性囊肿均从脾门区伸入脾实质(图1~3),其中23 名患者单纯由主胰管瘘破入脾门区形成(图1),13 名患者仅由胰尾假性囊肿发展至脾门区形成(图2),另18 名患者胰尾假性囊肿发展至脾门区和主胰管末端瘘破入脾门区共同作用形成脾门假性囊肿(图3)。
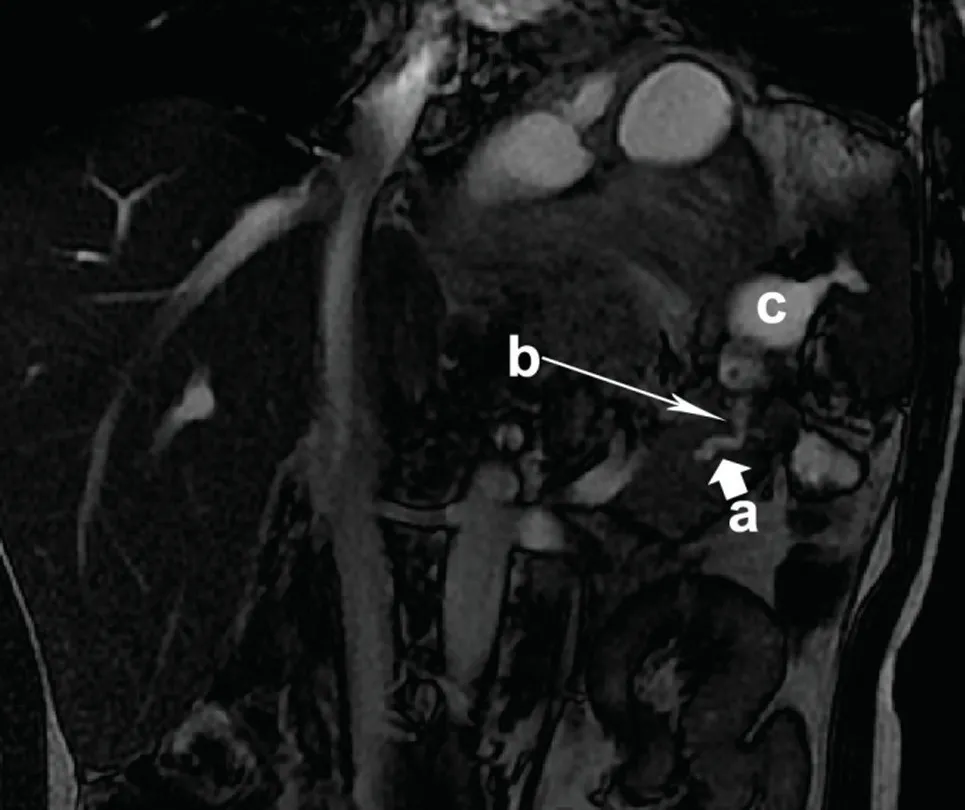
图1 典型病例1 I型脾门假性囊肿43 岁男性慢性胰腺炎患者冠状位MRI T2WI 像a.主胰管 b.主胰管末端瘘 c.胰瘘破入脾门区形成脾门假性囊肿并进一步伸入脾实质Fig.1 Typical case 1: a 43-year-old male with chronic pancreatitis underwent T2-weighted MRI scans a, main pancreatic duct; b,Distal fistula of the main pancreatic duct; c, The pancreatic fistula disrupted into the splenic hilum to form the POSH

图2 典型病例2 Ⅱ型脾门假性囊肿 65 岁男性慢性胰腺炎患者CT 增强像门静脉期胰尾假性囊肿发展至脾门区,突入脾实质形成脾门假性囊肿(a)Fig.2 Typical case 2: a 65-year-old male, type II POSH,with chronic pancreatitis underwent the CECT scans The CECT image at the portal venous phase showed the pseudocyst of pancreatic tail (POPT) developed to the splenic hilum, and further protruded into the spleen to form the POSH (a)

图3 典型病例3 Ⅲ型脾门假性囊肿49 岁男性慢性胰腺炎患者MRI T2WI 像A:轴位MRI 显示胰尾假性囊肿(a)B:冠状位MRI 显示主胰管末端瘘(b)胰瘘破入脾门区,导致脾门假性囊肿(c)并伸入脾实质C:胰尾假性囊肿(a)破入脾门假性囊肿(c)参与后者生成,另一脾内假性囊肿(d)位于脾包膜下区Fig.3 Typical case 3: a 49-year-old male, type III POSH, with chronic pancreatitis underwent T2-weighted MRI scans A: Axial MRI showed the POPT (a); B: Coronal MRI displayed distal fistula of the main pancreatic duct (b) disrupted into the splenic hilum, which resulted in the formation of the POSH (c).And this pseudocyst dissected into the spleen; C: The POPT (a) disrupted into the POSH (c) and participated into the formation of the latter one.Another intrasplenic pseudocyst (d) located at the subcapsular area of the spleen
2.2 利用CVH2 模拟脾门假性囊肿分类
根据脾门假性囊肿形成机制分为3 类,虚拟呈现于CVH2 模型上(图4)。第I类:胰尾假性囊肿累及脾门区,随后扩散入脾实质形成脾门假性囊肿(图4A);第Ⅱ类:主胰管瘘破入脾门区,发展成脾门假性囊肿(图4B);第Ⅲ类:胰尾假性囊肿发展至脾门区,且主胰管瘘破入脾门区,二者共同形成脾门假性囊肿(图4C)。
2.3 脾门假性囊肿与SPH 潜在关系
据结果显示,42.9%(36/84)的SPH 患者伴有脾门假性囊肿,而在无SPH 的病例中仅8.7%(18/207)的患者伴有脾门假性囊肿(OR=7.88,95%CI 2.56~24.21,P<0.001)。因此脾门假性囊肿是预测SPH 发病风险增高的重要指标。脾静脉与胃短静脉和胃网膜静脉之间侧支循环开放分别见于65.4%(55/84)和73.8%(62/84)的SPH患者(图5B),胃底胃壁水肿、增厚,伴发胃底静脉曲张见于71.4%(60/84)的SPH患者(图5B、C)。
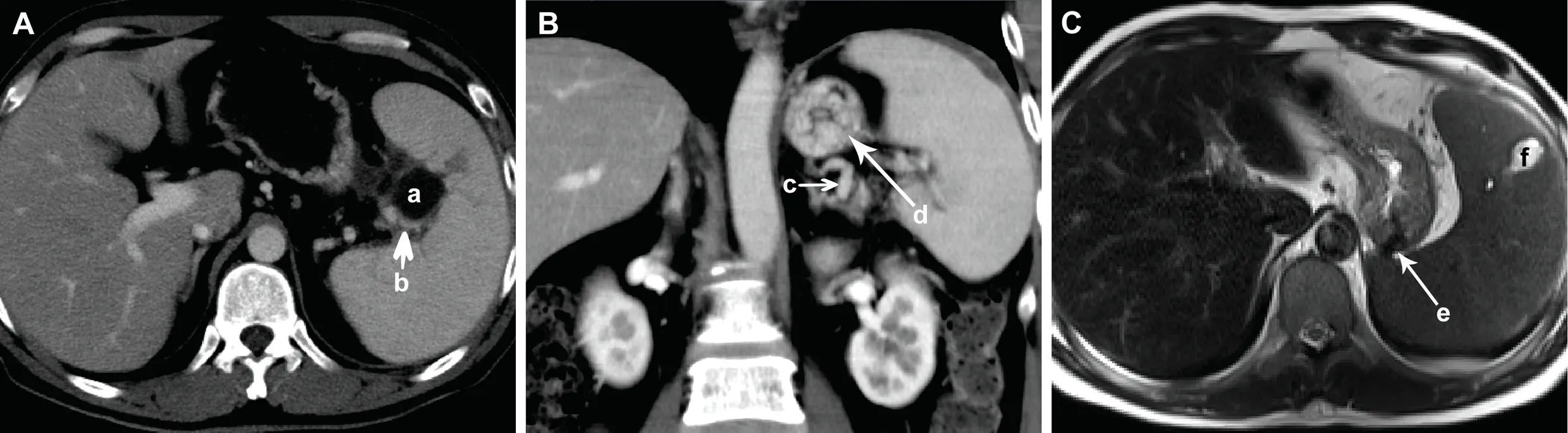
图5 病例3 继发于脾门假性囊肿的血管并发症A:CT 增强像显示脾门假性囊肿(a)压迫脾静脉远端分支(b)B:冠状位CT 可见该患者胃短静脉迂曲扩张(c)和胃底胃壁增厚、显著强化(d)C:MRI T2WI 像显示胃壁静脉曲张流空效应(e)和另一个脾内假性囊肿(f)Fig.5 Typical case 3: vascular complications followed to the POSH A: The CECT images showed that the POSH (a) compressed the distal branch of splenic vein (b); B:The varicosity of a short gastric vein (c), and the thickening and marked enhancement of the gastric wall of fundus (d) were present on the coronal CT; C:T2-weighted MRI displayed the voiding effect(e) of gastric varices and another intrasplenic pseudocyst (f)
2.4 患者治疗及转归
在291 位受试者中,80 位患者通过药物治疗康复出院;121 位患者接受了外科手术;90 位患者实施了微创介入手术,其中13 位患者行传统内镜引导下穿胃壁引流,21 位和45 位患者分别实施了经十二指肠大乳头内镜逆行胰管内引流和超声内镜引导下囊肿胃吻合引流术,11 位患者先后接受了上述两种引流术。23 位患者接受了内镜引导下引流联合外科手术。对54 位脾门假性囊肿病例施行了囊肿空肠吻合术。15 位患者实施了脾切除术。12 位行胰尾脾联合切除术,其中8 位患者脾切除术后死亡。有21 位SPH患者住院期间发生上消化道出血,给予内镜引导下组织黏合剂注射+静脉曲张栓塞术,其中6 位患者术后死亡。有34 位患者死于多器官功能衰竭。
3 讨论
既往研究对脾门假性囊肿的解剖定位不统一,未能对其分类[3,5~7]。本研究基于影像学观察,得出脾门假性囊肿可分为3 类(图4)。笔者认为将胰尾假性囊肿或/和胰尾瘘发展而来的位于脾门部和脾实质交界区的假性囊肿命名为脾内假性囊肿或慢性脾周积液有待商榷。从发病进程将各种病因导致的脾实质内梗塞灶继发的液化坏死灶,进一步发展为脾内囊性积液灶命名为脾内假性囊肿可能更为适宜[4];基于分布于脾周的潜在腔隙和软组织间隙的解剖学结构与功能,将累及脾周的胃脾隐窝、脾肾隐窝、膈脾隐窝、脾结肠隐窝和脾裸区等间隙,而未伸入脾实质的局灶性积液定义为慢性脾周积液更为妥当[13]。
本实验中57.4%(31/54)的脾门假性囊肿由胰尾假性囊肿发展而来或参与构成,由此将本研究对脾门假性囊肿的分类与Nealon 等[14]和D'Egidio 等对胰腺假性囊肿分类方法作一比较[15]。共同点是本分类方法和另两种分类方法均关注了胰管与假性囊肿的通联情况。不同之处在于:Nealon 等[14]的分类方法将胰腺假性囊肿与主胰管交通与否,以及主胰管有无狭窄作为分类依据。而D'Egidio 分类法除了关注前述两点以外,还将囊肿壁的成熟程度作为分类依据[15],关注囊肿的病程变化,更有利于选择合理的治疗方案。本分类方法除了关注脾门假性囊肿与主胰管的通联情况,还将胰尾假性囊肿是否参与脾门假性囊肿的形成作为分类依据之一。
有研究证实40%~66%的胰周假性囊肿患者存在通联胰周假性囊肿和主胰管之间的瘘[8]。这种通联关系使得临床医生可以经过十二指肠大乳头向胰周假性囊肿置入一个支架,并经该支架完成对胰周假性囊肿的引流,称为经乳头引流。本研究结果显示胰瘘存在于Ⅱ型和Ⅲ型脾门假性囊肿中,这两型脾门假性囊肿在所有脾门假性囊肿中的占比达75.9%(图1,图3)。由于存在主胰管和脾门假性囊肿之间的瘘,笔者认为前述两种脾门假性囊肿宜首选内镜引导下经乳头引流治疗,对于部分假性囊肿内因组织碎屑堵塞瘘管致使该手术无法正常进行者,需进一步采用超声内镜引导下引流,甚至外科手术。因此为选择合适治疗手段,术前行MRI 检查,尤其是磁共振胰胆管成像(magnetic resonance cholangiopancreatography,MRCP)了解主胰管和脾门假性囊肿之间是否存在这种通联关系极为必要。
如图4 所示脾门假性囊肿主要位于脾裸区这一相对封闭的软组织间隙,因此脾门假性囊肿常会压迫脾静脉及分支,导致其血流不畅及后续血管并发症如SPH 等(图5)[16,17]。本研究中,42.9%(36/84)的SPH 患者伴有脾门假性囊肿(图5)。本研究发现脾门假性囊肿是SPH 的重要风险预测指标(OR=7.88,P<0.001)。有研究显示50%脾静脉阻塞继发的SPH 病例由胰尾假性囊肿压迫所致,这与本研究数据较为相近[18]。分析原因可能有:本研究中57.4%的脾门假性囊肿由胰尾假性囊肿发展而来或参与构成,而脾门假性囊肿的脾外部分与胰尾假性囊肿在空间分布上均毗邻脾静脉及分支,都可能对其造成压迫引发SPH。SPH 可进一步导致上消化道出血,因此临床医生需关注胰腺炎患者病理进程中胰尾假性囊肿与脾门假性囊肿的发生发展。
本研究利用CVH2 数据库,直观感受3D 模型虚拟展示的脾门假性囊肿分类法,这将提高影像医生和胃肠外科医生对脾门假性囊肿病理解剖学的认识,增强彼此间关于脾门假性囊肿相关病变的学术交流,避免将脾门假性囊肿与脾内假性囊肿或脾周局灶性积液相混淆。对脾门假性囊肿所属类别的正确掌握还将提高后续临床治疗的效率和患者预后[19]。
综上所述,本研究通过影像学资料和CVH2 数据库,运用可视化技术发现脾门假性囊肿可分为3 类,而其中两类存在通联主胰管与脾门假性囊肿的瘘,使用MRI 检查了解主胰管和脾门假性囊肿之间是否存在这种通联关系,对后续采取何种治疗手段起指导作用。另外,本研究提示脾门假性囊肿是SPH 的重要风险预测指标。