胆汁酸及其受体与中枢神经系统疾病
2019-12-26吴县洪浩
吴 县 洪 浩
中国药科大学药学院药理系,南京,210009,中国
最近的研究表明,胆汁酸与其内源性受体结合参与调控胆固醇/胆汁酸代谢,葡萄糖/脂质代谢,免疫反应和能量代谢。此外,胆汁酸还可以通过在肠道中胆汁酸受体的活化释放中间信号分子,接受这些中间信号分子的受体也遍布全身。在人和啮齿动物大脑中已发现胆汁酸及其受体,然而,胆汁酸是否能够向中枢神经系统传递信号以及这种信号分子传导意味着什么,目前还不是很清楚。
1 胆汁酸的合成和调节
胆汁酸是胆汁的活性成分,分为游离型和结合型并具有类固醇骨架[1]。按来源又可分为初级胆汁酸和次级胆汁酸。胆汁酸由胆固醇经经典途径和替代途径转化而来,其中经典途径是胆汁酸合成的主要来源[2]。它是 由胆固醇7α-羟化酶(cholesterol 7α-hydroxylase,CYP7A1)启动酶促反应,最终形成胆酸(cholic acid,CA)和鹅去氧胆酸(chenodeoxycholic acid,CDCA)。而甾醇12α-羟化酶(sterol 12α-hydroxylase,CYP8B1)和甾醇-27 羟化酶(sterol-27 hydroxylase,CYP27A1)是形成CA 和CDCA 的关键酶。随后,这些初级胆汁酸与氨基酸甘氨酸或牛磺酸缀合形成甘氨胆酸(glycocholic acid,GCA)、甘氨鹅脱氧胆酸(glycochenodeoxycholic acid,GCDCA)、牛磺胆酸(taurocholic acid,TCA)和 牛磺酸鹅去氧胆酸(taurochenodeoxycholic acid,TCDCA)。次级胆汁酸主要在肠道菌群控制下的肠中形成,当其返回肝脏时可以与甘氨酸和牛磺酸结合[3-4]。在人类中,胆汁酸主要是CA 和CDCA,而在小鼠中主要是CA 和鼠胆酸(muricholic acid,MCA)。胆汁酸合成的替代途径主要由CYP27A1 启动,先转化为27-羟基胆固醇,随后被CYP7A1 羟基化,最后转化成CDCA。此外,肝肠循环也是调节胆汁酸合成的重要途径[5-6]。目前越来越多的研究表明,胆汁酸是一种信号调节分子,在代谢和炎症性疾病中发挥重要的调控作用[7-10]。
2 胆汁酸受体分类和特点
胆汁酸受体主要分为核受体和膜受体这两类[11]。核受体主要有类法尼醇 X 受体(farnesoid X receptor,FXR)、维生素D 受体(vitamin D receptor,VDR)、组成型雄烷受体(constitutive androstane receptor,CAR)和孕烷X 受体(pregnane X receptor,PXR)等[12];膜受体主要有TGR5(takeda G-protein-coupled receptor 5)[13]。目前研究最多的是FXR 和TGR5。
2.1 FXR
FXR 基因定位于人染色体的12q23.1 位置和大鼠染色体的7q13 位置。FXR 是最早发现的胆汁酸核受体,已被证明是胆汁酸的内源性配体,并且在调节转录因子中起作用。它能通过调控胆汁酸代谢过程中的关键酶以及转运体基因来调节胆汁酸的合成、吸收和代谢过程。FXR 主要在肝脏、肠道、肾脏、肾上腺、心脏以及脂肪组织上表达[2]。此外,在中枢神经元上也发现FXR 表达[14]。目前研究发现FXR 在糖脂代谢中具有重要作用。
2.2 TGR5
TGR5 属于G 蛋白偶联受体家族成员,由单个外显子基因编码,基因定位于人染色体2q35 位置和小鼠染色体1C3 位置,含有330 个氨基酸,于2002 年首次发现[15]。TGR5 在多种组织和细胞中表达,包括肝脏、胆囊、回肠、结肠、心脏、脾脏、肾脏、胎盘、白细胞、骨骼肌、棕色脂肪组织以及胰岛β细胞[15]。此外,在中枢神经元、小胶质细胞和星形胶质细胞中也有表达[16-17]。目前已发现TGR5 在糖脂代谢和免疫功能调节方面发挥重要作用,是新发现的用于治疗2 型糖尿病的药物靶标。
3 胆汁酸受体激动剂
3.1 FXR 激动剂
FXR 激动剂按结构分为甾体和非甾体两类。奥贝胆酸属甾体类FXR 激动剂,可以抑制胆酸合成的限速酶CYP7A1 间接抑制胆酸合成,目前已进入三期临床实验用于治疗非酒精性脂肪性肝炎[18]。CDCA 是FXR 活性最强的天然配体[19]。非甾体FXR 激动剂主要GW4064,具有降血脂作用,但其具有毒性,限制了其临床开发[20]。GSK8062 是在GW4064 结构改造后得到的化合物,对FXR 选择性高,但是水溶性差[21]。新合成的FXR 激动剂FXR450 在动物实验中发现能减少肝脏脂肪聚集且口服生物利用度较好[22]。Cilofexor(GS-9674)是一种选择性的非甾体FXR 激动剂,具有良好的耐受性和安全性,目前正在进行二期临床试验用于治疗原发性硬化性胆管炎患者的胆汁淤积[23]。
3.2 TGR5 激动剂
TGR5 激动剂大多为甾体类激动剂。石胆酸(lithocholic acid,LA)是TGR5 活性最强的天然配体。目前TGR5激动剂的开发策略主要是结构修饰内源性的胆汁酸以提高选择性。齐墩果酸是三萜类化合物,来源于橄榄叶,已被证实是一种非甾体类TGR5 激动剂,无FXR 活性,能改善胰岛素抵抗。INT-777 是一种新合成的胆汁酸衍生物,已被证明是高效的TGR5 特异性激动剂,目前正在进行临床前研究用于治疗2 型糖尿病。
4 胆汁酸及其受体介导的信号转导
目前胆汁酸及其受体对细胞内信号调控的机制研究还不是很清楚。研究证实,胆汁酸可通过其受体引起G 蛋白构象改变,导致细胞内环磷酸腺苷(cyclic adenosine monophosphate,cAMP)浓度增加,进而激活蛋白激酶A(protein kinase A,PKA),使cAMP 反应元件结合蛋白(cAMP-response element binding protein,CREB)磷酸化,而磷酸化的CREB 又可以与一些基因的启动子区域中的特定DNA 序列结合来调节靶基因的表达,从而发挥生物学效应。此外,细胞内cAMP 浓度升高还可抑制核因子κB(nuclear factor κB,NF-κB)的激活,而PKA 又能促进CREB 磷酸化,磷酸化的CREB通过与NF-κB 竞争辅助因子CREB 结合蛋白(CREB binding protein,CBP)来 抑制NF-κB 的功能[24-25]。研究发现,胆汁酸及其受体还参与调控丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号传导过程。胆汁酸与受体结合后,能够激活细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)、c-Jun 氨基末端激酶(c-Jun N-terminal kinase,JNK)和p38 丝裂原活化蛋白激酶(p38 mitogen-activated protein kinase,p38MAPK)介导的信号完成对靶基因的调节[26]。胆汁酸还能通过TGR5-cAMP-PKA 轴抑制NLRP3 炎性小体激活,从而发挥抗炎的作用[10]。此外,有研究发现胆汁酸及受体还能作用于中枢神经系统,分两种途径:一种是直接作用于中枢神经系统,这主要由于胆汁酸易通过血脑屏障发挥作用;另一种是间接的作用,如通过成纤维细胞生长因子19(fibroblast growth factor 19,FGF19)和胰高血糖素样肽1(glucagon-like peptide 1,GLP-1)向中枢神经系统进行信号传导[27]。
5 胆汁酸及其受体与中枢神经系统疾病
胆汁酸及其受体主要参与代谢性疾病以及炎症性疾病的发病过程。尽管胆汁酸及其受体在大脑中的生理功能尚未明确,但其病理生理学作用已有研究。最近的研究发现,胆汁酸及其受体也参与了阿尔茨海默病(Alzheimer’s disease,AD)、帕金森病、肌萎缩性脊髓侧索硬化症、亨廷顿病和急性中风以及肝性脑病等中枢神经系统病变过程。胆汁酸在中枢神经退行性疾病中的研究小结参见Tab.1[28]。
5.1 阿尔茨海默病
AD 是痴呆最常见类型,会导致患者性格变化并伴有不适当的情绪和社会行为以及认知功能衰退,其主要病理学特征是β-淀粉样蛋白(amyloid β-protein,Aβ)沉积形成的老年斑和Tau 蛋白过度磷酸化形成的神经纤维缠结[29]。有研究发现,AD 患者脑提取液和血浆中CA 比年龄匹配的对照受试者显著降低,提示胆汁酸水平的变化与AD 有关[30-31]。最近研究发现,熊去氧胆酸(ursodeoxycholic acid,UDCA)和牛磺熊去氧胆酸(tauroursodeoxycholic acid,TUDCA)能减少Aβ诱导的原代大鼠皮层和海马神经元的凋亡,具有抗凋亡的作用。UDCA 也被证明可通过调节BV-2 小胶质细胞系中的NF-κB 信号传导来抑制Aβ毒性[32]。此外,在APP/PS1 双转基因AD 动物模型中发现TUDCA 能明显减少海马和前额叶皮层中的淀粉样斑块数量,增加突触后 致 密 物-95(postsynaptic density protein-95,PSD-95)的表达,能显著改善记忆力[33-34]。然而这些实验都没有直接研究胆汁酸是否通过胆汁酸受体发挥作用的。实验结果表明,在Aβ、脂多糖(lipopolysaccharide,LPS)和链脲霉素(streptozocin,STZ)诱导的认知功能障碍小鼠模型中均伴有海马和前额叶皮层TGR5 表达的下调,而TGR5 选择性激动剂INT-777 能够明显改善这些模型小鼠的认知功能障碍、神经炎症、细胞凋亡和突触功能损伤,并能增加海马和前额叶皮层TGR5 的表达[35-36]。此外,还发现TGR5 在AD 病人皮层的表达明显比同龄正常人低且在9 和12 月龄APP/PS1 双转基因小鼠海马表达也明显下降。这些研究结果提示,胆汁酸及其受体可能参与了AD 的发病过程,但其具体机制目前尚不清楚,有待进一步研究。

Tab.1 A summary of the application of bile acids in neurodegenerative disorders
5.2 帕金森病(Parkinson’s disease,PD)
PD 特征在于大脑黑质区域多巴胺能神经元的选择性丧失而产生的震颤、肌强直以及运动减少[37]。有研究表明胆汁酸能改善PD 相关症状。Graham SF 等人的研究发现胆汁酸浓度的变化可作为预测PD 的潜在生物标志物,并可反映PD 的病情进展[38]。在硝普钠(sodium nitroprusside,SNP)诱导的人多巴胺能SHSY5Y 细胞PD 模型上发现,UDCA 剂量依赖性的降低SNP 诱导的细胞死亡。此外,有研究发现线粒体功能障碍与PD 有关,而UDCA 能通过激活糖皮质激素受体和增加蛋白激酶B(protein kinase B,AKT)磷酸化来改善线粒体功能[39-40]。1-甲基-4-苯基-1,2,3,6-四氢吡啶(1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine,MPTP)可用于诱导PD 相关的神经毒素模型,它能模拟人和动物PD 模型中的大多数临床病理特征[41]。在MPTP 诱导的黑质纹状体轴多巴胺能神经元缺失的PD 动物模型上发现TUDCA 能改善神经元退变。MPTP 诱导的神经毒性还与活性氧(reactive oxygen species,ROS)的增加以及JNK 介导的细胞凋亡有关,而TUDCA 可明显降低活性氧(reactive oxygen species,ROS)水平并能抑制细胞凋亡[42]。
5.3 肌萎缩性脊髓侧索硬化症(amyotrophic lateral sclerosis,ALS)
ALS 是一种渐进性的,具有致命性的运动神经元疾病,其主要病理特征为脑干、脊髓以及大脑皮质运动神经元缺失,从而导致肌肉无力和萎缩以及运动功能性瘫痪。NSC-34 细胞是通过融合培养神经母细胞瘤细胞和来自小鼠脊髓的运动神经元产生的,是目前广泛使用的小鼠运动神经元细胞系模型。用视黄酸处理NSC-34 细胞可以诱导神经突向外生长[43-44]。SOD1是最早发现的一种ALS 致病基因,经修饰以携带具有G93A 突变的人类SOD1(hSOD1G93A)的NSC-34 细胞已被用作ALS 细胞模型。据报道,GUDCA 可减少NSC-34 hSOD1G93A 细胞模型中的细胞死亡并阻断caspase-9 的激活[45]。此外,临床研究数据表明,ALS患者口服UDCA 后,具有良好的耐受性并能以剂量依赖性的进入脑脊液[46]。临床试验发现,ALS 患者口服UDCA 3 个月后耐受性依然表现良好[47]。每天口服TUDCA 两次超过1 年,可改善受试者在ALS 功能评定量表中表现[48]。
5.4 亨廷顿病(Huntington’s disease,HD)
HD 是一种常染色体显性遗传性神经退行性疾病,由亨廷顿蛋白(Huntingtin,HTT)基因外显子1 中CAG三联体重复序列的扩增突变引起,常伴有非自愿性舞蹈动作、精神和行为障碍以及认知功能受损[49]。3-硝基丙酸(线粒体琥珀酸脱氢酶的不可逆化学抑制剂)可用于诱导动物脑纹状区神经元凋亡,引起类似于HD 相关的形态学和神经学变化。用TUDCA 孵育大鼠神经元RN33B 细胞可以使3-硝基丙酸诱导的细胞凋亡减少约80%[50]。其他胆汁酸,包括UDCA 和GUDCA,也能减少细胞凋亡,阻止3-硝基丙酸诱导的线粒体细胞色素C 的释放[51]。而在HD 的遗传模型中如R6/2 转基因小鼠,表现出严重的神经变性,导致生存时间缩短至少4 个月。R6/2 转基因小鼠从断奶至6 月龄,每隔3天皮下注射给予TUDCA(500 mg·kg-1)一次治疗可明显减少纹状体细胞凋亡,并增强其在开场运动和感觉运动测试中的表现[52]。
5.5 急性中风(acute stroke)
中风分为缺血性与出血性两大类,是一种严重的脑血管疾病。已有研究发现,大鼠大脑中动脉闭塞60 min后单剂量静脉给予TUDCA,可显著减少梗死面积和细胞凋亡[53]。单剂量静脉注射UDCA 可导致脑内UDCA水平显著增加,从不能检测上升至 0.15 nmol·g-1。此外,还发现TUDCA 在中枢神经系统中有抗炎作用,可减少胶质细胞活化以及促炎细胞因子表达[54]。在纹状体注射胶原酶诱导出血性损伤后,在颈动脉注射TUDCA 可减少病灶容积和周围血肿,且二天后半胱天冬酶活性下降50%[55]。
5.6 肝性脑病(hepatic encephalopathy,HE)
HE 是急性和慢性肝衰竭引起的严重神经系统并发症。从无症状到严重的认知能力下降,甚至死亡[56]。有研究发现TGR5 mRNA 在肝性脑病人皮层中表达明显下调[16]。在氧化偶氮甲烷(azoxymethane,AOM)诱导的肝性脑病动物模型中,TGR5 激动剂桦木酸(betulinic acid)可以明显改善神经功能下降,增加皮质cAMP 浓度,减少小胶质细胞激活以及促炎症细胞因子的产生[57]。胆汁酸及其受体在中枢神经退行性疾病中的相关调节机制参见Fig.1。
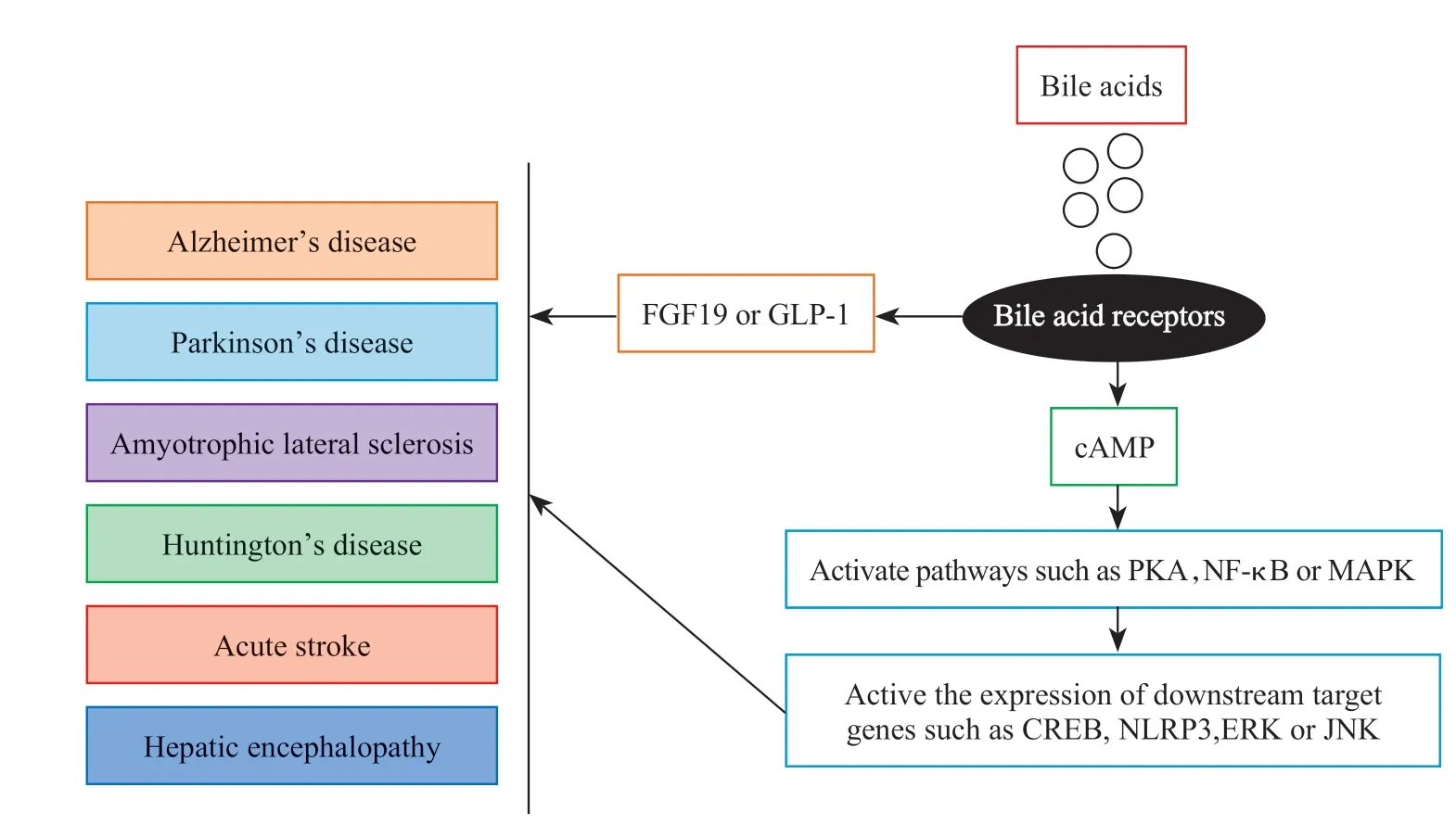
Fig.1 TGR5 signal transduction pathway
6 总结与展望
胆汁酸及其受体的研究主要是在外周,并有望用于治疗代谢型疾病如高血脂、脂肪肝、肥胖和糖尿病等。对胆汁酸及其受体的研究,将加速受体特异性激动剂的开发,降低毒副作用并提高疗效。胆汁酸易通过血脑屏障并且在中枢组织中发现其受体有表达,这些发现表明其可能具有重要的功能作用。目前在细胞和动物模型以及人体临床试验中,胆汁酸及其受体的中枢神经保护作用已经确认,但它们在中枢神经系统疾病中的作用机制有待深入研究。研究胆汁酸及其受体在中枢神经系统中作用,将促进对中枢神经系统疾病发病机制的研究,这将为开发用于防治中枢神经系统疾病的新型药物提供理论基础。
