MAPREC与MNVT评价III型Sabin株脊髓灰质炎病毒神经毒力的比较
2019-12-23李娜丁玲马萌孙千一王红燕李拓
李娜,丁玲,马萌,孙千一,王红燕,李拓
论著
MAPREC与MNVT评价III型Sabin株脊髓灰质炎病毒神经毒力的比较
李娜,丁玲,马萌,孙千一,王红燕,李拓
用 PCR 扩增及限制性酶切分析突变技术(MAPREC)和猴体神经毒力试验(MNVT)评价同一批 III 型 Sabin 株脊灰病毒神经毒力的结果差异。
采用 MAPREC 技术,检测 III 型 Sabin 株脊灰病毒神经毒力关键位点 472 位点突变率;采用 MNVT 病理切片分析,评价 III 型 Sabin 株脊灰病毒神经毒力。
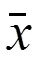
在III 型 Sabin 株脊灰病毒神经毒力检测方面,操作简单,试验周期短的MAPREC 技术可作为金标准 MNVT 的有益补充。
神经毒力; III 型 Sabin 株脊髓灰质炎病毒; 分子水平; 动物水平
Sabin 株脊髓灰质炎病毒(脊灰病毒)由于其安全性高、免疫效果好的优势,被世界卫生组织(WHO)推荐在发展中国家用于生产脊灰病毒疫苗。目前市面上使用 Sabin 株生产的脊灰病毒疫苗包括口服 Sabin 脊髓灰质炎减毒活疫苗(oral poliovirus vaccine,OPV)和 Sabin 脊灰病毒灭活疫苗(sabin inactivated poliovirus vaccine,sIPV)。自 Sabin 株脊灰疫苗使用以来,脊髓灰质炎病例自 1988 年以来已减少了 99% 以上,从 35 万多例的估计数减少到 2017 年的 22 例报告病例,为全球消除脊灰病毒做出了巨大贡献。如今,世界上只有巴基斯坦、阿富汗和尼日利亚三个国家没有消灭脊髓灰质炎的传播,偶有病例报告。Sabin 株脊髓灰质炎病毒是由野毒株 Salk 株经连续低温传代得到,Sabin 株 OPV 遗传物质比较稳定,但接种 OPV 仍会出现极低概率的疫苗相关的麻痹性脊髓灰质炎(vaccine associated paralytic poliomyelitis,VAPP)及疫苗衍生脊髓灰质炎病毒(vaccine derived poliovirus,VDPV)现象[1]。主要原因是 Sabin 株毒株在传代时候发生了基因突变,导致神经毒力恢复。因此在疫苗生产中,检测 Sabin 株脊灰病毒神经毒力是必要的[2]。目前神经毒力检测方法主要包括以下几个方法:①猴体神经毒力试验(monkeys neurovirulence test,MNVT),该方法是 Sabin 株脊灰病毒神经毒力检测的金标准,2015 版《中国药典》要求每批 OPV 疫苗需通过 MNVT 检测;② Tg PVR21 转基因小鼠神经毒力试验方法,该方法转基因小鼠表达脊灰病毒受体,使小鼠对脊灰病毒易感,从而评价神经毒力,该方法涉及专利问题,不被允许大规模应用[3];③ PCR 扩增及限制性酶切分析突变技术(mutant analysis by PCR and restriction enzyme cleavage,MAPREC),检测重要毒力位点突变率,该方法基于分子生物学方法,操作简单,要求较低;④深度测序技术,大规模平行测序,监控所有基因位点改变。本研究利用 MAPREC 从分子水平和 MNVT 从动物水平共同检测一批 III 型 Sabin 株脊灰病毒神经毒力,对比检测结果是否保持一致。
1 材料与方法
1.1 材料
1.1.1 标准品及样品 MAPREC 实验用标准品均购自英国国家生物制品检定所(national institute for biological standards and control,NIBSC),具体信息如表 1 所示。猴体神经毒力实验标准品为:脊髓灰质炎减毒活疫苗参考品,购自 NIBSC,批号 III-1981。试验样品为III 型 Sabin 株脊灰病毒,批号:III201101,来自北京生物制品研究所有限责任公司。

表 1 MAPREC 标准品信息
1.1.2 主要仪器及试剂 CF16RN 离心机为日本日立公司产品;Azure Sapphire 多功能分子成像系统为美国 Azure 公司产品;Hoefer-SE600-Ruby 垂直电泳仪为美国通用电气公司产品;T-100 基因扩增仪为美国伯乐公司产品;EG1150 C 冰台、EG1150 H 包埋机、HI 1220 烘片机、RM2245 切片机均为德国徕卡公司产品。限制性内切酶I(1501804)、I(10007459)购自 New England Biolabs 公司;病毒 RNA 提取试剂盒(R6423)购自天根生物科技有限公司;SuperScriptTMIV First-Strand Synthesis System(00599722)、AmpliTaq Gold 360 Master Mix(1710071)均购自美国赛默飞公司;没食子蓝(MKBT6206V)、加拿大树胶(20150324)、正丁醇(20141114)、乙醚(20180201)、无水乙醇(20170902)、丙酮(20170210)、二甲苯(20170601)均购自国药集团化学试剂有限公司。
1.1.3 引物探针序列 引物 pA-3/484 序列:5' CAGGCTGGCTGCTGGGTTGCAGCTGCCTGC 3',工作浓度均为 3 μg/ml。pS-3/470 序列:5' TGAGCTACATGAGAGTGCTCCGGCCCCTGAATGCGGCTGA 3',工作浓度均为 30 μg/ml。引物与 CY5 标记的 pA-3/484 探针(CY5-pA-3/484)均由生工生物(上海)科技有限公司合成。
1.1.4 实验动物 实验用恒河猴购自北京协尔鑫生物资源研究所有限责任公司,许可证号:SCXK(京)2015-0011。北京所实验动物许可证号:SYXK(京)2016-0051。恒河猴为抗脊灰病毒抗体阴性、体重> 1.5 kg、检疫合格的一级实验用猴,未作其他实验,2018087-2018108 号免疫参考品,2018109-2018130 号免疫样品。
1.2 方法
1.2.1 MAPREC 检测 III 型 Sabin 脊灰病毒 472-C 突变率
1.2.1.1 RNA 提取与反转录制备 cDNA 按照病毒 RNA 提取试剂盒说明书,提取待测样品与标准品 LMVR、HMVR 的病毒基因组 RNA,随后立刻按 SuperScriptTMIV First-Strand Synthesis System 说明书进行体外反转录,得到 3 种 cDNA。
1.2.1.2 非对称 PCR 最佳模板浓度筛选[4]按以下比例配置非对称 PCR 反应 Mix:2 × PCR Master Mix 25 μl,pA-3/484 和 pS-3/470 各 5 μl,H2O 10 μl,总体积 45 μl。
每个 cDNA 组有 7 管,除 1 号管加入56.25 μl 非对称 PCR Mix 外,2 ~ 7 号管中各加50 μl 非对称 PCR Mix。分别取 6.25 μl cDNA 加到对应的 1 号管中,混匀后取 12.5 μl 移到 2 号管,依次重复,直至 7 号管混匀后弃去 12.5 μl 液体。
另取 5 管为对照,每管加 45 μl 非对称 PCR 反应 Mix,分别加入 0.01 μg/ml 100% DNA,2 支 0.01 μg/ml IS DNA,分别命名为 IS DNA-A 和 IS DNA-B,无菌水、反转录对照各 5 μl。
按照以下条件进行 PCR 反应:95 ℃ 10 min,95 ℃ 15 s,55 ℃ 30 s,72 ℃ 1 min,运行 40 个循环,72 ℃ 7 min。取 10 μl 扩增产物,加入 PCR Master Mix 和 6 μg/ml 的标记探针 CY5-pA-3/484 各 1 μl,混匀离心后 72 ℃反应 10 min,进行 PCR 产物的荧光标记。取 4 μl 标记产物加入 1 μl 30% 甘油,进行 10% 聚丙烯酰胺凝胶电泳。Azure Sapphire 设备里 CY-5 模式下扫描、成像、分析。
1.2.1.3 突变率检测 选择目的条带明显,且引物剩余少的最高稀释管的 PCR 产物用于酶切和
定量分析。取 6 μl 标记混合物,加入终浓度分别为 2 U/μl 的 Mbo I 酶切工作体系 1 μl,37 ℃孵育 2 h,电泳后在 Azure Sapphire 设备里 CY-5 模式下扫描、成像、分析,共进行 5 次重复实验,对结果进行分析。
1.2.2 猴体神经毒力实验[5-6]
1.2.2.1 样品稀释 供试品滴度调至 105.5~ 106.5半数细胞培养感染量(50% cell culture infective dose,CCID50)/0.1 ml。
1.2.2.2 猴体免疫 将已麻醉的猴子各 14 只分别免疫,在第一腰椎处,将针头在正中略斜处刺入,免疫 0.1 ml 样品及参考品,在笼上标记猴号,观察 17 ~ 22 d。北生研根据《北京市实验动物福利伦理审查指南》、《北京实验动物管理条例》制定了《实验动物福利伦理及动物实验安全审查 SOP》,实验中所涉及的实验动物均严格遵守该 SOP,充分考虑动物的利益,善待动物,防止或减少动物的应激、痛苦和伤害,尊重动物生命,制止针对动物的野蛮行为、采取痛苦最少的方法处置动物。实验方法和目的符合道德伦理标准和国际惯例。
1.2.2.3 组织切片染色计分 观察期末将动物处死后,石蜡包埋大脑和脊髓不同部位并切片(厚度 9 ~ 15 μm),经没食子蓝染色后,镜下检查。根据病毒活性计分标准对每只猴腰髓切片,以猴脑及脊髓中线为界,左右分别计分,并判断是否是有效猴(每只猴 29 块组织切片中任意 1 切片评分≥ 2,则视为有效猴),评分标准[5]:没有损伤为 0 分;仅有细胞浸润为 1 分;细胞浸润伴有少量的神经元损害,为 2 分;细胞浸润伴有广泛的神经元损害,为 3 分;大量的神经元损害,伴有或无细胞浸润,为 4 分。再对其他部位切片左右分别计分,统计出腰、颈、脑部的各自平均分,统计单只猴的病变平均分。
1.3 统计学处理
2 结果
2.1 最佳 PCR 模板浓度筛选
对于逆转录的 cDNA 进行 5 倍梯度稀释,作为非对称 PCR 的模板,待测样品最佳 PCR 模板浓度筛选电泳结果如图 1 所示,54倍稀释度为最高稀释度且不产生引物二聚体的稀释浓度,待测样品 cDNA 模板 54倍稀释下的 PCR 产物作为我们下一步定量分析的目标。HMVR 和 LMVR 的最佳 PCR 模板浓度筛选电泳图与图 1 一致。HMVR 为 57倍稀释,LMVR 为 56倍稀释。
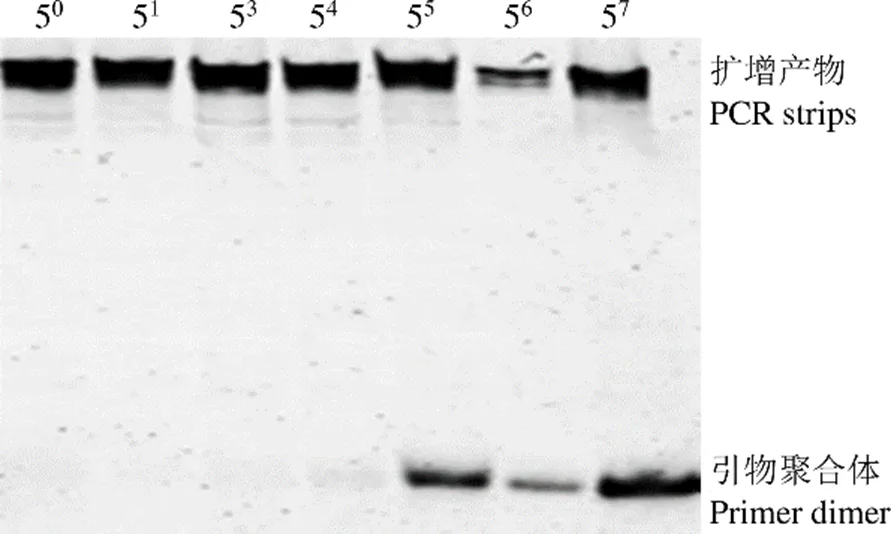
图 1 PCR 模板筛选电泳图
Figure 1 Electropherogram for PCR template screening
2.2 定量突变率检测
利用筛选出的最佳 PCR 模板的产物进行荧光标记、酶切、电泳、扫描成像后对酶切条带的灰度值进行分析,根据各个条带的灰度值计算各个样品的突变率,电泳结果扫描如图 2 所示。5 次重复酶切突变率如表 2 所示,IS DNA-A 与 IS DNA-B 的比值为 1.004,结果接近 1。IS DNA-A与 IS DNA-B 的测定值波动小,检测值在 ± 3之间。LMVR 的检测突变率低于同步检测的 IS DNA 的检测突变率。HMVR 的检测突变率高于同步检测的 IS DNA 的检测突变率,样品合格。
2.3 猴体神经毒力实验切片分析
由同一人采用计分法在显微镜下观察并在镜检结果记录表中记录结果,并评分,图 3 为试验中神经元病变图。图 3A 为针迹反应;图 3B 为正常神经元,评为 0 分;图 3C 仅有细胞浸润,评为 1 分;图 3D 细胞浸润伴有少量的神经元损害,评为 2 分;图 3E 细胞浸润伴有广泛的神经元损害,评为 3 分。
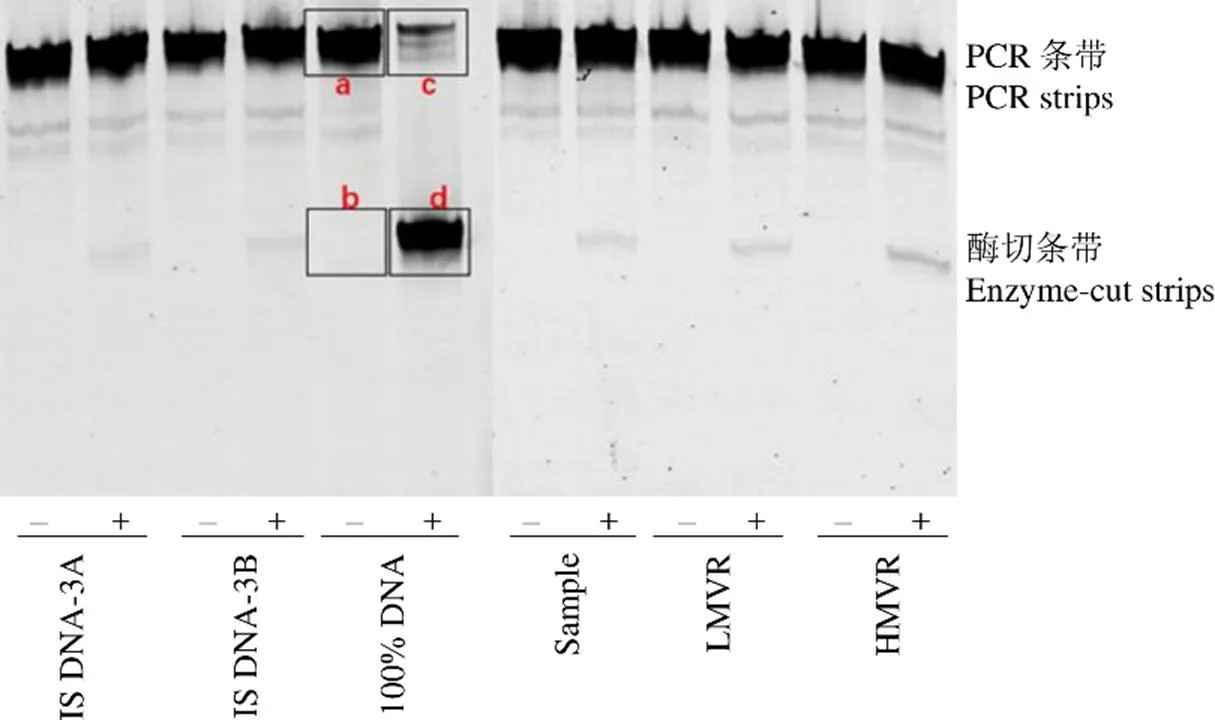
图 2 定量检测电泳图(突变率 = d/(c + d) – b/(a + b),“–”表示非酶切,“+”表示酶切)
Figure 2 Electropherogram for quantitative detection of mutation rate (Mutant rate = d/(c + d) – b/(a + b), “–” represent non-digested DNA, “+” represent digested DNA)
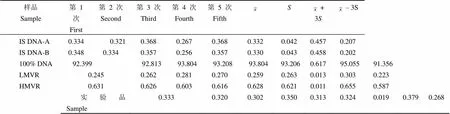
表 2 5 次定量检测结果分析(%)
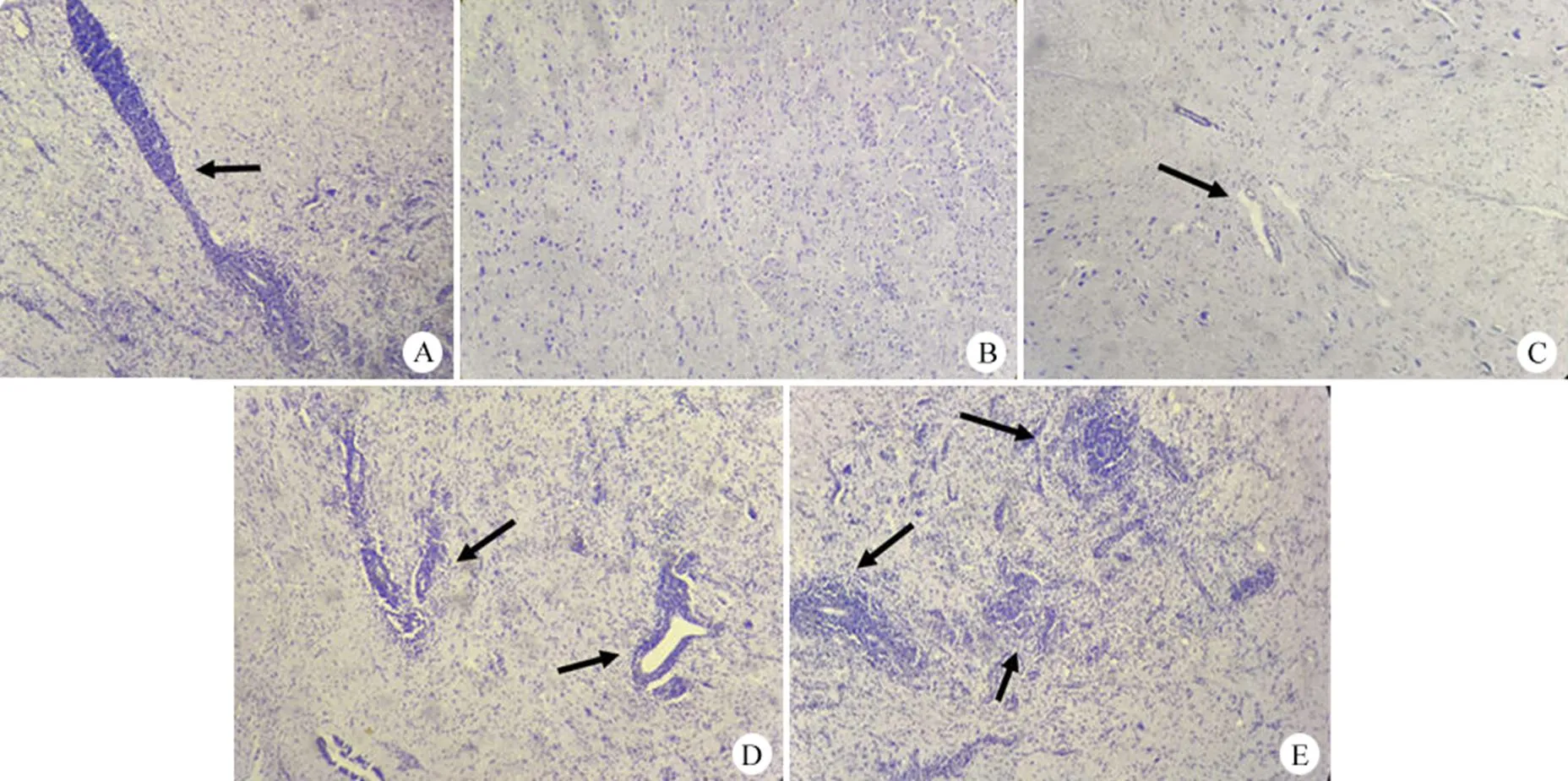
图 3 猴体神经病变切片图(40 ×)
Figure 3 Picture for monkey nerve tissue lesion slice (40 ×)
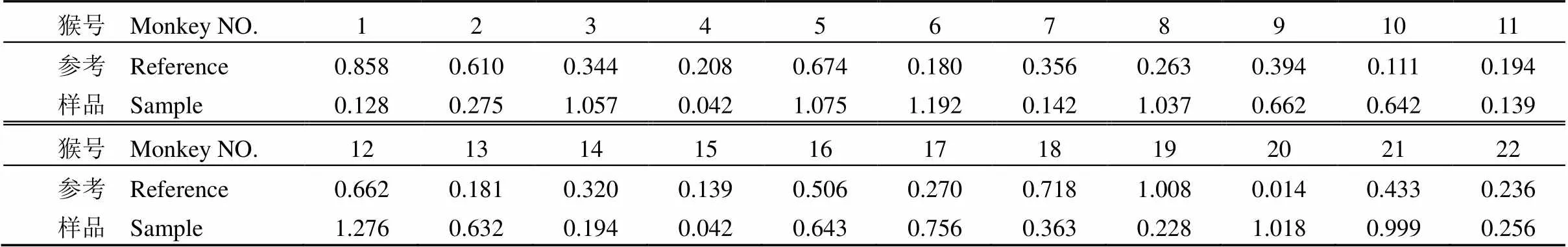
表 3 每只猴的 Ls 值
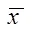
2.4 猴体神经毒力实验数据分析
3 讨论
Sabin 株脊灰病毒疫苗由于其成本低廉和免疫效果好的原因被发展中国家大量生产使用。2015 版《中国药典》OPV 成品及 sIPV 毒种需要经过 MNVT 检测,证明其神经毒力在可控范围。MNVT 实验作为脊灰病毒神经毒力验证的金标准,是疫苗生产厂商目前检测其疫苗安全性最可靠的方法。但是 MNVT 耗时周期长达一个月,在日常工作中会拖慢工作进度。MAPREC 实验从分子水平检测某个具体关键位点的突变率反映整体疫苗的安全程度,具有实验操作简单,实验周期短等特点,MAPREC 实验将实验样品与标准品同时检测,能客观反映待测样品相对于标准品的突变程度。在目前阶段,疫苗生产单位可以辅助使用MAPREC 技术用于 Sabin 株脊灰病毒的突变率的监测,作为风险监控的指标,快速指导生产工作的安排。在本文中,我们使用 MAPREC 技术和 MNVT 同时对一批 III 型 Sabin 株脊灰病毒神经毒力进行检测。试验表明,两种不同的技术,得到的结果是一致的。但目前对于 Sabin 减毒株关键毒力位点的研究还不是十分明确,因此目前 MAPREC 实验仍不能取代 MNVT。随着分子生物技术的发展,对 Sabin 株脊灰病毒回复突变的研究的深入,Sabin 株脊灰病毒回复突变原理逐渐清晰,控制神经毒力的关键位点被明确找到后,一个替代MNVT 的分子生物学技术有望得到应用。
[1] Li HZ, Sun MB, Yang JS. Research progress of sequential immunization schedule for poliomyelitis vaccine. Chin J Vaccine Immun, 2016, 22(3):327-332. (in Chinese)
李洪哲, 孙明波, 杨净思. 脊髓灰质炎疫苗序贯免疫程序的研究与应用进展. 中国疫苗和免疫, 2016, 22(3):327-332.
[2] Luo HM, Yu WZ, Wen N, et al. Application of poliomyelitis vaccine and recommendation on switch of immunization strategies in China. Chin J Vaccines Immun, 2014, 20(2):172-176. (in Chinese)
罗会明, 余文周, 温宁, 等. 中国脊髓灰质炎疫苗使用历史回顾及免疫策略调整建议. 中国疫苗和免疫, 2014, 20(2):172-176.
[3] Ohka S, Igarashi H, Nagata N, et al. Establishment of a poliovirus oral Infection system in human poliovirus receptor-expressing transgenic mice that are deficient in alpha/beta interferon receptor. J Virol, 2007, 81(15):7902-7912.
[4] World Health Organization. Standard operating procedure mutant analysis by pcr and restriction enzyme cleavage (maprec) for oral poliovirus (sabin) vaccine types 1, 2 or 3. Version 5. 2012 [2019-02- 26]. https://www.who.int/biologicals/vaccines/MAPREC_SOP_Final_ 09112012.pdf?ua=1.
[5] Qu Z, Yang YW, Lv JJ, et al. Establishment of a histopathology evaluation method of in vivo neurovirulence test in monkeys. Chin J New Drugs, 2014, 23(18):2117-2122. (in Chinese)
屈哲, 杨艳伟, 吕建军, 等. 猴体神经毒力实验组织病理学评价方法的建立. 中国新药杂志, 2014, 23(18):2117-2122.
[6] Xie ZP, Chen HB, Shen D, et al. Analysis of pathological lesion caused by neurovirulence test of oral poliovirus vaccine in monkeys. Chin J Biol, 2007, 20(3):206-208, 218. (in Chinese)
谢忠平, 陈瀚博, 沈冬, 等. 口服脊髓灰质炎减毒活疫苗猴体神经毒力试验病理结果分析. 中国生物制品学杂志, 2007, 20(3):206- 208, 218.
Evaluation of the neurovirulence of type III Sabin strain poliovirus through MAPREC and MNVT
LI Na, DING Ling, MA Meng, SUN Qian-yi, WANG Hong-yan, LI Tuo
To study the difference between the neurovirulence of the same type III Sabin strain poliovirus examined by MAPREC and MNVT.
The MARPEC assay was used to detect the point mutation rate of the 472 site, which are the key sites of the virulence of the type III Sabin strain poliovirus. The paraffin sections of the MNVT was analyzed to evaluate the neurovirulence of the type III Sabin strain poliovirus.
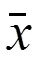
In the detection of virulence of poliovirus type III Sabin strain, the simple operation and short test period of MAPREC can be used as a beneficial supplement to the gold standard MNVT.
Neurovirulence; Type III Sabin strain poliovirus; Molecular level; Animal level
LI Tuo, Email: little0815@qq.com
Author Affiliation: Department of Quality Control (LI Na, DING Ling, MA Meng, SUN Qian-yi, LI Tuo), Department of Vaccine Facility 4 (WANG Hong-yan), Beijing Bio-Institute Biological Products Co., Ltd., Beijing 100176, China
10.3969/j.issn.1673-713X.2019.06.003
“重大新药创制”国家科技重大专项(2018ZX09737008)
100176 北京生物制品研究所有限责任公司质量检定室(李娜、丁玲、马萌、孙千一、李拓),疫苗 4 室(王红燕)
李拓,Email:little0815@qq.com
2019-08-02
