新疆紫草及其活性成分抗病毒作用研究进展
2019-12-23徐景怡吴硕李玉环于莲
徐景怡,吴硕,李玉环,于莲
综述
新疆紫草及其活性成分抗病毒作用研究进展
徐景怡,吴硕,李玉环,于莲
紫草是紫草科植物新疆紫草(Royle) Johnst 或内蒙古紫草Bunge 的干燥根,为常用中药之一,最早记载在《神农本草经》中。其味甘、咸,性寒,归心、肝经,具有清热、活血、解毒等功能[1]。新疆紫草也被称为软紫草,其主要活性成分具有多种生理活性,包括抗菌、抗炎、抗病毒、抗肿瘤和免疫调节等[2],本文主要对其抗病毒活性进行综述。
1 化学成分研究
已报道从新疆紫草分离出多种化学成分,包括萘醌类、单萜苯醌类、苯酚类、多糖类以及酚酸类等物质[2-3]。其主要有效成分为萘醌类化合物,包含紫草素类和阿卡宁类,两者化学结构为 R 和 S 型光学异构体(图 1),目前已分离鉴定的紫草素类化合物包括去氧紫草素、β,β'-二甲基丙烯酰紫草素、乙酰紫草素、紫草素、丙酰紫草素、异丁酰紫草素、异戊酰紫草素、β-乙酰氧基-异戊酰紫草素、β-羟基-异戊酰紫草素;阿卡宁类化合物包括β-β'-二甲基丙烯酰阿卡宁、β-乙酰氧基异戊酰阿卡宁、乙酰阿卡宁、β-羟基异戊酰阿卡宁。
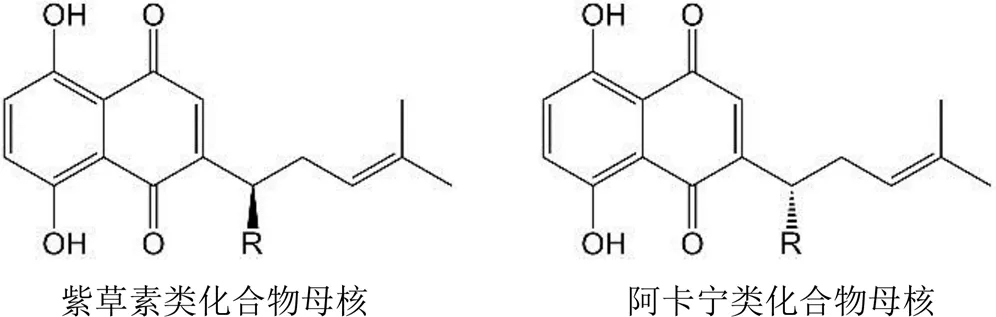
图 1 紫草素类化合物和阿卡宁类化合物化学结构
2 抗病毒作用
2.1 抗人乳头瘤病毒
尖锐湿疣是由人乳头瘤病毒(human papillomavirus,HPV)感染引起的性传播疾病,具有致癌性。现今临床上尚未有可治疗的药物。符惠燕等[4]进行分极性段提取紫草,通过荧光定量 PCR 测定各提取物对分离的尖锐湿疣疣体标本中 HPV-DNA 的抑制作用。结果表明,只有紫草水提取物能使 HPV-DNA 呈阴性,最低有效浓度为 0.2 g/ml,而其他部分提取物作用后的 PCR 扩增呈阳性。因此,紫草的水提取物具有显著抗 HPV 作用。邓远辉等[5]提取、分离、纯化获得分子量分别为 27366 和 1152 的两个紫草多糖,含有这两个多糖的混合物在体外能明显抑制 HPV-DNA 活性。舒海燕等[6]通过 MTT 法、Annexin V/PI 染色后流式分析以及 DAPI 染色等方法检测发现,紫草素作用 24 h 后可明显抑制感染 HPV16 的宫颈癌 Caski 细胞增殖并促进其凋亡。陈天雷等[7]在临床中对尖锐湿疣患者进行紫草煎剂浸泡外洗治疗后,皮肤中凋亡抑制因子 Bcl-2 和 survivin 以及 VEGF 的表达均明显降低,与对照处理组相比治愈率高,复发率低,提示紫草可能通过促进病毒感染细胞凋亡,抑制疣体供血血管的增生,切断疣体的营养来源,清除病毒,使疣体缩小乃至消退。
2.2 抗人类疱疹病毒
简单的疱疹病毒如单纯疱疹病毒(herpes simplex virus,HSV)、水痘-带状疱疹病毒(varicella zoster virus,VZV)可引起各种皮肤病,例如咽炎、唇疱炎和生殖器疱疹。紫草对其有治疗作用。紫草液与 HSV 病毒液混合 12 h 后病毒的感染力明显减弱,表明紫草可以直接灭活 HSV-II 病毒;在预防给药、同时给药、治疗给药三种途径下采用原代兔肾细胞培养法测得紫草水煎液对 HSV-II 最低有效浓度分别为 3.125、0.78 和 0.391 mg/ml[8],表明相对于预防给药,紫草液同时给药和治疗给药中具有较好的抗 HSV-II 效果。江爱龙和江松员[9]对 132 例带状疱疹患者外用紫草锌油并随证内服龙胆泻肝汤,结果显示,痊愈 120 例(90.91%)、好转 9 例、无效 3 例,治疗时间最短为 2 天、最长为 15 天,显著缩短了治疗期,提高了疗效。
2.3 抗流感和副流感病毒
流感病毒(influenza virus,IFV)基因组的高突变率以及病毒相互之间重组现象的发生使得流感病毒的大爆发和季节性流感严重威胁着人类的健康。刘国声等[10]用试管内直接接触法和预防方法,通过鸡胚实验检测了中药对亚洲甲型流感病毒的作用,发现紫草提取品紫草素体外 37 ℃作用 3 h 具有较好抗病毒作用,最小有效浓度为 0.25 mg/ml。Tian 等[11]筛选了 439 个中药水提取物对 A 型流感病毒神经氨酸酶活性的抑制情况,结果显示紫草提取物对 A 型流感病毒 H1N1 A/California/7/2009(H1N1)NYMC X-179A 株神经氨酸酶有较好的抑制活性,IC50为(184.3 ± 13.1)μg/ml,且紫草提取物在 MDCK 细胞中可以剂量依赖性降低病毒引起的细胞病变效应和子代病毒的产生。说明传统中药紫草有较强的抗流感病毒活性,但是仍然需要进一步的纯化和鉴定来找出发挥抗流感病毒活性的确切成分。Zhang 等[12]发现紫草素酯衍生物 PMM-034 在 MDCK 细胞和 A549 细胞中对流感病毒 A/PR/8/34(H1N1) 的抑制活性优于或相当于对照化合物奥司他韦。PMM-034 也可以剂量依赖性降低流感 A/PR/8/34(H1N1) 神经氨酸酶的活性,结构模拟和分子对接实验进一步证实 PMM-034 结合在流感病毒神经氨酸酶 ARG 118、ARG 152、ARG 371 和 GLU 227 四个氨基酸处。该研究还发现在 A549 细胞中 PMM-034 可以抑制流感病毒引起的细胞凋亡以及促炎细胞因子 TNF-α 和 IL-8 的表达,因此紫草素酯衍生物 PMM-034 是一个很有潜力的抗流感病毒药物。
副流感病毒(parainfluenza virus,PFV)也是一种可引起呼吸道感染的病毒,也可引起如肺炎、支气管炎和细支气管炎等严重的疾病。罗学娅等[13]用平皿内直接杀灭副流感病毒实验证明左旋紫草素对副流感病毒具有明显的剂量依赖性的直接杀灭作用。进一步利用血细胞凝集和细胞病变方法证明左旋紫草素在 6.0 ~ 0.75 mg/ml 可抑制副流感病毒对鸡胚细胞的致病变作用且呈剂量依赖性,但其作用机制尚不明确,有待于进一步探索。
2.4 抗人类免疫缺陷病毒
人类免疫缺陷病毒(human immunodeficiency virus,HIV)是一种攻击人体免疫系统的病毒。它以人体免疫系统中最重要的 CD4T 淋巴细胞为主要靶点,大量破坏细胞并剥夺机体的免疫功能。因此,HIV 患者容易发生各种疾病,并且可能发生恶性肿瘤,且死亡率高。Kashiwada 等[14]提取和分离新疆紫草干燥根得到了含水丙酮提取物 1 ~ 9,其中化合物 2 ~ 4 在急性感染 Hg 细胞中表现出较好的抗 HIV 活性,EC50分别为 2.8、4.0 和 1.5 μg/ml,治疗指数为 19.6、12.5 和 333,进一步研究发现,化合物 2 ~ 4 中咖啡酸四聚体钠盐和钾盐具有较好的抗 HIV 活性。有研究发现从软紫草根中分离得到的一种二氢苯骈呋喃类物质抗 HIV 的作用强度优于曾报道的紫草咖啡酸四聚体[15]。
细胞上的辅助受体水平是 HIV-1 进入和随后感染的关键因素。外周血单个核细胞中CKR5 水平降低或缺失的患者对 HIV-1 感染具有抗性[16]。此外,血液中巨噬细胞炎性蛋白1α(CCL3)和1β(CCL4)的高水平表达提供了对抗 HIV-1 感染的保护作用[17]。Chen 等[18]研究了紫草素对趋化因子受体功能和 HIV-1 复制的影响,结果显示,紫草素在纳摩尔浓度下能够抑制单核细胞的趋化性以及对多种趋化因子反应的钙通量。研究还发现,在巨噬细胞中,紫草素还能显著下调 HIV-1 辅助受体 CCR5 的表面表达和 mRNA 水平。此外,紫草素还能抑制人外周血单个核细胞中多药耐药病毒株和儿科临床 HIV 分离株的复制,IC50为 96 ~ 366 nmol/L,紫草素还有效抑制单核细胞/巨噬细胞中 HIV Ba-L 分离株的复制,IC50为 470 nmol/L,这些结果表明紫草素发挥抗 HIV-1 作用与其干扰趋化因子受体的表达和功能有关。因此,紫草素作为天然存在的低分子量泛趋化因子受体抑制剂,构成了新型抗 HIV 治疗剂的开发基础。
紫草的另一有效成分紫草多糖具有增强特异性和非特异性免疫的作用,如可提高免疫低下小鼠的脏器指数、吞噬指数和血清溶血素水平,改善免疫抑制小鼠低下的脾淋巴细胞增殖反应等[19-20]。徐杭民等[21]发现“艾滋II 号”(由黄芪、紫草、甘草等制成)在适当浓度下,体外能使 NK 细胞对 YAC-1 肿瘤靶细胞的杀伤率从 27.3% 提高至 66.4%,体内从 26.4% 提高至 62.7%。此外,该复方对 ConA 激活的小鼠胸腺前 T 细胞增殖提高 121%,对脾脏混合淋巴细胞的转化反应比对照组高 180%,对 ConA 激活的小鼠功能性 T 细胞增殖提高 137%,这些结果说明紫草也能通过调节机体的免疫作用发挥抗 HIV 作用。
2.5 阻止轮状病毒性腹泻
轮状病毒(rotavirus,RV)是导致婴儿和幼儿腹泻的主要病原体之一。分泌性腹泻是一种全球性的健康负担,会导致儿童死亡。Jing 等[22]通过荧光淬灭实验证明紫草素可以抑制 TMEM16A 氯通道的活性,IC50为 6.5 μmol/L。短路电流分析实验结果表明,紫草素可以剂量依赖地抑制TMEM16A 介导的Cl-电流,IC50值为 1.5 μmol/L。短路电流分析实验结果还表明,紫草素在小鼠结肠上皮细胞可以剂量依赖地抑制胆碱能激动剂卡巴胆碱诱导的 Cl-电流,但是对细胞质中 Ca2+浓度及其他主要肠细胞氯离子通道电导调节因子没有明显影响。紫草可以抑制小鼠结肠上皮细胞基底外侧膜K+通道活性,而不影响 Na+/K+ATP 酶活性。此外,紫草素在新生小鼠轮状病毒腹泻模型中显著延缓小鼠肠道蠕动并减少粪便含水量,而不影响体内病毒感染过程。该研究表明,紫草素可抑制肠上皮细胞钙激活的氯离子通道,其抑制作用部分是通过抑制基底外侧的 K+通道活性,紫草素可能作为治疗轮状病毒分泌性腹泻的候选物之一。
2.6 抗肝炎病毒作用
2.6.1 抗甲型肝炎病毒 甲型肝炎病毒(hepatitis A virus,HAV)可引起甲型肝炎。张有明[23]将紫草加入茵陈蒿汤自拟茵板紫垂汤来治疗甲肝 80 例,痊愈 78 例,总有效率高达 97.5%,治疗天数最短者 7 天,最长者 28 天。于宝存[24]将紫草入煎剂,控制用量,可以预防急性甲型病毒性肝炎病毒接触者或流行期间的健康人饮用,可预防甲肝的流行,且未见不良反应。
2.6.2 抗乙型肝炎病毒 乙型肝炎病毒(hepatitis B virus,HBV)可引起急性和慢性乙型肝炎,继而引发肝脏病变。孔炳耀[25]以广州中医药大学李仲守教授的“五草汤”(方中含紫草 10 g)为基本方治疗慢迁肝 25 例,主要表现为肝炎病史半年以上,肝区疼痛,乏力,ALT 轻、中度升高,每日一剂,30 天为一疗程,结果基本治愈 9 例、有效12 例、无效 4 例,总有效率达 84%。后其在“五草汤”基础上用紫草 20 g,并配用黄芪等健脾益气药可治疗乙肝表面抗原(HBsAg)阳性的患者,42 例患者经一疗程后,HBsAg 转阴的有 29 例(69.05%),乙型肝炎表面抗体(HBsAg)阳转的有 31 例(73.8%)。孙志义等[26]对 32 例乙型肝炎患者以紫草为主进行治疗,取得了良好效果。2014 年,Moon 等[27]报道乙酰紫草素(acetylshikonin,ASK)能诱导稳定表达 HBV X 蛋白(HBV X protein,HBX)的肝癌细胞 Hep3B-HBX 的凋亡,且呈剂量依赖性;进一步研究发现 ASK 诱导 Hep3B-HBX 凋亡依赖于 Nur77 蛋白的上调以及 JNK 的激活;此外,ASK 还能通过活性氧的产生来诱导内质网应激(如增加 ER 应激蛋白 Bip 的表达水平、增强细胞内蛋白的泛素化水平),且实验结果证明 JNK 的激活而不是 Nur77 蛋白的上调对 ASK 诱导 ER 应激是必要的;因此,ASK 诱导 ER 应激是使表达 HBX 蛋白的肝癌细胞发生凋亡的先决条件。
2.6.3 抗丙型肝炎病毒 丙型肝炎病毒(hepatitis C virus,HCV)可引起丙型肝炎。Li 等[28]测试了不同新疆紫草提取物的抗 HCV 的活性,发现紫草素抗病毒作用效果最明显,其 EC50(25 ng/ml)远低于阳性对照药利巴韦林(2.6 μg/ml)。廖炜波等[29]发现用乙酰紫草素溶液作用于感染 HCV 的 Huh7 细胞能显著抑制 HCV RNA 和 HCV core 蛋白的表达,且能降低自噬标志因子 LC3 mRNA 和蛋白的表达水平,提示乙酰紫草素可通过调节细胞自噬途径影响 HCV 病毒的复制。
以上结果表明紫草对甲肝、乙肝和丙肝病毒均有较好抑制作用,但其作用机制尚不十分明确,有待进一步研究。
临床上慢性肝炎的治疗除了抗病毒治疗外,还包括抗炎保肝和对症治疗,从而延长患者的生存期。紫草在抗炎保肝方面也发挥了重要作用。邵鸿娥等[30]证实紫草可有效地防止四氯化碳引起血清 SALT 活力和血清胆红素含量异常,从而提示紫草具有抗四氯化碳所致动物肝细胞损伤,达到保护肝脏,恢复肝功能的作用。买尔旦•马合木提等[31]研究了新疆紫草提取物对 D 氨基-半乳糖致小鼠急性肝损伤的保护作用,能显著地抑制小鼠 ALT、AST、MDA 的升高以及 SOD、GSH-Px 的降低,减轻肝脏受损程度,表明新疆紫草提取物可能通过清除自由基、保护细胞膜和脂质过氧化而发挥肝细胞保护作用。Guo 等[32]证明紫草素可通过抑制氧化应激和炎症来改善对乙酰氨基酚造成的肝损伤。
2.7 抗肠道病毒作用
肠道病毒 71 型(enterovirus 71,EV71)是手足口病的主要致病因子,特别是在婴儿和 4 岁以下儿童中。Zhang等[33]发现紫草素酯衍生物 PMM-034 在横纹肌肉瘤(RD)细胞中显示出较好的抗EV71 的活性。通过噬斑减少试验测定细胞上清病毒滴度,结果证明 PMM-034 可显著抑制 EV71 的复制,且抑制作用具有剂量和时间依赖性,IC50为2.31 μg/ml。RT-qPCR 和 Western blot 实验结果表明 PMM-034 处理的细胞中 EV71 VP1 mRNA 和蛋白质水平均显著降低。此外,PMM-034 作用后,细胞中 IL-1β、IL-6、IL-8 和TNF-α 的 mRNA 表达水平显著降低,磷酸化p65蛋白表达水平也降低,表明 PMM-034 可以抑制 RD 细胞中促炎细胞因子的表达。因此,PMM-034 是具有进一步开发价值的 EV71 抑制剂候选物。
2.8 抗腺病毒作用
腺病毒(adenovirus,AdV)感染可产生呼吸道、胃肠道、尿道和膀胱、眼、肝脏相关疾病,例如咽炎、肺炎、胃肠炎等。Gao 等[34]报道了紫草素对 AdV3 的抗病毒作用。研究表明,紫草素可以剂量依赖性抑制 AdV3 的复制,对病毒抑制率为 24% ~ 69%;进一步发现紫草素处理组中 AdV3 的六邻体蛋白表达显著降低,同时 HeLa 细胞凋亡率随着药物浓度的增加也显著降低。这些结果表明紫草素发挥抗 AdV3 作用可能与其抑制细胞凋亡以及病毒六邻体蛋白表达有关。
3 抗病毒作用机制
3.1 直接抗病毒作用
紫草液与 HSV 病毒液混合,可以直接灭活 HSV-II 病毒;紫草素酯衍生物 PMM-034 可以通过与流感病毒神经氨酸酶结合来抑制病毒的复制;左旋紫草素对副流感病毒具有明显的剂量依赖性的直接杀灭作用。
3.2 间接抗病毒作用
一方面紫草通过调控相关宿主蛋白或信号通路间接发挥抗病毒作用或者改善病毒引起的疾病症状,如PMM-034 除直接靶向流感病毒神经氨酸酶以外,还可以抑制流感病毒引起的细胞凋亡以及促炎细胞因子 TNF-α 和 IL-8 的表达;在抗 EV71 研究中,PMM-034 能通过抑制NF-κB/p65 的磷酸化水平进而抑制EV71 病毒引起促炎细胞因子 IL-1β、IL-6、IL-8 和 TNF-α 的表达;紫草素对轮状病毒感染过程并没有直接影响,而是通过抑制钙离子激活的氯离子通道来延缓小鼠肠道蠕动并减少粪便含水量以达到治疗轮状病毒性腹泻目的。
另一方面,紫草可以通过调节宿主免疫来发挥抗病毒作用,如在抗 HIV 研究中发现,紫草可增强 T 细胞、NK 细胞的活性,提高机体免疫力。
4 结语
病毒引起的传染病因其传染性强,传播快,感染造成的后果严重。除疫苗外,抗病毒药物在治疗病毒性疾病中发挥了重要的作用,同时抗病毒治疗也面临着严峻的挑战,如面临耐药、新病毒的出现等问题,因此抗病毒新药的研发仍然任重道远。我国对中药研究长达数千年,中药防治病毒产生的疾病也早有记载,新疆紫草作为中药有它自己得天独厚的优点。新疆紫草来源广泛,可以抑制多种病毒,从紫草中提取有效成分作为新型抗病毒药物具有极大研究价值,但是由于单体化合物提取工艺还在优化中,获得数量有限,因此研究过程中要避免不必要的浪费。另外紫草及其有效成分抗病毒的具体作用机制并未研究透彻,还需要进一步深入研究。
[1] Song YH, Sun H, Zhang AH, et al. Advances in studies on Arnebiae Radix. Acta Chin Med Pharmacol, 2013, 41(4):123-125. (in Chinese)
宋艳华, 孙晖, 张爱华, 等. 紫草的研究进展. 中医药学报, 2013, 41(4):123-125.
[2] Liu H, Chen HS. Advances on chemical constituents and pharmacological actions of Arnebiae Radix. J Pharm Pract, 2009, 27(3):161-164. (in Chinese)
刘虹, 陈海生. 新疆紫草化学成分与药理作用的研究进展. 药学实践杂志, 2009, 27(3):161-164.
[3] Xu XG, Wang BZ, Sun ZR, et al. Chemical constituents from root of Arnebia euchroma (Royle) Johnst. J Jilin Univ (Section Ed), 2010, 48(2):319-322. (in Chinese)
徐新刚, 王宝珍, 孙志蓉, 等. 新疆紫草的主要化学成分. 吉林大学学报(理学版), 2010, 48(2):319-322.
[4] Fu HY, Deng YH, Feng Y, et al. Studies of anti-human papillomavirus activity of Herba Arnebia. Traditional Chin Drug Res Clin Pharmacol, 2005, 16(4):259-260. (in Chinese)
符惠燕, 邓远辉, 冯怡, 等. 紫草抗人乳头瘤病毒作用的研究. 中药新药与临床药理, 2005, 16(4):259-260.
[5] Deng YH, Wang HL, Han L. Isolation, purification and biological activities of Arnebia euchroma Glycosaminoglycans. J Chin Med Mater, 2008, 31(5):753-756. (in Chinese)
邓远辉, 王海兰, 韩凌. 紫草多糖的分离纯化及生物活性研究. 中药材, 2008, 31(5):753-756.
[6] Shu HY, Zhou LB, Wang ST, et al. Effect of shikonin on cell proliferation and apoptosis of cervical cancer CaSki cells with HPV16. Guiding J Traditional Chin Med Pharm, 2019, 25(1):64-67. (in Chinese)
舒海燕, 周丽彬, 王舒甜, 等. 紫草素对感染HPV16的宫颈癌Caski细胞增殖与凋亡的影响. 中医药导报, 2019, 25(1):64-67.
[7] Chen TL, Wang DL, Zhang X, et al. The effects of decoction of gromwell root on expression of Bcl-2, survivin and VEGF from skin lesions from the patients with genital warts. J Guangdong Pharm Coll, 2010, 26(4):426-429. (in Chinese)
陈天雷, 王丹丽, 张弦, 等. 紫草对尖锐湿疣患者皮损中Bcl-2、survivin及VEGF表达的影响. 广东药学院报, 2010, 26(4):426-429.
[8] Xie CC, Fan RQ, Zhu YT, et al. Experimental study on shikonin against type II herpes simplex virus. South China J Dermato Venereol, 2000, 7(3):4-6. (in Chinese)
谢长才, 范瑞强, 朱宇同, 等. 紫草抗II型单纯疱疹病毒的实验研究. 岭南皮肤性病科杂志, 2000, 7(3):4-6.
[9] Jiang AL, Jiang SY. Treatment of 132 cases of herpes zoster with zinc oil in Zicao. J Jiangxi Coll Traditional Chin Med, 2002, 14(4):48. (in Chinese)
江爱龙, 江松员. 紫草地锌油治疗带状疱疹132例. 江西中医学院学报, 2002,14(4):48.
[10] Liu GS, Jiang JY, Chen HS, et al. The inhibitory activity of Chinese medicinal plants on influenza virus. Acta Microbiology Sina, 1960, 8(2):164-170. (in Chinese)
刘国声, 蒋景仪, 陈鸿珊, 等. 中药的抗流感病毒作用. 微生物学报, 1960, 8(2):164-170.
[11] Tian L, Wang Z, Wu H, et al. Evaluation of the anti-neuraminidase activity of the traditional Chinese medicines and determination of the anti-influenza A virus effects of the neuraminidase inhibitory TCMs in vitro and in vivo. J Ethnopharmacol, 2011, 137(1):534-542.
[12] Zhang Y, Han H, Qiu H, et al. Antiviral activity of a synthesized
shikonin ester against inflfluenza A (H1N1) virus and insights into its mechanism. Biomed Pharmacother, 2017, 93:636-645.
[13] Luo XY, Li MH, Lun YZ, et al. The effect of L- shikonin against parainfluenza virus. Chin Traditional Herbal Drugs, 2005, 36(4):568- 571. (in Chinese)
罗学娅, 李明辉, 伦永志, 等. 左旋紫草素抗副流感病毒作用. 中草药, 2005, 36(4):568-571.
[14] Kashiwada Y, Nishizawa M, Yamaagishi T, et al. Anti-AIDS agents, 18. Sodium and potassium salts of caffeic acid tetramers from Arnebia euchroma as anti-HIV agents. J Nat Prod, 1995, 58(3):392-400.
[15] Xinjiang Medical University. A water-soluble component of soft comfrey against HIV and its extract: China, 200510129949. 2007-06- 20. (in Chinese)
新疆医科大学. 软紫草抗HIV的一种水溶性成分及其提取物: 中国, 200510129949. 2007-06-20.
[16] Liu R, Paxton WA, Choe S, et al. Homozygous defect in HIV-1 coreceptor accounts for resistance of some multiply-exposed individuals to HIV-1 infection. Cell, 1996, 86(3):367-377.
[17] Cocchi F, DeVico AL, Yarchoan R, et al. Higher macrophage inflammatory protein (MIP)-1alpha and MIP-1beta levels from CD8 T cells are associated with asymptomatic HIV-1 infection. Proc Natl Acad Sci U S A, 2000, 97(25):13812-13817.
[18] Chen X, Yang L, Zhang N, et al. Shikonin, a component of Chinese herbal medicine, inhibits chemokine receptor function and suppresses human immunodeficiency virus type 1. Antimicrob Agents Chemother, 2003, 47(9):2810-2816.
[19] Li Q, Chen HY, Lian YJ, et al. Effects of polysaccharides from Arnebia euchroma on immune functions of mice. Chin J Hosp Pharm, 2011, 31(10):829-832. (in Chinese)
李倩, 陈韩英, 廉宜君, 等. 新疆软紫草多糖对小鼠免疫功能的影响. 中国医院药学杂志, 2011, 31(10):829-832.
[20] Chen XN, Ruan H. Studies on the immunoregulation and anti-tumor activity of polysaccharide from Arnebia root. J Zhejiang Univ (Sci Ed), 2008, 35(6):674-677. (in Chinese)
陈祥娜, 阮红. 紫草多糖的免疫调节和肿瘤抑制活性研究. 浙江大学学报(理学版), 2008, 35(6):674-677.
[21] Xu HM, Wang XA, Xie ZH, et al. Immunopharmacological effects of “AIDS II” extracted from Chinese herbs. Pharmacolo Clin Chin Meteria Med, 1995, (4):21-24. (in Chinese)
徐杭民, 王绪鳌, 谢志慧, 等. 中药复方“艾滋Ⅱ号”的免疫药理作用. 中药药理与临床, 1995, (4):21-24.
[22] Jiang Y, Yu B, Yang H, et al. Shikonin inhibits Intestinal calcium-activated chloride channels and prevents rotaviral diarrhea. Front Pharmacol, 2016, 7:270.
[23] Zhang YM. Treatment of hepatitis A with Zicao. J Traditional Chin Med, 1996, 37(4):197-198. (in Chinese)
张有明. 紫草治疗甲型肝炎. 中医杂志, 1996, 37(4):197-198.
[24] Yu BC. Medicinal Zicao can be used to prevent hepatitis A. J Traditional Chin Med, 1996, 37(4):198. (in Chinese)
于宝存. 紫草可用于预防甲型肝炎. 中医杂志, 1996, 37(4):198.
[25] Kong BY. Zicao has the functions of regulating endocrine, soothe the nerves, and making HBsAg negative. J Traditional Chin Med, 1996, 37(4):197. (in Chinese)
孔炳耀. 紫草有调节内分泌、安神、使澳抗阴转的作用. 中医杂志, 1996, 37(4):197.
[26] Sun ZY, Zhang DH, Wang WH, et al. Overview of the composition, pharmacology and clinical application of Zicao. Shandong Med Industry, 1998, 17(3):30-31. (in Chinese)
孙志义, 张东华, 王文华, 等. 紫草的成分、药理及临床应用研究概况. 山东医药工业, 1998, 17(3):30-31.
[27] Moon J, Koh SS, Malilas W, et al. Acetylshikonin induced apoptosis of hepatitis B virus X protein expression human hepatocellular carcinoma cells via endoplasmic reticulum stress. Eur J Pharmacol, 2014, 735:132-140.
[28] Li HM, Tang YL, Zhang ZH, et al. Compounds from Arnebia euchroma and their related anti-HCV and antibacterial activities. Planta Med, 2012, 78(1):39-45.
[29] Liao WB, Lu HQ, Liang H, et al. Research on the effects of acetyl shikonin on HCV replication and its mechanism (s). Intern Med China, 2019, 14(2):137-141. (in Chinese)
廖炜波, 鲁弘骎, 梁浩, 等. 乙酰紫草素对HCV复制的影响及其作用机制研究. 内科, 2019, 14(2):137-141.
[30] Shao HE, Li LF, Cui JY. Protective effect of comfrey Zicao on experimental liver injury. Res Traditional Chin Med, 1995, (3):61-62. (in Chinese)
邵鸿娥, 李丽芬, 崔建亚. 紫草对实验性肝损伤的保护作用. 中医药研究, 1995, (3):61-62.
[31] Maierdan Mahemuti, Liu Y, Nijiti Rehemu. Protective effect of Arnebia euchroma (Royle) Johst extract on acute liver injury induced by D-galactosamine in mice. China J Chin Meteria Med, 2006, 31(19):1646-1649. (in Chinese)
买尔旦•马合木提, 刘燕, 尼加提•热合木. 新疆紫草提取物对D-氨基半乳糖致小鼠急性肝损伤的保护作用. 中国中药杂志, 2006, 31(19):1646-1649.
[32] Guo H, Sun J, Li D, et al. Shikonin attenuates acetaminophen-induced acute liver injury via inhibition of oxidative stress and inflflammation. Biomed Pharmacother, 2019, 112:108704.
[33] Zhang Y, Han H, Sun L, et al. Antiviral activity of shikonin ester derivative PMM-034 against enterovirus 71 in vitro. Braz J Med Biol Res, 2017, 50(10):e6586.
[34] Gao H, Liu L, Qu ZY, et al. Anti-adenovirus activities of shikonin, a component of Chinese herbal medicine in vitro. Biol Pharm Bull, 2011, 34(2):197-202.
国家自然科学基金(81803592);“重大新药创制”国家科技重大专项(2018ZX09101003-003-003)
154007 黑龙江,佳木斯大学药学院药剂室(徐景怡、于莲);100050 北京,中国医学科学院北京协和医学院医药生物技术研究所抗感染药物研究北京市重点实验室(吴硕、李玉环)
吴硕,Email:wushuoimb@126.com;于莲,Email:jdyulian@ 163.com
2019-06-19
10.3969/j.issn.1673-713X.2019.06.013
