Decorin提升小鼠脾脏细胞对乳腺癌细胞系4T1的免疫响应性
2019-12-23赵慧强刘超胡泽斌戴诗云王华
赵慧强,刘超,胡泽斌,戴诗云,王华
论著
Decorin提升小鼠脾脏细胞对乳腺癌细胞系4T1的免疫响应性
赵慧强,刘超,胡泽斌,戴诗云,王华
评价高表达核心蛋白聚糖(Decorin)的小鼠乳腺癌细胞系 4T1 对正常小鼠脾细胞的免疫激活效应,明确 Decorin 对抗肿瘤免疫的调节作用。
采用携带Decorin 基因的复制缺陷型重组腺病毒 Ad.DCN 感染小鼠乳腺癌细胞系 4T1。与小鼠脾细胞共培养 3 d 后,通过流式细胞术检测小鼠脾细胞的 CD4+T 细胞、CD8+T 细胞、T 记忆细胞(Tm)和T 调节细胞(Treg)的百分比;利用实时定量 PCR(qPCR)技术检测 Th1 类细胞因子IL-2、IL-12、TNF-α和IFN-γ 的表达,Th2 类细胞因子IL-4、IL-6、IL-10 和转化生长因子 β(TGF-β)的表达,以及与杀伤相关基因穿孔素与颗粒酶 B 的表达。
与小鼠乳腺癌细胞系 4T1 共培养后,小鼠脾细胞 CD4+T 淋巴细胞、CD8+T 淋巴细胞、Treg 细胞比例无明显改变,但Tm 细胞比例显著升高;同时,细胞因子、穿孔素和颗粒酶 B 表达下调。但是,病毒感染的 4T1 细胞,特别是 Ad.DCN 感染的 4T1 细胞可显著抑制 Treg 细胞,并部分逆转细胞因子表达的下调。
Decorin 高表达可增强正常小鼠脾脏细胞对乳腺癌细胞系 4T1 的免疫响应性,从而激活抗肿瘤免疫反应。
核心蛋白聚糖; 乳腺肿瘤; 基因,MHC II 类; 脾细胞; 4T1 细胞系
乳腺癌在世界范围内的发病率居于女性恶性肿瘤第一位,约占女性恶性肿瘤的 25%;同时,乳腺癌的死亡率约占肿瘤总死亡率的 15%[1],高居女性癌症死亡率的第 5 位。当前肿瘤生物治疗发展迅速,其通过激活机体内在免疫功能达到增强机体对肿瘤细胞的免疫应答,并使宿主对肿瘤细胞产生长期抑制效应。基因治疗作为肿瘤生物治疗的前沿技术,主要利用多种病毒或非病毒载体,将目的基因导入靶细胞,实现目的基因的靶向和高效表达,从而治疗疾病。
核心蛋白聚糖(Decorin,DCN)是重要的肿瘤抑制分子,本课题组及其他研究团队的研究结果证实,Decorin 对多种肿瘤的生长和转移有很好的治疗作用[2-10],其主要机制包括抑制wnt/β-catenin、Met、血管内皮生长因子(vascular endothelial growth factor,VEGF)等多条肿瘤生长和转移信号通路等。但是,其对乳腺癌及其转移的治疗作用及机制,特别是抗肿瘤免疫激活机制尚未完全阐明。Decorin是TGF-β 的天然抑制分子,而 TGF-β 在诱导肿瘤免疫耐受过程中发挥重要作用,在肿瘤转移患者的外周血和肿瘤微环境中均可检测到大量 TGF-β 的表达。那么,作为TGF-β 的天然抑制分子,Decorin 是否具有激活机体免疫的作用呢?本研究通过体外实验,对 Decorin 调节乳腺癌细胞系 4T1 激活小鼠脾脏细胞免疫的作用进行进一步探讨。
1 材料与方法
1.1 材料
1.1.1 细胞系、病毒及试剂 4T1 细胞系由军事科学院军事医学研究院提供;重组腺病毒Ad.DCN、Ad.Null 由本室保存;1640 培养基购自美国 Gibco 公司;胎牛血清购自美国 Gemini 公司;反转录试剂盒购自 Genestar 公司;抗小鼠 CD3、CD4、CD8、CD44、CD62L 抗体购自美国 BD 公司;Treg 试剂盒购自美国 eBioscience 公司。
1.1.2 实验动物 BALb/c 小鼠,雌性,4 ~ 6 周龄,购于维通利华公司,饲养于军事医学研究院动物房。
1.2 方法
1.2.1 4T1 细胞系培养扩增 使用含 10% 胎牛血清的 1640 培养基进行培养,取对数生长期的4T1 细胞系,弃培养液,使用 PBS 洗涤后,加入0.05% 胰酶,恒温箱孵育完全消化后加入培养液中和胰酶,细胞悬液离心后弃上清,用培养液重悬,按照 1:3 比例传代培养。
1.2.2 BALb/c 小鼠脾细胞制备 颈椎脱臼处死小鼠,75% 酒精浸泡,于小鼠左下腹下肢与肋下缘之间取脾,持镊轻夹脾脏,注意保证脾脏的完整性,切下的脾脏放入含 PBS 液的平皿中暂存。将获得的脾脏放置在不锈钢网上轻轻研磨,获取细胞悬液,收集细胞悬液离心,用红细胞裂解液裂红,PBS 洗涤 2 次,重悬,计数,备用。
1.2.3 实验分组 实验分为两组,一组测定 CD3、CD4 和 CD8,共 3 块板,每块板为一个样本;另一组测定T 记忆细胞(memory T cell,Tm)、T 调节细胞(Treg)及目的基因,共 9 块板,每 3 块板为一个样本,共计12 块六孔板,每块板均设空白对照孔。
将 4T1 细胞计数,按照每孔 5 × 105的浓度将培养扩增后的细胞铺于六孔板中继续培养。培养 24 h 后,使用 Ad.DCN 和 Ad.Null 病毒感染 4T1 细胞,感染 4 h 后使用环孢霉素作用 2 h,然后更换培养基;感染病毒 24 h 后,每孔加入 5 × 106脾细胞。一组培养 3 d 收集脾细胞,标记 PE-CD3、PerCP-Cy5.5-CD4 和 FITC-CD8a。二组培养 3 d,收集细胞,分别进行如下检测:①提取 RNA,反转录,实时定量 PCR(qPCR)检测 IL-2、IL-4、IL-6、IL-10、IL-12、TNF-α、TGF-β、IFN-γ、穿孔素、颗粒酶 B 表达;②检测 Treg 细胞比例;③检测 Tm 细胞比例。
1.2.4 Tm 细胞比例测定 将收取的细胞离心后弃上清,用 PBS 洗涤 1 次,然后标记抗体。取 PE-CD44、Alexa Fluor488-CD4、APC-CD62L、PerCP-Cy5.5-CD3 抗体各 2 μl 至 100 μl PBS 中混匀,加入到细胞悬液中,4 ℃避光孵育 30 min;孵育结束后离心,再次使用 PBS 洗涤 1 次;500 μl PBS 重悬细胞,上机检测。
1.2.5 Treg 细胞比例测定 将收取的细胞离心,用 PBS 洗涤一次,然后标记抗体。取FITC-CD4 和 APC-CD25 抗体各 0.6 μl加入 50 μl PBS 中混匀,加入到细胞悬液中,4 ℃避光孵育 30 min;孵育结束后加入 PBS 洗涤,离心后加入 stainingbuffer 洗涤,再次离心,加入固定/透化液(按要求1:3 稀释),4 ℃孵育 30 min,孵育完成后离心,加入透化 buffer(用去离子水稀释成 1 ×),离心后再次加入透化buffer,离心。然后每样本加入50 μl PBS(含 1 μl FC 阻断剂),避光 4 ℃孵育15 min,孵育完成后加入 50 μl PBS(含 1 μl PE-Cy7-FoxP3 的抗体)避光 4 ℃孵育 30 min;孵育完成后加入透化buffer,洗涤细胞,离心;最后 300 μl PBS 重悬细胞,上机检测 CD4+CD25+FoxP3+细胞比例。
1.2.6 CD3+、CD4+和 CD8+T 细胞检测 收集淋巴细胞离心,PBS 重悬后再次离心,每管用 50 μl PBS 重悬,并分别加入 1.5、1 和 0.5 μl的 PE-CD3、PerCP-Cy5.5-CD4 和FITC-CD8a,避光孵育半小时;孵育完成后加入 PBS 洗涤 2 次,每样本加入 400 μl的 PBS 重悬,上机检测。
1.2.7 qPCR 检测 配制样本,采用 20 μl体系,每样本 4 复孔。利用实时定量 PCR 仪进行目的基因检测。方法选用相对定量法,荧光试剂选择SYBR 绿色荧光染料,运行模式采用2 h 标准程序,95 ℃ 10 min,95 ℃ 15 s,60 ℃ 60 s,40 个循环。
1.2.8 免疫印迹 收集 4T1.Null 和 4T1.DCN 细胞的蛋白,标记鼠抗人 Decorin 抗体,通过免疫印迹检测 Decorin 蛋白的表达。
1.3 统计学处理
2 结果
2.1 重组腺病毒 Ad.DCN 高效介导 Decorin 蛋白在 4T1 的表达
重组腺病毒 Ad.DCN 以 5000 VPs/细胞感染 4T1 后 48 h,收集细胞,提取蛋白,通过免疫印迹检测 Decorin 蛋白的表达,从图 1 可以看到,重组腺病毒可高效介导 Decorin 蛋白在 4T1 细胞中的表达。
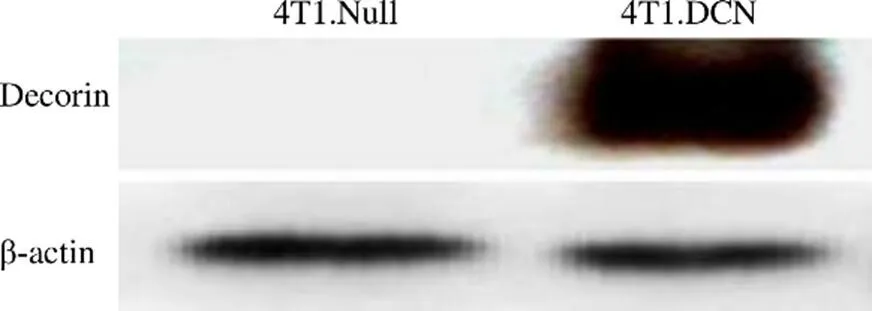
图 1 免疫印迹法检测 Decorin 蛋白表达
Figure 1 The protein expression of Decorin detected by Western blot
2.2 Decorin 高表达的 4T1 细胞对小鼠脾脏 CD4+/CD8+T 淋巴细胞无显著影响
将 4T1、4T1.Null 和 4T1.DCN 细胞与正常小鼠脾脏淋巴细胞共培养 3 d 后,流式细胞术检测小鼠脾脏 T 细胞中 CD4+和 CD8+细胞的比例,结果显示(图 2),4T1 细胞中,Decorin 高表达对小鼠脾脏 CD4+/CD8+T 淋巴细胞的比例无显著影响。
2.3 Decorin 高表达可下调 Treg 细胞比例
Tm 细胞是免疫记忆细胞,在二次免疫应答中起重要作用。流式细胞分析显示,4T1、4T1.Null 和 4T1.DCN 均可以诱导脾脏Tm 细胞比例升高,4T1.Null 和 4T1.DCN与 4T1 之间无统计学差异(图3A)。表明 4T1 可以诱导小鼠脾细胞产生较强的免疫记忆,Decorin 不会进一步增强这种诱导作用。
Treg 细胞是免疫调节细胞,可以保持机体的免疫稳态。流式细胞术分析结果显示,4T1.Null 和4T1.DCN 组 Treg 细胞比例明显下调,与对照组之间具有统计学差异(图3B)。
2.4 Decorin 高表达的 4T1 细胞系可部分逆转细胞因子表达下调
细胞共培养 3 d,收集培养细胞,采用 qPCR 方法检测了脾细胞炎性细胞因子的表达。结果(图 4,图 5)发现,与 4T1 共培养后,脾脏细胞 Th1 和 Th2 细胞因子的表达均降低;4T1.Null 和 4T1.DCN 可以促进 Th2 和部分Th1(IL-2)细胞因子的表达;4T1.DCN 的促进作用更明显。
2.5 4T1.DCN 调节小鼠脾脏细胞杀伤相关基因表达
细胞共培养 3 d,收集培养细胞,采用 qPCR 方法检测了穿孔素和颗粒酶 B 的表达。结果(图 6)显示,4T1 可以抑制这两种杀伤相关基因的表达;4T1.Null 和 4T1.DCN 可以逆转肿瘤细胞的这种抑制作用,恢复脾脏细胞的杀伤功能。
3 讨论
腺病毒是免疫基因治疗的重要载体,在多种肿瘤的治疗中发挥着重要作用。众所周知,TGF-β 在肿瘤的发生、发展和进展过程中具有双重作用。在肿瘤晚期,TGF-β 信号被激活,可以通过多种机制促进肿瘤生长、侵袭和转移[11-14]。Decorin 是 TGF-β信号的天然抑制剂,因此,可以作为治疗晚期和转移癌的潜在研究对象[15]。已经证实Decorin 在各种晚期癌症患者的肿瘤组织中表达下调,而恢复 Decorin 的表达已成为一种潜在的治疗策略[2, 16-19]。
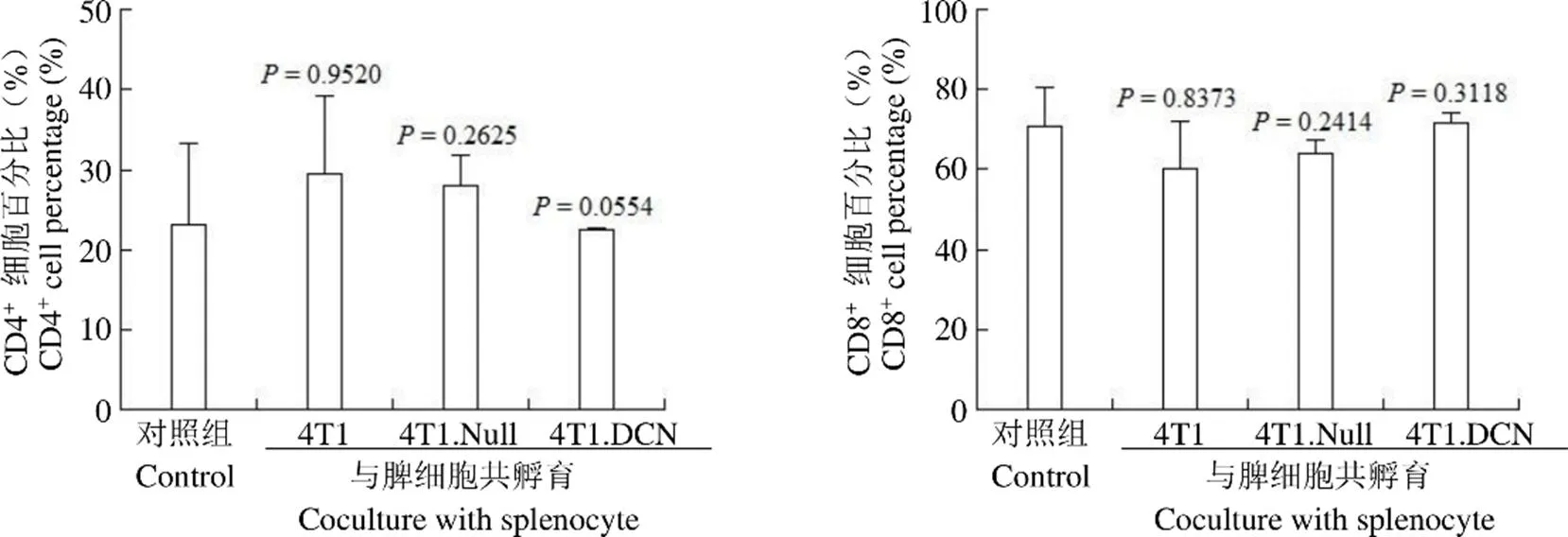
图 2 小鼠脾脏细胞 CD4+和 CD8+细胞比例
Figure 2 The percentage of CD4+and CD8+cells of mouse splenocyte
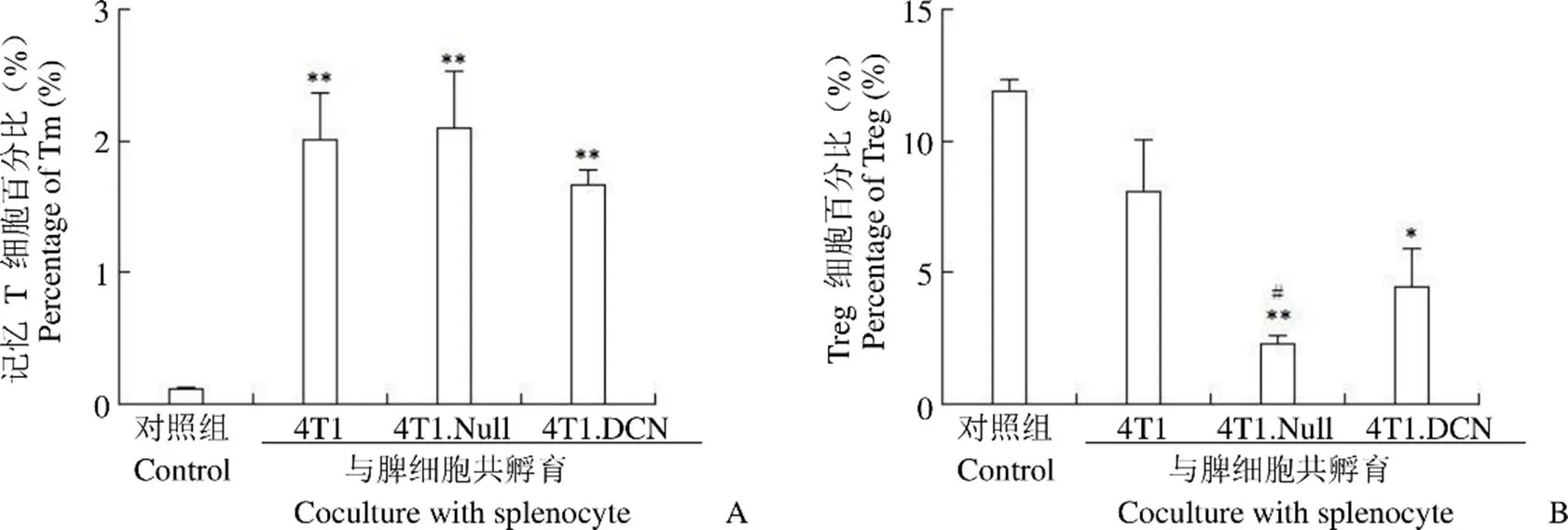
图 3 小鼠脾细胞记忆 T 细胞(A)和 Treg 细胞(B)比例(*P < 0.05,**P < 0.01,vs. control;#P < 0.05,vs. 4T1)
Figure 3 Percentage of Tm (A) and Treg (B) in splenocyte after different stimulations (*< 0.05,**< 0.01, vs. control;#< 0.05, vs. 4T1)
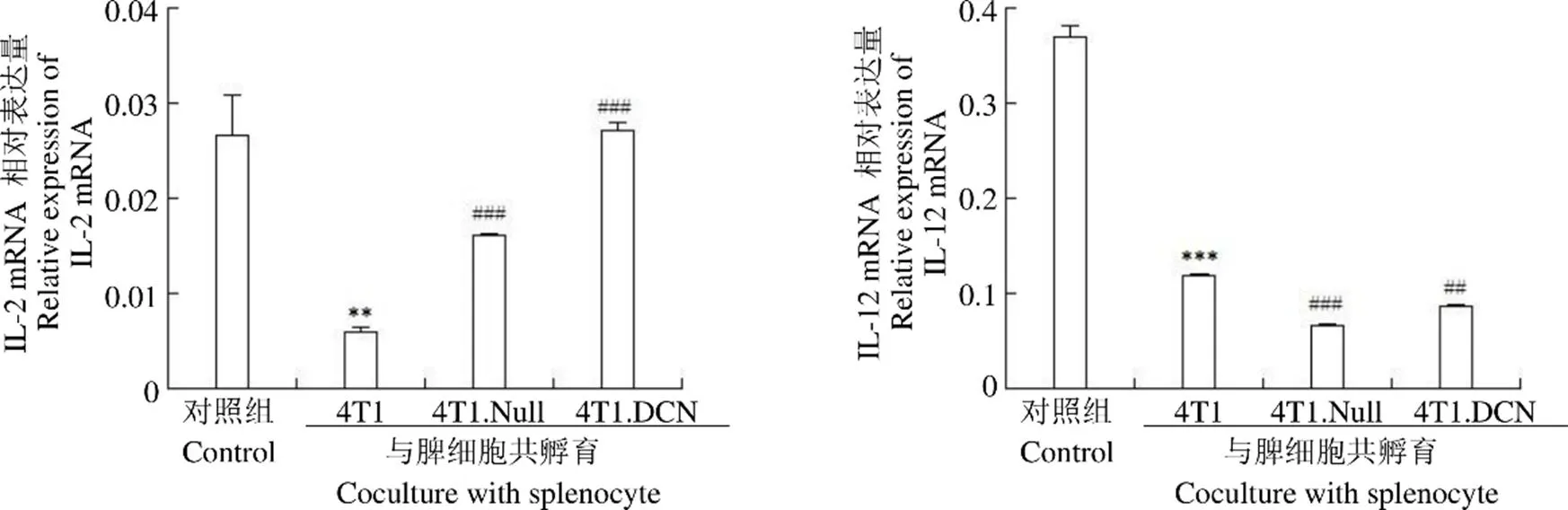
Figure 4 mRNA expressions of Th1 cytokines in splenocyte (**< 0.01,***< 0.001 vs control;#< 0.05,##< 0.01,###< 0.001 vs. 4T1)
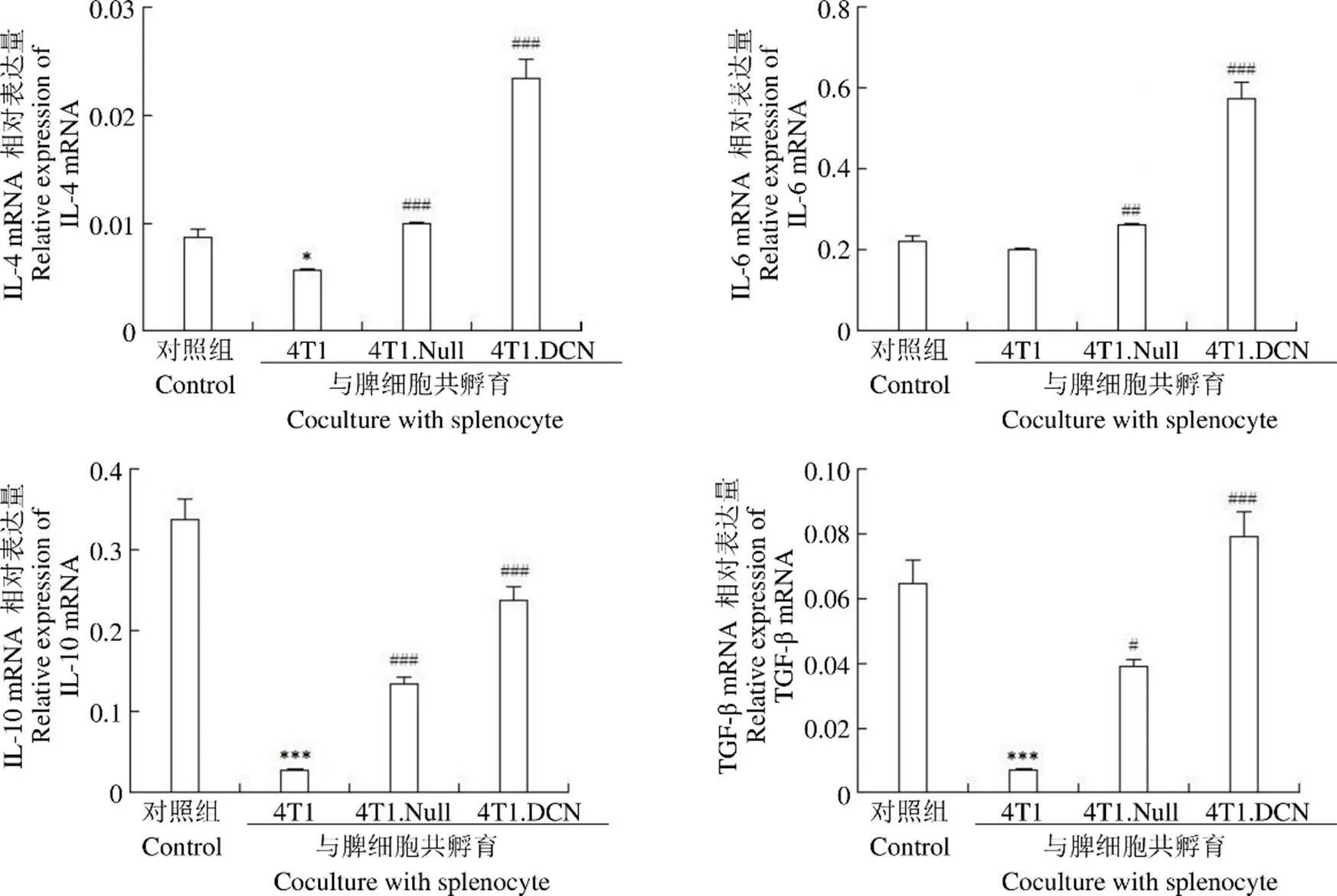
图 5 Th2 类细胞因子表达(*P < 0.05,***P < 0.001 vs control;#P < 0.05,##P < 0.01,###P < 0.001 vs 4T1)
Figure 5 mRNA expressions of Th2 cytokines in splenocyte (*< 0.05,***< 0.001 vs control;#< 0.05,##< 0.01,###< 0.001 vs 4T1)
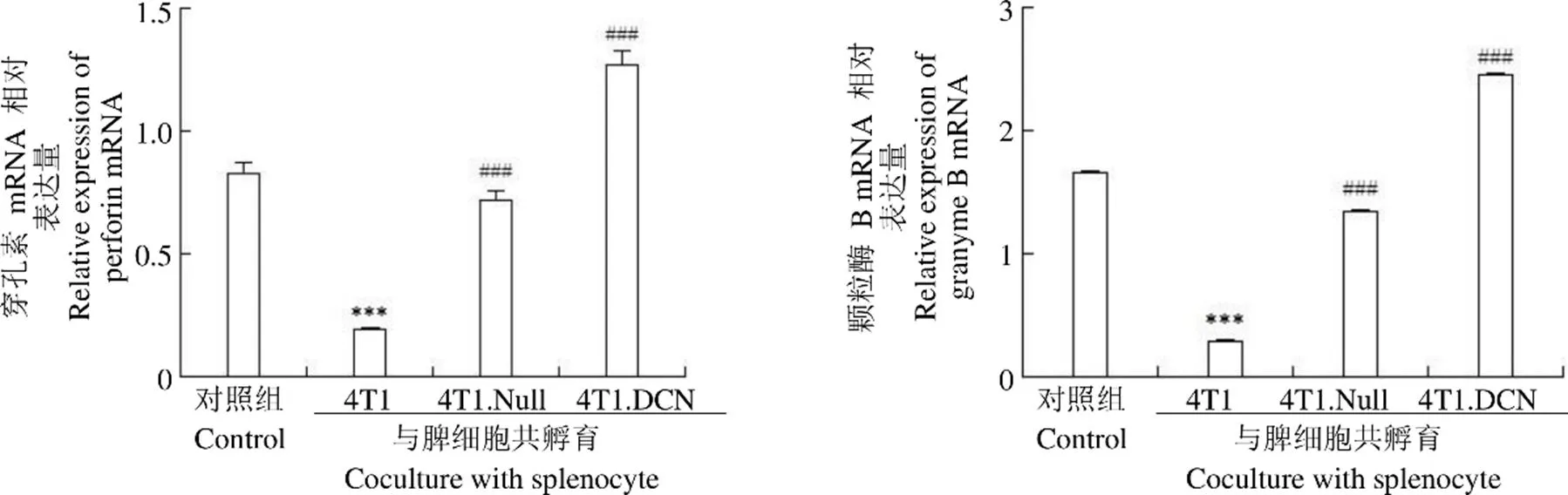
图 6 小鼠脾脏细胞穿孔素和颗粒酶 B 的表达(***P < 0.001 vs control;###P < 0.001 vs 4T1)
Figure 6 The expression of perforin and granzyme B in mouse splenocyte (***< 0.001 vs control;###< 0.001 vs 4T1)
据报道,TGF-β 是调节肿瘤微环境的一个重要分子。高 TGF-β 水平可以抑制效应细胞的成熟,如 Th 细胞、树突状细胞和 NK 细胞,以及诱导 M2 巨噬细胞的极化。此外,TGF-β 也可以调节细胞因子和趋化因子的表达来调节抗肿瘤炎症反应和推动 Th1-Th2 平衡向 Th2 免疫表型转化[20-22]。本研究表明,Decorin 对 Th 细胞因子、穿孔素和颗粒酶 B 均具有调节作用,尤以对 IL-2、IL-10、IFN-γ、TGF-β、穿孔素和颗粒酶的调节作用最为明显。TGF-β mRNA 表达升高,我们推测与Decorin 抑制 TGF-β 信号后的代偿性表达升高有关,但仍需要进一步试验证实。
临床前研究表明,抗 TGF-β 抗体和小分子靶向 TGF-β 信号均可以调节肿瘤微环境,如恢复 CD8+T 淋巴细胞的细胞毒性,增强树突状细胞的抗原呈递能力和减少CD4+CD25+Treg 细胞的百分比[23-26]。本研究中虽然 CD4+T 细胞和 CD8+T 淋巴细胞的比例与对照组相比并无统计学差异,但是 CD4+T 细胞的亚群发生了显著改变,与免疫抑制相关的 Treg 细胞比例明显降低,与免疫记忆相关的 Tm 细胞比例明显升高,表明 Decorin 很好地调节了免疫细胞的抗肿瘤活性。
综上所述,本研究证明了 Decorin 可以增强乳腺癌细胞系对小鼠脾脏细胞的免疫激活作用。其可以通过抑制 Treg 细胞的比例,改善肿瘤微环境的抑制;通过增加 Tm 细胞的比例,增强机体的抗肿瘤免疫;通过调节 Th 细胞因子的表达,达到调节免疫的作用;还可以通过增加穿孔素和颗粒酶的表达,增强免疫细胞对肿瘤细胞的杀伤作用。
[1] Torre LA, Bray F, Siegel RL, et al. Global cancer statistics 2012. CA Cancer J Clin, 2015, 65(2):87-108.
[2] Tralhão JG, Schaefer L, Micegova M, et al. In vivo selective and distant killing of cancer cells using adenovirus-mediated decorin gene transfer. FASEB J, 2003, 17(3):464-456.
[3] Yang Y, Xu W, Neill T, et al. Systemic delivery of an oncolytic adenovirus expressing decorin for the treatment of breast cancer bone metastases. Hum Gene Ther, 2015, 26(12):813-825.
[4] Xu W, Neill T, Yang Y, et al. The systemic delivery of an oncolytic adenovirus expressing decorin inhibits bone metastasis in a mouse model of human prostate cancer. Gene Ther, 2015, 22(3):247-256.
[5] Xu W, Zhang Z, Yang Y, et al. Ad5/48 hexon oncolytic virus expressing sTGFβRIIFc produces reduced hepatic and systemic toxicities and inhibits prostate cancer bone metastases. Mol Ther, 2014, 22(8):1504-1517.
[6] Zhang Z, Hu Z, Gupta J, et al. Intravenous administration of adenoviruses targeting transforming growth factor beta signaling inhibits established bone metastases in 4T1 mouse mammary tumor model in an immunocompetent syngeneic host. Cancer Gene Ther, 2012, 19(9):630-636.
[7] Hu Z, Gupta J, Zhang Z, et al. Systemic delivery of oncolytic adenoviruses targeting transforming growth factor-β inhibits established bone metastasis in a prostate cancer mouse model. Hum Gene Ther, 2012, 23(8):871-882.
[8] Hu Z, Zhang Z, Guise T, et al. Systemic delivery of an oncolytic adenovirus expressing soluble transforming growth factor-β receptor II-Fc fusion protein can inhibit breast cancer bone metastasis in a mouse model. Hum Gene Ther, 2010, 21(11):1623-1629.
[9] Zhang Z, Krimmel J, Zhang Z, et al. Systemic delivery of a novel liver-detargeted oncolytic adenovirus causes reduced liver toxicity but maintains the antitumor response in a breast cancer bone metastasis model. Hum Gene Ther, 2011, 22(9):1137-1142.
[10] Zhao H, Wang H, Kong F, et al. Oncolytic adenovirus, rAd.DCN, inhibits breast tumor growth and lung metastasis in an immune-competent orthotopic xenograft model. Hum Gene Ther, 2019, 30(2):197-210.
[11] Caja F, Vannucci L. TGFbeta: A player on multiple fronts in the tumor microenvironment. J Immunotoxicol, 2015, 12(3):300-307.
[12] Zhu H, Luo H, Shen Z, et al. Transforming growth factor-β1 in carcinogenesis, progression, and therapy in cervical cancer. Tumour Biol, 2016, 37(6):7075-7083.
[13] Moustakas A, Heldin CH. Mechanisms of TGFβ-induced epithelial-mesenchymal transition. J Clin Med, 2016, 5(7):E63.
[14] Tirado-Rodriguez B, Ortega E, Segura-Medina P, et al. TGF-β: an important mediator of allergic disease and a molecule with dual activity in cancer development. J Immunol Res, 2014, 2014:318481.
[15] Border WA, Noble NA, Yamamoto T, et al. Natural inhibitor of transforming growth factor-beta protects against scarring in experimental kidney disease. Nature, 1992, 360(6402):361-364.
[16] Edwards IJ. Proteoglycans in prostate cancer. Nat Rev Urol, 2012, 9(4):196-206.
[17] Nash MA, Deavers MT, Freedman RS. The expression of decorin in human ovarian tumors. Clin Cancer Res, 2002, 8(6):1754-1760.
[18] Troup S, Njue C, Kliewer EV, et al. Reduced expression of the small leucine-rich proteoglycans, lumican, and decorin is associated with poor outcome in node-negative invasive breast cancer. Clin Cancer Res, 2003, 9(1):207-214.
[19] Boström P, Sainio A, Eigėlienė N, et al. Human metaplastic breast carcinoma and decorin. Cancer Microenviron, 2017, 10(1-3):39-48.
[20] Flavell RA, Sanjabi S, Wrzesinski SH, et al. The polarization ofimmune cells in the tumour environment by TGFbeta. Nat Rev Immunol, 2010, 10(8):554-567.
[21] Marcoe JP, Lim JR, Schaubert KL, et al. TGF-β is responsible for NK cell immaturity during ontogeny and increased susceptibility to infection during mouse infancy. Nat Immunol, 2012, 13(9):843-850.
[22] Liu S, Chen S, Zeng J. TGF-β signaling: a complex role in tumorigenesis (review). Mol Med Rep, 2018, 17(1):699-704.
[23] Tran TT, Uhl M, Ma JY, et al. Inhibiting TGF-beta signaling restores immune surveillance in the SMA-560 glioma model. Neuro Oncol, 2007, 9(3):259-270.
[24] Tanaka H, Shinto O, Yashiro M, et al. Transforming growth factor β signaling inhibitor, SB-431542, induces maturation of dendritic cells and enhances anti-tumor activity. Oncol Rep, 2010, 24(6):1637-1643.
[25] Liu VC, Wong LY, Jang T, et al. Tumor evasion of the immune system by converting CD4+CD25-T cells into CD4+CD25+T regulatory cells: role of tumor-derived TGF-beta. J Immunol, 2007, 178(5):2883-2892.
[26] Bhome R, Al Saihati HA, Goh RW, et al. Translational aspects in targeting the stromal tumour microenvironment: from bench to bedside. New Horiz Transl Med, 2016, 3(1):9-21.
Decorin promotes the immune response of mouse splenocytes in response to breast cancer cell line 4T1
ZHAO Hui-qiang, LIU Chao, HU Ze-bin, DAI Shi-yun, WANG Hua
We aim to evaluate the immune activation effect of breast cancer cell line 4T1 with Decorin overexpression on the mouse splenocytes, and thus identify the immunological regulation of Decorin on anti-tumor immunity.
Mouse breast cancer cell line 4T1 was infected by adenovirus expressing Decorin, and then cocultured with mouse splenocytes for 3 days. By FACS analysis, the percentage of CD4+T cells, CD8+T cells, memory T cell (Tm) and Treg were detected. Real-time PCR was used to detect the mRNA expression of Th1 cytokines IL-2, IL-12, TNF-α and IFN-γ, Th2 cytokines IL-4, IL-6, IL-10 and TGF-β, and cytotoxic related genes perforin and granzyme B, after coculture with 4T1 wild type cells, 4T1.Null (adenovirus infection conrtol) and 4T1.DCN (with Decorin overexpression).
Though the percentage of CD4+T, CD8+T and Treg cells were not significantly changed in splenocytes cocultured with 4T1 wild type cells, the subsets of Tm were increased.Meanwhile, themRNA expression of cytokines, perforin and granzyme B were decreased in the splenocytes coculture with 4T1 wild type cells. However, in the 4T1.DCN and 4T1.Null group, the percentage of Treg were decreased, and the suppressed expression of Th1 and Th2 related cytokinesas well as perforin and granzyme B were partly reversed as compared with the 4T1 wild type group. 4T1-DCN group exerted more significant effect than 4T1.Null group.
Decorin may positively regulate the immune response of splenocytes upon stimulation by breast cancer cell line 4T1.
Decorin; Breast neoplasms; Genes, MHC class II; Splenocyte; 4T1 cells
WANG Hua, Email: 18511712135@163.com; HU Ze-bin, Email: 94535226@qq.com
100850 北京,军事科学院军事医学研究院辐射医学研究所(赵慧强、戴诗云、王华);100048 北京,中国人民解放军总医院第六医学中心干部保健科(赵慧强);264003 山东,滨州医学院临床医学院(刘超);100050 北京,中国食品药品检定研究院体外诊断试剂所(胡泽斌)
Author Affiliations: Institute of Radiation Medicine, Academy of Military Medical Sciences, Academy of Military Sciences, Beijing 100850, China (ZHAO Hui-qiang, DAI Shi-yun, WANG Hua); Department of Cadre Health Care, The Sixth Medical Center of PLA General Hospital, Beijing 100048, China (ZHAO Hui-qiang); School of Clinical Medicine, Binzhou Medical University, Shandong 264003, China (LIU Chao); Institute for In Vitro Diagnostic Reagents Control, National Institute for Food and Drug Control, Beijing 100050, China (HU Ze-bin)
10.3969/j.issn.1673-713X.2019.06.001
北京市科技新星计划(Z171100001117118)
王华,Email:18511712135@163.com;胡泽斌,Email;945352226@qq.com
2019-10-11
