一株放线菌次级代谢产物分离鉴定研究
2019-12-23薛长艳李建宋郝之奎奚逢源
薛长艳,李建宋,郝之奎,奚逢源
论著
一株放线菌次级代谢产物分离鉴定研究
薛长艳,李建宋,郝之奎,奚逢源
对放线菌NEAU-Jh3-20 菌株的次级代谢产物进行分离鉴定。
发酵液经大孔树脂HP-20 吸附洗脱、正相硅胶和凝胶 Sephadex LH-20 层析、制备型和半制备型高效液相色谱分离纯化,然后运用核磁共振、高分辨质谱等对单体化合物进行结构鉴定。
从放线菌NEAU-Jh3-20 菌株发酵液提取物中获得 5 个代谢产物,均为戊二酰亚胺类化合物,除化合物1为新化合物外,其余均为已知化合物,分别鉴定命名为:(5,9,11)-8,10-二甲基-3-(2-氨基-2-氧乙基)-7-十三氧代-5,9,11-三烯酸(1),()-4-[5-甲基-7-(3-甲基环氧乙烷-2-基)-2-羟基-4-氧代辛-6-烯-1-基]呱啶-2,6-二酮(2),2-{2-[(3,5)-3,5-二甲基-7-羟基-2-氧代辛-3,5-二烯-1-基]-6-氧代四氢-2-吡喃-4-基}乙酰胺(3),3-(4-羟苄基)六氢吡咯并[1,2-a]吡嗪-1,4-二酮(4),3-(6-甲基-1-羟基)-庚基-5-(羟甲基)二氢呋喃-2(3)-酮(5),5 个化合物均为首次从该菌中分离得到。
本研究丰富了微生物化合物多样性,同时为其他放线菌产活性物质的研究与发掘提供了参考与理论基础。
NEAU-Jh3-20; 次级代谢产物; 结构鉴定
由于抗生素的滥用以及抗药性菌株的不断出现,以及临床上使用的抗癌药及抗生素 60% ~ 70% 均出自或来源于其前体天然产物[1-2],使得人们一直致力于发掘寻找新型活性物质,而放线菌是公认的产生活性物质微生物中最大的类群,也是研究较多的一类。但由于研究手段和方法的限制,分离到的放线菌仅占所有放线菌的 10%[3],其中产生生物活性物质尤其是抗生素的链霉菌占了众多放线菌的一半[4],然而不同菌株在所产化合物上有所差异。一直以来从海洋放线菌中发现具有结构新颖的化合物屡见不鲜[5]。因此,本文对链霉菌进行发酵,对其产生的代谢产物进行分离鉴定归纳研究,丰富了微生物化合物多样性,同时为其他放线菌产活性物质的研究与发掘提供了参考与理论基础。
1 材料与方法
1.1 材料
1.1.1 仪器设备 YJ-875 型超净工作台购自苏州净化设备厂;37 ℃、5% CO2恒温培养箱购自德国 BinDer 公司;摇床购自美国 New Brunswick Scientific 公司;恒温恒湿培养箱购自德国 Binder 公司;pH 计购自上海精密科学仪器有限公司;薄层层析硅胶板购自烟台市化学工业研究所;YB102 电子天平购自上海海康电子仪器厂;Diaion HP-20 树脂购自日本三菱公司;Sephadex LH-20 购自 GE Healthcare 公司;旋转蒸发仪购自日本 Eyela 公司;半制备型液相色谱仪(Zorbax SB-C18,5 μm,250 mm × 9.4 mm)购自美国 Agilent 公司;制备型液相色谱仪(LC-8A,C18,5 μm,250 mm × 20 mm)购自日本 Shimadzu 公司;DRX-400 超导核磁共振仪购自德国 Bruker 公司;色谱用试剂购自美国 Fisher 公司;其他试剂为市售分析纯。
1.1.2 菌株 实验菌株为链霉菌属NEAU-Jh3-20,分离自吉林省河流淤泥,16s rRNA 基因序列在 GenBank 中登记号为:KM000839。
1.2 方法
1.2.1 发酵培养 按接种量5%(v/v),将培养24 ~ 48 h 的种子培养基(酵母粉 0.4%、麦芽提取物 1.0%、葡萄糖 0.4%、可溶性淀粉 2.0%、ISP3/ISP4 微液 1.0 ml/L、CaCO30.2%,pH 7.2 ~ 7.4)接种到 20 L 摇瓶发酵的发酵培养基(可溶性淀粉 2%,棉籽饼粉 1%,酵母粉 0.5%,麦芽糊精 2.0%、麦芽提取物 0.5%、CaCO30.2%、MgSO4·7H2O 0.2%、NaCl 0.2%,pH 7.0 ~ 7.2),装量为 250 ml/L 摇瓶,28 ℃,250 r/min 摇瓶发酵培养 7 d。
1.2.2 分离与提取 将发酵后的 20 L 发酵液通过真空抽滤,使得菌丝体和上清液分离,分开后的菌体用去离子水(3 L)冲洗,再用乙醇(3 L)室温搅拌浸泡 12 h 后离心,取上清。将 HP-20 树脂装入树脂柱(规格为 8 cm × 120 cm,装量为 1 L),上清液加入到 HP-20 树脂柱进行动态吸附 2 次,吸附后用 5 L 去离子水去除树脂上多余糖分,乙醇(6 L)洗脱树脂,得到乙醇洗脱液。浸提液和乙醇洗脱液分别在 55 ℃下浓缩至干,取浓缩样品少量溶解,TLC 薄层层析,结果显示两份样品主点大体一致,因此将两份浓缩样混合在一起,经硅胶(100 ~ 200 目)柱层析,以氯仿/甲醇(= 100:0/50:50,v/v)梯度洗脱,TLC 薄层层析检测,将相似流份合并浓缩后,进行 LH-20 凝胶柱层析(直径5.2 cm,柱高 120 cm),以甲醇/氯仿(1:1,v/v)进行洗脱,经 TLC 薄层层析检测,再浓缩,样品通过制备型高效液相、半制备型高效液相反向色谱进行化合物分离纯化。
1.2.3 结构鉴定 运用核磁共振和高分辨质谱(HRESIMS)、旋光、红外光谱(IR)和紫外光谱(UV)等现代仪器分析技术对得到单体化合物进行结构鉴定。对于简单常见化合物,与已知类似化合物的1H-NMR 数据图谱对比,质谱分析便可初步推断该化合物结构、分子式等。不常见图谱结构,通过核磁共振进行DEPT135、1H-1H COSY、HSQC、HMBC、NOESY 信号扫描、全谱分析,结合高分辨质谱 MS、旋光度、IR 和 UV 对化合物进行结构鉴定,推断其分子量及分子式,继而确定化合物结构,SciFinder Scholar 检索,以确定化合物是否为新化合物。
2 结果
2.1 次级代谢产物的分离纯化
从放线菌NEAU-Jh3-20 中共分离得到 5 个化合物(图 1),其中化合物1经结构鉴定确定为新化合物,表 1 为化合物分离制备条件。
2.2 化合物结构鉴定
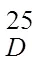
化合物1的1H-NMR(400 MHz,CDCl3)谱给出 5 个烯族质子信号[H5.22(1H,d,=9.7 Hz)、H5.55 m,H5.83(1H,d,= 11.7 Hz),H6.26(1H,d,= 15.56 Hz),H6.84 m];1 个烯甲基质子信号[H1.87(3H,s)];2 个脂肪族双峰甲基信号[H1.20(3H,d,= 6.8 Hz),H1.773H,d,=1.5 Hz)]。13C-NMR 和 DEPT135 谱给出了 17 个碳信号,它们分别为 1 个羰基碳信号(C200.1),2 个酰胺羰基碳信号(C175.4,175.9),5 个2次甲基碳信号(C125.1,128.5,130.6,133.0,143.6),1 个2季碳信号(C135.1),3 个亚甲基碳信号(C37.1,38.2,39.6),3 个甲基碳信号(C14.7,16.4,17.2)。
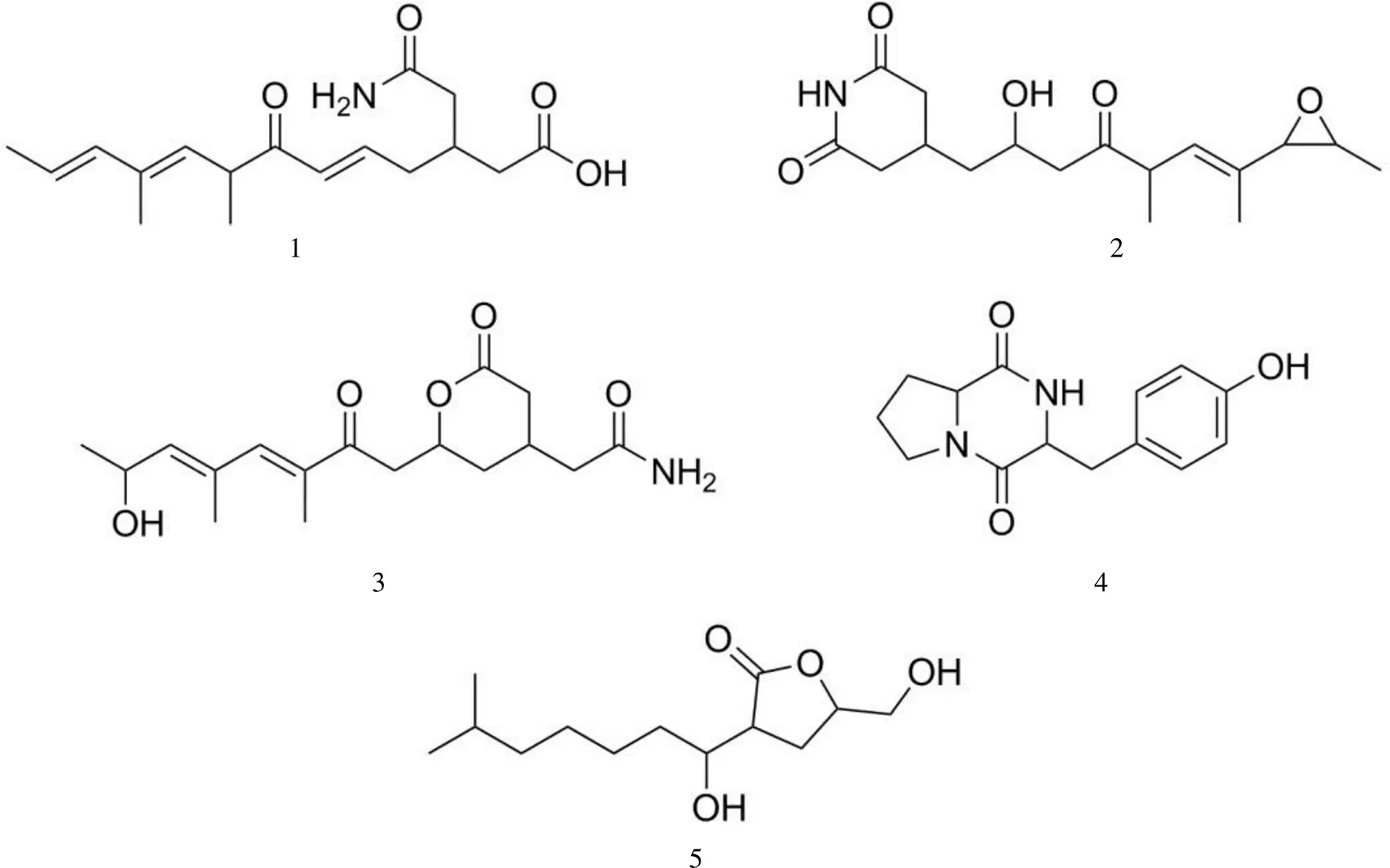
图 1 化合物1 ~ 5 结构
Figure 1 Structure of compounds 1-5

表 1 化合物1 ~ 5的 HPLC 分离条件
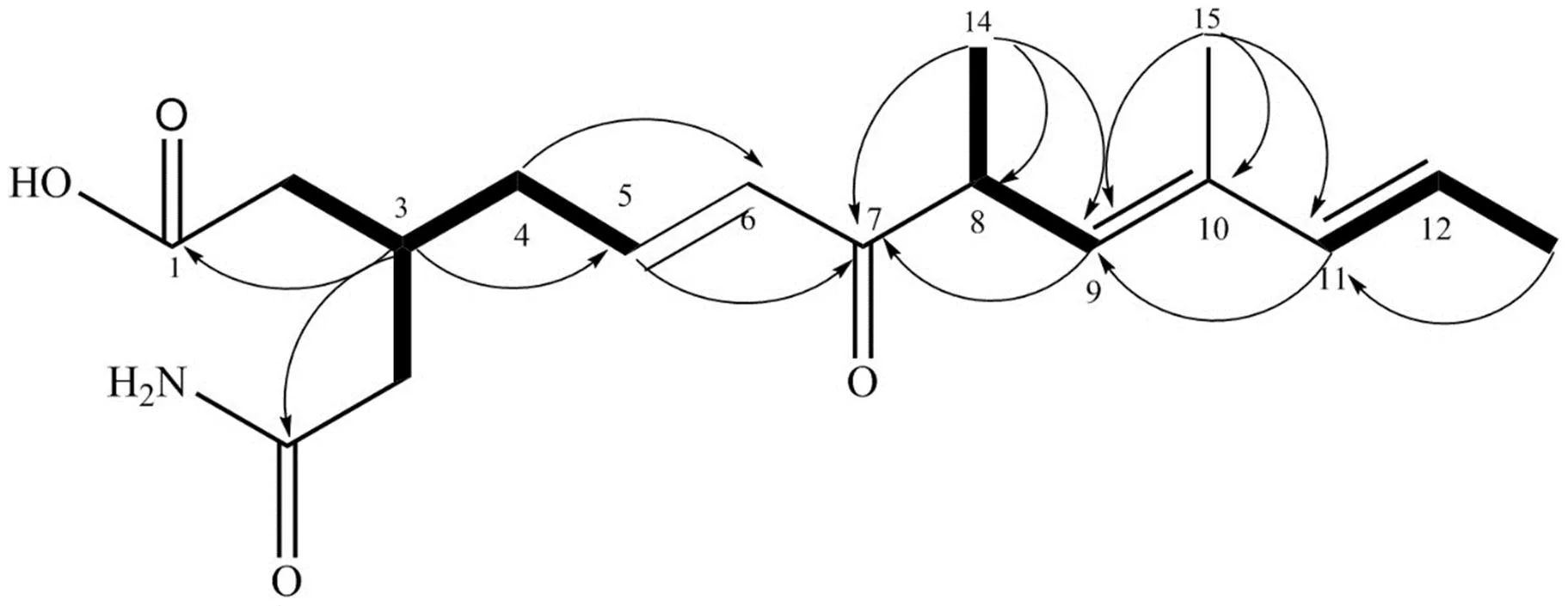
图 2 化合物1的关键1H-1H COSY 和HMBC 相关谱图
Figure 2 The key1H-1H COSY and HMBC spectrum of compound 1
化合物1通过在 H-3/H2-4/H-5,H-9/H-8/H3-14,H-11/H-12/H3-13 的1H-1H COSY 相关性证明了 C-3 到 C-5,C-9 到 C-14,和 C-11 到 C-13 三个结构单元,从 H-5,H-9 到 C-7,从 H3-14 到 C-7,C-8,C-9,从 H3-15 到 C-9,C-10,C-11 的 HMBC 信号可以确定 C-3-C-13 的信号连接(图 2)。两个酰胺羰基碳(C175.4,C175.9)和四个质子对亚甲基信号H2.33(1H,m),2.34(1H,m),2.42(1H,m),2.46(1H,m)存在HMBC 信号,同时,这四个质子对亚甲基信号H2.33(1H,m),2.34(1H,m),2.42(1H,m),2.46(1H,m)和H2.33(1H,m)存在1H-1H COSY 信号。
1H-NMR(400 MHz,CDCl3)数据6.84(1H,m);6.26(1H,d,= 15.56 Hz);5.83(1H,d,= 11.7 Hz);5.55(1H,m);5.22(1H,d,=9.7 Hz);3.60(1H,m);2.55(1H,d,= 5.7 Hz);2.46(1H,m);2.42(1H,m);2.34(1H,m);2.33(3H,m);1.87(3H,s);1.77(3H,d,=1.5 Hz);1.20(3H,d,= 6.8 Hz)。
13C-NMR(100 MHz,CDCl3)数据200.1(C-7);175.9(C-2');175.4(C-1);143.6(C-5);135.1(C-10);133.0(C-9);130.6(C-6);128.5(C-11);125.1(C-12);45.0(C-8);39.6(C-2);38.2(C-1');37.1(C-4);32.0(C-3);17.2(C-15);16.4(C-14);14.7(C-13)。
综上数据,同时参考相似化合物[6]核磁数据解析出化合物1的结构,通过 SciFinder 检索,未发现该化合物的相关报道,表明这是一个新的戊二酰亚胺类化合物,依据系统命名法命名为:(5,9, 11)-8,10-二甲基-3-(2-氨基-2-氧乙基)-7-十三氧代-5,9,11-三烯酸。
2.2.2 化合物2 分子式 C17H25NO5,浅黄色油状物质;ESI-MS322.12 [M-H]-,分子量为 323。1H-NMR(400 MHz,CDCl3)数据5.29(1H,dm,= 9.8,1.3 Hz);4.09(1H,m);3.42(1H,dq,= 9.8,6.8 Hz);3.35(1H,dd,= 4.2,1.3 Hz);3.19(1H,dq,= 4.2,5.3 Hz);2.76(2H,m);2.54(2H,d,= 5.3 Hz);2.48(1H,m);2.31(2H,m);1.74(3H,dd,= 1.3 Hz);1.58(1H,ddd,= 13.9,10.5,4.8 Hz);1.30(1H,ddd,= 13.9,8.7,2.6 Hz);1.18(3H,d,= 6.8 Hz);1.12(3H,d,= 5.3 Hz)。
根据1H-NMR 和 ESI-MS 图谱解析出化合物2的结构,通过 SciFinder Scholar 检索,与文献[7]中化合物进行数据对比,确定化合物2为已知的戊二酰亚胺类化合物:()-4-[5-甲基-7-(3-甲基环氧乙烷-2-基)-2-羟基-4-氧代辛-6-烯-1-基]呱啶-2,6-二酮。
2.2.3 化合物3 分子式 C17H25NO5,为无色油状物质;ESI-MS322 [M-H]-,分子量为 323。
1H-NMR(400 MHz,CDCl3)数据6.94(1H,d,= 10.0 Hz);5.66(1H,d,= 7.8 Hz);4.62(1H,m);4.48(1H,d,= 6.3,5.1 Hz);3.18(1H,dd,= 18.0,6.5 Hz);2.88(1H,dd,= 18.0,5.6 Hz);2.67(1H,dd,= 16.0,6.0 Hz);2.61(1H,m);2.34(2H,d,= 7.1 Hz);2.33(1H,dd,= 16.0,8.0 Hz);1.82(2H,t,= 6.7 Hz);1.69(3H,s);1.64(3H,s);1.57(3H,s)。根据1H-NMR 和 ESI-MS 图谱解析出化合物的结构,通过 SciFinder Scholar 检索发现为已知的戊二酰亚胺类化合物:2-{2-[(3,5)-3,5-二甲基-7-羟基-2-氧代辛-3,5-二烯-1-基]-6-氧代四氢-2-吡喃-4-基}乙酰胺,且与文献[6,8]中化合物相似。
2.2.4 化合物4 分子式 C14H16N2O3,无色无定型固体;ESI-MS261[M+H]+,分子量为 260。1H-NMR(400 MHz,CDCl3)数据7.08(1H,s);7.06(1H,s);6.74(1H,s);6.72(1H,s);6.11(1H,s);4.22(1H,dd,= 2.9,9.6 Hz);4.08(1H,m);3.57(2H,m);3.42(2H,dd,= 11.0,14.0 Hz);2.32(1H,m);1.96(1H,m);1.85(2H,m);根据1H-NMR 和 ESI-MS 图谱,推导出化合物4的结构,通过 SciFinder Scholar 检索,发现化合物4与文献[9]中化合物核磁数据基本一致,为环二肽类化合物:3-(4-羟苄基)六氢吡咯并[1,2-a]吡嗪-1,4-二酮。
2.2.5 化合物5 分子式 C13H24O4,淡黄色油状物质;ESI-MS m/z 243 [M-H]-,分子量 244。1H-NMR(400 MHz,CDCl3)数据δ 4.62(1H,m);4.06(1H,m);3.83(1H,dd,= 1.5,7 Hz);3.55(1H,dd,= 2.5,7 Hz);2.78(1H,dd,= 2.6,8 Hz);2.35(1H,dd,= 8,12.8 Hz);2.05(1H,dd,= 4,10 Hz);1.05-1.55(9H,m);0.81(6H,d,= 7.2 Hz)。
根据以上核磁数据解析确定出化合物5的结构,通过 SciFinder Scholar 检索,与文献[10]中丁内酯数据基本一致,为丁烷内酯类化合物:3-(6-甲基-1-羟基)-庚基-5-(羟甲基)二氢呋喃-2(3)-酮。
3 讨论
从海洋微生物中获取结构新颖的抗肿瘤天然产物是学者们研究的热点,也是亟需解决的任务,而被冠以丰富资源库的海洋放线菌次级代谢产物又是“药物先导化合物”的重要来源[11],因此本研究对分离自河流淤泥的链霉菌NEAU-Jh3-20 菌株进行摇瓶发酵,分离得到 5 个化合物,主要为酰胺类化合物,化合物1为新化合物。据文献记载该类化合物因其具有抗菌、抗病毒、抗肿瘤、抗炎症等多种生物活性而被广泛研究[12-14]。本文为以放线菌为研究前提,探索开发活性天然化合物及商业用药提供了参考意义,具有巨大潜在研究价值和开发前景。
[1] Van Lanen SG, Shen B. Microbial genomics for the improvement of natural productdiscovery. Curr Opin Microbiol, 2006, 9(3):252-260.
[2] Challis GL. Mining microbial genomes for new natural products and biosynthetic pathways. Microbiology, 2008, 154(6):1555-1569.
[3] Zhang JZ, Huang JJ, Sheng ZD, et al. Microbial taxonomy. Shanghai: Fudan University Press, 1985:214-218. (in Chinese)
张纪忠, 黄静娟, 盛宗斗, 等. 微生物分类学. 上海: 复旦大学出版社, 1985:214-218.
[4] McKenzie NL, Thaker M, Koteva K, et al. Induction of antimicrobial activities in heterologous streptomycetes using alleles of the Streptomyces coelicolor gene absA1. J Antibiot (Tokyo), 2010, 63(4): 177-182.
[5] Jiang LX, Wu Y, Chen JH, et al. Identification of six Actinomycetes strains isolated from mangrove rhizosphere soil and determination of their activity. J Pathogen Biol, 2017, 12(6):513-518. (in Chinese)
蒋莲秀, 吴越, 陈建宏, 等. 6株红树林根际土壤放线菌的分离鉴定及活性测定. 中国病原生物学杂志, 2017, 12(6):513-518.
[6] Zhao XL, Wang H, Xue ZL, et al. Two new glutarimide antibiotics from Streptomyces sp. HS-NF-780. J Antibiot (Tokyo), 2019, 72(4): 241-245.
[7] Otani T, Sasaki T, Minami Y, et al. New glutarimide antibiotics, S-632-B1 and B2. I. Taxonomy of producing strain, fermentation and biological properties. J Antibiot (Tokyo), 1989, 42(5):647-653.
[8] Urakawa A, Otani T, Yoshida K, et al. Isolation, structure determination and biological activities of a novel antifungal antibiotic, S-632-C, closely related to glutarimide antibiotics. J Antibiot (Tokyo), 1993, 46(12):1827-1833.
[9] Pérez-Mellor A, Alata I, Lepère V, et al. Conformational study of the jet-cooled diketopiperazine peptide cyclo tyrosyl-prolyl. J Phys Chem B, 2019, 123(28):6023-6033.
[10] Pathirana C, Dwight R, Jensen PR, et al. Structure and synthesis of anew butanolide from a marine actinomycete. Tetrahedron Lett, 1991, 32(48):7001-7004.
[11] Marris E. Marine natural products: drugs from the deep. Nature, 2006, 443(7114):904-905.
[12] Cheng C, Liu Q, Chen L, et al. Isolation, structure determination and biological activity of a new glutarimide antibiotic, S632A3. J Asian Nat Prod Res, 2006, 8(1-2):55-60.
[13] Deng H, Zhang N, Wang Y, et al. S632A3, a new glutarimideantibiotic, suppresses lipopolysaccharide-induced pro-inflammatory responses via inhibiting the activation of glycogen synthase kinase 3β. Exp Cell Res, 2012, 318(20):2592-2603.
[14] Wang HP, Lou J, Chen LC, et al. Cyclodipeptides from Bacillus sp. HZ16. Nat Product Res Dev, 2017, 29(5):783-786. (in Chinese)
王宏鹏, 楼坚, 陈丽春, 等. 芽孢杆菌HZ16发酵产物中的环二肽类化学成分. 天然产物研究与开发, 2017, 29(5):783-786.
Isolation and identification of secondary metabolites from a strain of
XUE Chang-yan, LI Jian-song, HAO Zhi-kui, XI Feng-yuan
To isolate and identify secondary metabolites fromNEAU-Jh3-20.
The fermentation liquid was separated and purified by HP-20 resin adsorption, normal silica gel and Sephadex LH-20 chromatography, preparative and semi-preparative HPLC. The structures of monomer compounds were identified by modern instrumental spectral analysis techniques such as NMR and HRMS.
Five compounds were extracted from the fermentation broth ofNEAU-Jh3-20, among them compound 1 was identified as a new compound. All compounds were identified separately as follows: (5,9,11)-3-(2-amino- 2-oxoethyl)-8,10-dimethyl-7-oxotrideca-5,9,11-trienoic acid (1), ()-4-[2-hydroxy-5-methyl-7-(3-methyloxiran-2-yl)-4-oxooct-6- en-1-yl]piperidine-2,6-dione (2), 2-{2-[(3,5)-7-hydroxy-3,5-dimethyl-2-oxoocta-3,5-dien-1-yl]-6-oxotetrahydro-2H-pyran-4-yl} acetamide (3), 3-(4-hydroxybenzyl)hexahydropyrrolo(1,2-a)pyrazine-1,4-dione (4), 3-(1-hydroxy-6-methylheptyl)-5-(hydroxymethyl) dihydrofuran-2(3H)-one (5).
This study enriched the diversity of microbial compounds and provided references for the research and excavation of active substances produced by other actinomycetes.
NEAU-Jh3-20; Second metabolites; Structure identification
XUE Chang-yan, Email: xcydawn@163.com
Author Affiliations: Biotechnology Research Institute, Taizhou Vocational & Technical College, Zhejiang 318000, China (XUE Chang-yan, LI Jian-song, HAO Zhi-kui); Taizhou Technician College, Zhejiang 318000, China (XI Feng-yuan)
10.3969/j.issn.1673-713X.2019.06.006
浙江省基础公益研究计划(LGG18E020003);台州市科技计划项目(1801gy24);台州职业技术学院校级课题(2019YB05);台州技师学院(筹)(2018TJXZ01)
318000 浙江,台州职业技术学院应用生物技术研究所(薛长艳、李建宋、郝之奎);318000 浙江,台州技师学院(奚逢源)
薛长艳,Email:xcydawn@163.com
2019-09-04
