RAI1脱敏干预影响变应性鼻炎大鼠模型ECP表达和Th1-Th2分化的机制
2019-12-23杨守云肖艳
杨守云,肖艳
论著
RAI1脱敏干预影响变应性鼻炎大鼠模型ECP表达和Th1-Th2分化的机制
杨守云,肖艳
探究探针 RAI1 脱敏干预影响变应性鼻炎大鼠模型 ECP 表达和 Th1-Th2 分化的机制
卵白蛋白(OVA)诱导雌性 Sprague-dawley 大鼠构建过敏性鼻炎(AR)模型。并进行构建沉默 RAI1 mRNA 质粒载体,脑内注射至AR 模型大鼠体内。通过蛋白质印迹法检测 Th1-Th2 相关因子的蛋白表达情况;通过 qRT-PCR 分析各组大鼠中维甲酸诱导蛋白 RAI1 的 mRNA 表达情况;通过记录大鼠鼻炎行为评估变应性鼻炎症状;通过酶联免疫吸附试验检测各组大鼠血清中 ECP、IgE 含量。
大鼠搔鼻挠嘴、打喷嚏行为 AR 模型组较对照组、RAI1 干预组频繁(< 0.05),说明 AR 模型建立成功。RAI1 干预组(1.02 ± 0.01)较AR 模型组(2.85 ± 0.25)、对照组(2.69 ± 0.11)相比,RAI1 mRNA 表达降低(< 0.05),说明病毒载体构建成功,RAI1 蛋白表达受到抑制。Th1 相关因子 IL-2、IFN-γ 的蛋白表达 AR 模型组较对照组、RAI1 干预组低(< 0.05)。Th2 相关因子IL-4、IL-5 的蛋白表达 AR 模型组较对照组、RAI1 干预组高(< 0.05)。经酶联免疫吸附检测 ECP、IgE 含量,AR 模型组(3.11 ± 0.23、29.51 ± 3.64)较对照组(1.62 ± 0.18、13.72 ± 2.68)、RAI1 干预组(1.85 ± 0.14、17.66 ± 2.16)升高(< 0.05)。
RAI1 脱敏干预会降低 ECP 蛋白表达,平衡 Th1-Th2 生物功能,对变应性鼻炎具有治疗效果,减轻鼻炎症状。
鼻炎,变应性,季节性; 脱敏法,免疫; Th1-Th2 平衡; 嗜酸性粒细胞阳离子蛋白; 炎症反应; RAI1
变应性鼻炎又称过敏性鼻炎(allergic rhinitis,AR)是由免疫球蛋白E(immunoglobulin E,IgE)介导的炎症诱发的 I 型过敏性疾病,其特征为阵发性鼻塞、鼻漏、鼻痒和打喷嚏[1]。1 型辅助 T 细胞(type 1 helper T cell,Th1)和 2 型辅助 T 细胞(type 2 helper T cell,Th2)的失衡被认为是 IgE 介导的过敏性炎症的主要诱导因素[2]。当持续暴露于某些浓度的过敏原时,抗原呈递细胞将过敏原呈递给 CD4+T 淋巴细胞,其反过来释放刺激 B 淋巴细胞分化成浆细胞的细胞因子,促进了 IgE 的产生[3]。当 IgE 抗体与肥大细胞和嗜酸性粒细胞上的受体结合时,个体会变得敏感;当它们再次暴露于过敏原时,会刺激 IgE 介导的炎症,导致 AR 症状[4-5]。嗜酸性粒细胞阳离子蛋白(eosinophil cationic protein,ECP)在引起鼻腔炎症反应中起到迟发作用,在嗜酸性细胞趋化因子的作用下分化成熟并参与其中的炎症反应[6]。维甲酸诱导蛋白介导的人 B 细胞活化可增强先天性和适应性 B 细胞应答之间的相互作用,调节免疫应答过程[8]。本研究即探究与 AR 相关的 Th1 和 Th2 免疫应答机制以阐明RAI1 脱敏干预对过敏性炎症的影响及可能的治疗机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 无特定病原体等级Sprague-dawley 大鼠,雌性,3 月龄,体重 220 ~ 240 g。22 ℃,12 h 光照/ 12 h 黑暗循环下饲养,随意获取食物和水。所有实验程序均经动物保护和使用委员会批准,并根据实验动物护理和使用指南进行实验。
1.1.2 其他材料 OVA 购自美国 Sigma 公司;氢氧化铝购自苏州市协昌化学试剂有限责任公司;沉默 RAI1 mRNA 质粒载体购自上海赛默飞世尔科技有限公司;SYBR Green 核心反应试剂盒购自美国应用生物系统公司;PVDF 膜购自美国 BioTrace 公司;ECL 检测试剂盒、ECP Elisa 检测试剂盒和 IgE ELISA 检测试剂盒均购自上海碧云天生物科技有限公司。
1.2 方法
1.2.1 AR 大鼠模型构建及 RAI1 沉默表达载体构建 参照文献[7]构建由卵白蛋白(OVA)诱导的大鼠AR 模型。实验大鼠适应实验室条件后,用OVA(0.3 mg 腹腔注射)致敏,每 2 天腹腔注射氢氧化铝 30 mg,共计给药 14 d(D1 ~ D14)。第15 天起,每天鼻内滴注 10 μl 10% OVA,连续 7 d,第 22 天起,每隔一天继续鼻内施用10 μl 10% OVA 以维持过敏体征。
1.2.2 大鼠 RAI1 沉默表达载体构建 用浓缩的包装高滴度慢病毒颗粒对 OVA 诱导的 AR 模型脑内注射,将最终浓度调节至 1 × 1010TU/ml。慢病毒可以通过相应的穿梭质粒干扰靶基因的表达和生物活性。将慢病毒纯化并溶于 8% 甘油中。通过 RT-qPCR 测试慢病毒的滴度。
1.2.3 实验分组 将大鼠随机分为 3 组,每组8 只。分别为对照组(腹腔注射等量的生理盐水),AR 模型组(氢氧化铝 30 mg 给药 14 d,每 2 天给药 1 次),RAI1干预组(对于 AR 诱导的大鼠随机选取 8 只,将构建的沉默 RAI1 mRNA 质粒载体脑内注射大鼠体内)。实验中对各组大鼠进行分离观察实验,通过鼻腔灌洗、舌下静脉取血等方式收集样本。
1.2.4 大鼠搔鼻症状记录 将各组实验大鼠置于相同环境中,避免声音、强光等逆性环境,记录大鼠的搔鼻、打喷嚏、流鼻涕等行为现象,记录30 min,并根据大鼠 AR 评分量表对大鼠的鼻炎症状计算加和。
1.2.5 定量 mRNA 表达 大鼠舌下静脉抽取血液分离得到血清液,分离总 RNA。将 1 μg 总 RNA 用于 cDNA 合成和实时 PCR 基因表达分析。首先,20 ℃温育 5 min 以去除 DNA 污染,在 20 μl 反应体系中进行逆转录。反应条件:20 ℃ 10 min,42 ℃ 45 min,95 ℃ 5 min。使用 SYBR Green 核心反应试剂盒,在 7500 序列检测系统上通过实时 PCR 扩增 cDNA。将聚合酶在 95 ℃下热活化 10 min,然后95 ℃、15 s 进行 40 个循环,60 ℃下退火1 min 扩增转录物,并在每个循环中收集数据。
1.2.6 蛋白质印迹分析 生理盐水冲洗各实验组大鼠鼻腔,收集鼻腔分泌液样本,来自同一组的鼻黏膜样品混合在一起并从样本液中分离总蛋白质,使用 BCA 蛋白质测定试剂盒测定其浓度。在10% 分离凝胶上分离后,将蛋白质转移到PVDF膜上。用 5% 脱脂奶粉在室温下封闭膜1 h,用 PBS-0.05% Tween 20(PBS-T)洗涤 3 次后,将 PVDF 膜与第二抗体在室温下孵育 90 min。使用 ECL 检测试剂盒使蛋白质条带可视化。将膜用100 mmol/L 2-巯基乙醇、2% SDS 和 62.5 mmol/L Tris-HCl(pH 6.7)在 50 ℃洗涤 30 min,并与靶向单独蛋白质的抗体再温育。使用 NIH ImageJ 软件将所有印迹数字化并定量。
1.2.7 ELISA 检测大鼠血清中 ECP 及 IgE含量 将血清样品加载到涂有 10 μg/ml OVA 的 96 孔板中,并用生物素缀合的抗小鼠 IgE Ab、ECP 检测免疫球蛋白。用 3,3',5,5'-四甲基联苯胺溶液显色反应,然后用 2 mmol/L 硫酸终止反应。用酶标仪在 450 nm 检查吸光度。
2 结果
2.1 各细胞系中 RAI1 mRNA 相对表达情况
实时检测 PCR 扩增结果(图 1)显示,实验中 RAI1 干预组中 RAI1 mRNA 表达较对照组、AR 模型组降低,差异有统计学意义(< 0.05),说明模拟物基因沉默表达共建成功,RAI1 的基因表达受到抑制,为后续的实验结果提供了依据。
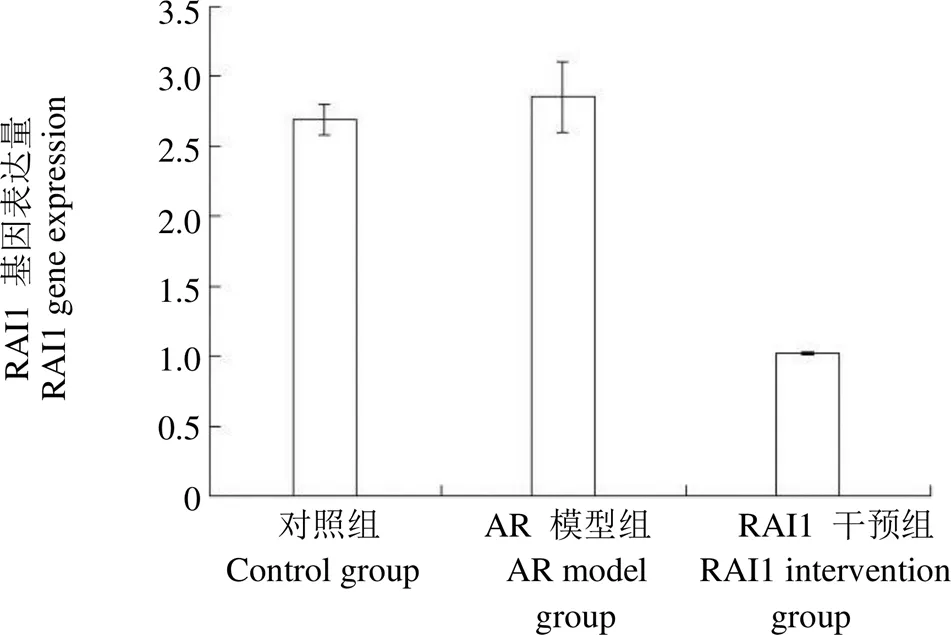
图 1 不同大鼠中的 RAI1 mRNA 相对表达情况(,n = 8)
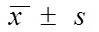
2.2 各实验组大鼠中挠鼻、打喷嚏行为记录情况
将各组实验大鼠置于相同环境中,避免声音、强光等逆性环境,记录大鼠的搔鼻、打喷嚏、流鼻涕等行为现象,记录 30 min。结果显示,在搔鼻挠嘴的行为上,AR 模型组、RAI1 干预组较对照组明显增多,差异有统计学意义(< 0.05),而 RAI1 干预组与 AR 模型组相比,大鼠搔鼻挠嘴次数降低,差异有统计学意义(< 0.05)。在记录大鼠的打喷嚏、流鼻涕行为上,AR 模型组、RAI1 干预组较对照组明显增多,差异有统计学意义(< 0.05),而 RAI1 干预组与 AR 模型组相比降低,差异有统计学意义(< 0.05)。说明干预组大鼠的 AR 状况较之前有很大改善(图 2)。
2.3 实验大鼠中 Th1 相关因子的蛋白表达情况
蛋白印迹分析各实验组中 Th1 相关因子的蛋白表达情况,发现与对照组相比,AR 模型组中IL-2、IFN-γ 蛋白表达降低,表达有统计学差异(< 0.05),RAI1 干预组较 AR 模型组 IL-2、IFN-γ 蛋白表达升高,差异有统计学意义(< 0.05)(图 3)。
2.4 实验大鼠中 Th2 相关因子的蛋白表达情况
蛋白印迹分析各实验组中 Th2 相关因子的蛋白表达情况发现与对照组相比,AR 模型组中 IL-4、IL-5 蛋白表达升高,差异有统计学意义(< 0.05),RAI1 干预组较 AR 模型组 IL-4、IL-5 蛋白表达降低,差异有统计学意义(< 0.05)(图 4)。
图 2 各实验组大鼠行为记录结果与比较(,n = 8)
2.5 血清 ECP 及 IgE 含量
通过 ELISA 检测对实验大鼠中的 ECP 及血清 IgE 含量分析。结果显示,AR 模型组较对照组和RAI1 干预组 ECP 含量升高,差异有统计学意义(< 0.05);AR 模型组较对照组和RAI1 干预组 IgE 含量升高,差异有统计学意义(< 0.05)(图 5)。
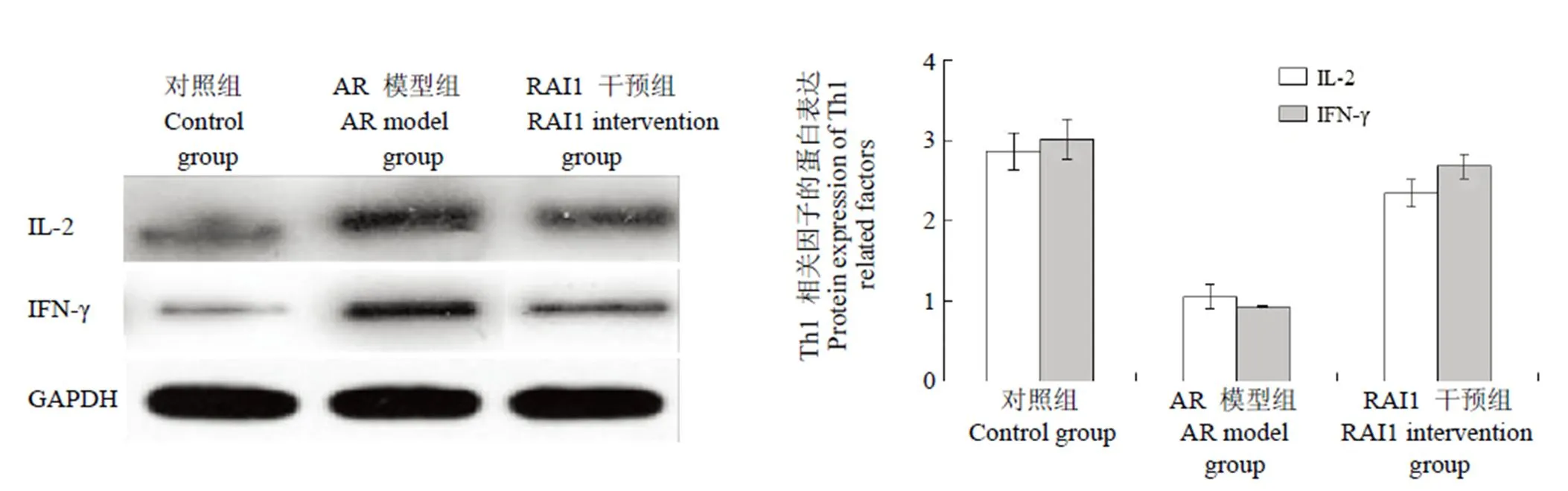
图 3 免疫印迹实验检测大鼠 Th1 相关因子的蛋白表达
Figure 3 Protein profile of Th1-related factors in experimental rats by Western blot
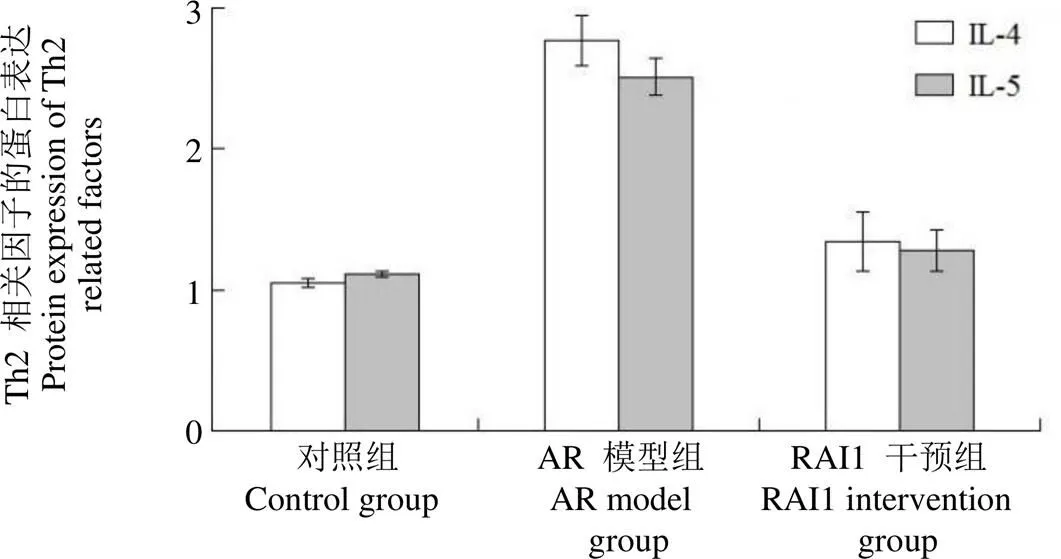
图 4 Th2 相关因子的蛋白表达(,n = 8)
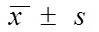
图 5 实验大鼠中 ECP 及 IgE 表达情况(,n = 8)
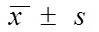
3 讨论
AR 是常见的过敏性疾病,不仅对患者的生活质量产生不利影响,还会引起多种相关并发症[9]。在该研究中,通过腹膜内注射 OVA 和氢氧化铝悬浮液并用OVA 溶液鼻腔滴注构建 AR 大鼠模型。在 AR 模型组中,大鼠表现极其频繁地打喷嚏和搔鼻挠嘴,血清总 IgE 和 ECP 水平升高,表明AR 大鼠模型构建成功。
AR 是 Th2 极化的过敏性疾病,推测 Th1-Th2 细胞失衡是导致 AR 的重要因素[10]。AR 中 Th0 细胞向 Th2 细胞的分化明显增强,结果导致 Th2 细胞因子的释放增加,加速转录因子和信号转导子和转录激活因子的表达,此外,过量的 Th2 细胞因子抑制 Th0 细胞向 Th1 细胞的分化,减少与 Th1 免疫应答相关的因子,如IFN-γ[11]。本研究发现过敏原特异性 Th1 在过敏性炎症中发挥重要作用。此外,Th1 细胞因子 IFN-γ 促进过敏原穿透呼吸道上皮并加重过敏性炎症。其次,在 AR发展后的不同时期,Th1 反应可能发挥不同的作用。据报道,在诱导 AR 后 24 h 内,OVA 诱导的 AR 大鼠模型中 Th1 细胞因子 IFN-γ 的血清水平明显升高,然后下降[12-13]。当感染 AR 时,分化为 Th2 细胞的比例将显著增加,并且 IL-4(主要由 Th2 细胞释放)分泌显著增加,以加速 IgE 的产生并同时抑制 Th1 应答。本研究中我们发现 AR 大鼠模型中 Th2 相关因子 IL-4、IL-5 均高表达,Th1 相关因子 IFN-γ、IL-2 均低表达[14-16]。目前用于 AR 的最流行的药物是口服 H1 抗组胺药和鼻内皮质类固醇,它们与免疫疗法结合使用,可以在短期或长期内控制这种过敏性疾病。然而,治疗期间可能会出现一系列副作用,如轻度嗜睡、深度睡眠、头晕、乏力等。在我们的研究中,通过 RAI1 脱敏干预 AR 模型组大鼠,能够平衡 Th1-Th2 相关因子的蛋白表达,降低与免疫应答的 ECP 含量,对 AR 治疗有一定作用。
[1] Ren M, Tang Q, Chen F, et al. Mahuang Fuzi Xixin decoction attenuates Th1 and Th2 responses in the treatment of ovalbumin-induced allergic inflammation in a rat model of allergic rhinitis. J Immunol Res, 2017, 2017:8254324.
[2] Shao YY, Zhou YM, Hu M, et al. The anti-allergic rhinitis effect of traditional Chinese medicine of Shenqi by regulating mast cell degranulation and Th1/Th2 cytokine balance. Molecules, 2017, 22(3): E504.
[3] Guo ZQ, Dong WY, Xu J, et al. T-helper type 1-T-helper type 2 shift and nasal remodeling after fine particulate matter exposure in a rat model of allergic rhinitis. Am J Rhinol Allergy, 2017, 31(3):148-155.
[4] Moitra S, Datta A, Mondal S, et al. Modulation of regulatory T cells by intranasal allergen immunotherapy in an experimental rat model of airway allergy. Int Immunopharmacol, 2017, 47:9-19.
[5] Gu ZW, Wang YX, Cao ZW. Neutralization of interleukin-17 suppresses allergic rhinitis symptoms by downregulating Th2 and Th17 responses and upregulating the Treg response. Oncotarget, 2017, 8(14):22361-22369.
[6] Dai YY, Ni SY, Ma K, et al. Stem cells from human exfoliated deciduous teeth correct the immune imbalance of allergic rhinitis via Treg cells in vivo and in vitro. Stem Cell Res Ther, 2019, 10(1):39.
[7] Luo Y, Wang S, Liu X, et al. Langerhans cells mediate the skin-induced tolerance to ovalbumin via Langerin in a murine model. Allergy, 2019. [Epub ahead of print]
[8] Choi SP, Oh HN, Choi CY, et al. Oral administration of Lactobacillus plantarum CJLP133 and CJLP243 alleviates birch pollen-induced allergic rhinitis in mice. J Appl Microbiol, 2018, 124(3):821-828.
[9] Iinuma T, Okamoto Y, Morimoto Y, et al. Pathogenicity of memory Th2 cells is linked to stage of allergic rhinitis. Allergy, 2018, 73(2):479-489.
[10] Sun Z, Zhe X, Wang D, et al. Selenium deficiency inhibits dendritic cells differentiation and immune function, imbalance the Th1/Th2 of dendritic cells. Metallomics, 2018, 10(5):759-767.
[11] Wise SK, Lin SY, Toskala E. International consensus statement on allergy and rhinology: allergic rhinitis-executive summary. Int Forum Allergy Rhinol, 2018, 8(2):85-107.
[12] Upadhyay R, Dua B, Sharma B, et al. Transcription factors STAT-4, STAT-6 and CREB regulate Th1/Th2 response in leprosy patients: effect of M leprae antigens. BMC Infect Dis, 2019, 19(1):52.
[13] Xue YL, Zhang SX, Zheng CF, et al. Silencing of STAT4 protects against autoimmune myocarditis by regulating Th1/Th2 immune response via inactivation of the NF-κB pathway in rats. Inflammation, 2019, 42(4):1179-1189.
[14] Sun J, Liu T, Yan Y, et al. The role of Th1/Th2 cytokines played in regulation of specific CD4+ Th1 cell conversion and activation during inflammatory reaction of chronic obstructive pulmonary disease. Scand J Immunol, 2018, 88(1):e12674.
[15] Ahir-Bist S, Chavan V, Samant-Mavani P, et al. Polymorphisms in TH1‐TH2 cytokine and receptor genes associated with risk of vertical HIV transmission, in Mumbai, India. J Gene Med, 2018, 20(10-11):e3047.
[16] Weinstein SF, Katial R, Jayawardena S, et al. Efficacy and safety of dupilumab in perennial allergic rhinitis and comorbid asthma.J Allergy Clin Immunol, 2018, 142(1):171-177, e1.
Mechanisms of RAI1 desensitization intervention on ECP expression and Th1-Th2 differentiation in allergic rhinitis rat model
YANG Shou-yun, XIAO Yan
To study mechanisms of RAI1 desensitization intervention on ECP expression and Th1-Th2 differentiation in allergic rhinitis (AR) rat model.
OVA induced an allergic rhinitis model in female Sprague-dawley rats. The silenced RAI1 gene plasmid vector was constructed and injected into the brain of AR model rats. The expression of Th1-Th2-related factors was detected by Western blot. The expression of retinoic acid-induced protein RAI1 in rats was analyzed by qRT-PCR. The symptoms of allergic rhinitis were evaluated by recording the behavior of rats with rhinitis. The serum levels of ECP and IgE were measured by ELISA.
Snoring and sneezing behavior in the AR model group of rats was more frequent than that the control group or RAI1 intervention group (< 0.05), indicating that the AR model was successfully established. The RAI1 mRNA expression was decreased in the RAI1 intervention group (1.02 ± 0.01) as compared with the AR model group (2.85 ± 0.25) or control group (2.69 ± 0.11) (< 0.05), indicating that the viral vector was successfully constructed and the RAI1 protein expression was inhibited. The protein expression of Th1 related factors IL-2 and IFN-γ was lower in the AR model group than that in the control group or RAI1 intervention group (< 0.05). The protein expression of Th2-related factors IL-4 and IL-5 was higher in the AR model group than that in the control group or RAI1 intervention group (< 0.05). The levels of ECP and IgE were detected by enzyme-linked immunosorbent assay (ELISA), and the values of the AR model group (3.11 ± 0.23, 29.51 ± 3.64) was higher than that of the control group (1.62 ± 0.18, 13.72 ± 2.68) or RAI1 intervention group (1.85 ± 0.14, 17.66 ± 2.16) (< 0.05).
RAI1 desensitization intervention can reduce ECP protein expression, balance Th1-Th2 biological function, have therapeutic effect on allergic rhinitis, and alleviate rhinitis symptoms.
Rhinitis, atopic, seasonal; Desensitization, immunity; Th1-Th2 balance; Eosinophil cationic protein; Inflammatory response; RAI1
YANG Shou-yun, Email: 971135735@qq.com
Author Affiliation: Department of E.N.T., National Medicine Dongfeng Maojian Hospital Shiyan, Hubei 442012, China
10.3969/j.issn.1673-713X.2019.06.011
442012 湖北,十堰市国药东风茅箭医院耳鼻喉科
杨守云,Email:yangshy012@126.com
2019-06-17
