塞来昔布对骨关节炎大鼠软骨组织AQP1和AQP3表达影响的研究
2019-12-19郑世雄刘合亮杨巍魏艳珍林亮明
郑世雄 刘合亮 杨巍 魏艳珍 林亮明


【摘 要】目的:研究塞來昔布对骨关节炎模型大鼠软骨组织水通道蛋白1(AQP1)和水通道蛋白3(AQP3)分布与表达的影响。方法:将45只SD大鼠随机分为空白对照组、模型对照组、塞来昔布组,每组15只。模型对照组和塞来昔布组采用关节腔注射木瓜蛋白酶建立模型。塞来昔布组采用
17.85 mg·kg-1·d-1塞来昔布灌胃,另外2组采用等量生理盐水灌胃。取左侧膝关节HE染色、甲苯胺蓝染色观察软骨组织形态,免疫组化观察AQP1、AQP3表达,ELISA检测血清白细胞介素-1β(IL-1β)含量;取右侧膝关节Real-time PCR、Western Blot检测软骨组织AQP1、AQP3表达。结果:与空白对照组比较,模型对照组软骨面缺损,细胞排列紊乱,甲苯胺蓝染色重度减弱,Mankin评分显著升高(P < 0.01),
移行层AQP1、AQP3表达显著升高(P < 0.05或P < 0.01),血清IL-1β表达升高(P < 0.01),AQP1、AQP3 mRNA和蛋白表达均升高(P < 0.05)。与模型对照组比较,塞来昔布组软骨面缺损较小,细胞排列较规则,甲苯胺蓝染色较深,Mankin评分降低(P < 0.05),移行层AQP3表达降低(P < 0.05),血清IL-1β表达降低(P < 0.01),AQP3 mRNA和蛋白表达降低(P < 0.01)。结论:塞来昔布可降低AQP3的分布范围和表达量,降低软骨组织渗透性,可能是其治疗骨关节炎的潜在作用机制之一。
【关键词】 骨关节炎;塞来昔布;水通道蛋白1;水通道蛋白3;大鼠
Effects of Celecoxib on the Expressions of AQP1 and AQP3 in the Cartilage of Rats with Osteoarthritis
ZHENG Shi-xiong,LIU He-liang,YANG Wei,WEI Yan-zhen,LIN Liang-ming
【ABSTRACT】Objective:To study the effects of celecoxib on the distribution and expressions of AQP1 and AQP3 in the cartilage of rats with osteoarthritis.Methods:Forty-five SD rats were randomly divided into a blank control group,a model control group and a celecoxib group,with 15 rats in each.In the model control group and the celecoxib group,papain was injected into the articular cavity to establish models.In the celecoxib group,17.85 mg·kg-1·d-1 of celecoxib was administered to the stomach,and in the other two groups,the same amount of normal saline was administered to the stomach.HE staining and toluidine blue staining were used to observe the cartilage morphology of the left knee joint,the expressions of AQP1 and AQP3 was observed by immunohistochemistry,and the content of IL-1β in serum was detected by ELISA.The expressions of AQP1 and AQP3 in cartilage of the right knee joint were detected by real-time PCR and Western blot.Results:Compared with the blank control group,the model control group had cartilage defects,disordered cell arrangement,weakened toluidine blue staining,significantly increased Mankin score(P < 0.01),significantly increased AQP1 and AQP3 expressions in the transitional layer(P < 0.05 or P < 0.01),increased IL-1β expression in serum(P < 0.01),and increased AQP1,AQP3 mRNA and protein expressions(P < 0.05).Compared with the model control group,the defect of cartilage surface in the celecoxib group was smaller,the cell arrangement was more regular,toluidine blue staining was deeper,Mankin score was lower
(P < 0.05),AQP3 expression in the transitional layer was lower(P < 0.05),IL-1β expression in serum was lower
(P < 0.01),and AQP3 mRNA and protein expressions were lower(P < 0.01).Conclusion:Celecoxib can reduce the distribution and expression of AQP3 and the permeability of cartilage tissue,which may be one of the potential mechanisms of treating osteoarthritis.
【Keywords】 osteoarthritis;celecoxib;aquaporin 1;aquaporin 3;rats
骨关节炎(osteoarthritis,OA)是常见的退行性疾病,发病率随人口老龄化而逐年增高,其病理变化以关节软骨变性和继发性骨质增生为主[1],具体发病机制仍未明确。软骨细胞是软骨中唯一的细胞成分,其主要功能为合成和分泌软骨基质,水是软骨基质的主要成分,约占软骨湿重的75%,软骨中不存在血管、淋巴、神经,营养物质由关节液和软骨下骨提供。当软骨组织蛋白多糖含量正常,负电荷密度高,流动水分子少,软骨渗透性小;而OA蛋白多糖含量减少,负电荷密度低,流动水分子增多,软骨渗透性增强,出现软骨水肿,软骨液相承重减弱而有机固相承重增加,导致软骨退变进一步加重。因此,水分子的流动、软骨渗透性的改变在OA的发展中起重要作用。
水通道蛋白(AQPs)是疏水性的跨膜蛋白家族,主要介导水的跨膜转运以维持细胞物质代谢[2]。近年来研究表明,AQP1和AQP3在OA发生、发展中起重要作用[3-6],AQP1、AQP3可能在OA的发生、发展中起协同作用。塞来昔布胶囊是临床常用的非甾体抗炎药,用于缓解OA临床症状。本研究通过建立大鼠OA模型,采用塞来昔布进行干预,观察软骨组织中AQP1、AQP3分布与表达的变化,探讨塞来昔布对OA抗炎消肿的潜在作用机制。
1 实验材料
1.1 实验动物与药物 SPF级8周龄雄性SD大鼠45只,体质量(250±10)g,购自上海斯莱克实验动物有限公司,生产许可证号SCXK(沪)2012-0002。在福建省中医药研究院比较医学中心进行实验,实验动物使用许可证号SYXK(闽)2016-0005。塞来昔布胶囊(辉瑞制药有限公司,生产批号X00278,规格200 mg)。
1.2 主要试剂与仪器 戊巴比妥钠(Merck)、木瓜蛋白酶(Merck)、多聚甲醛(国药集团化学试剂有限公司);乙二胺四乙酸二钠(国药集团化学试剂有限公司);苏木素-伊红(HE)染液、甲苯胺蓝(沃凯)、通用SP超敏免疫组化(北京索莱宝科技有限公司);白细胞介素-1β(IL-1β)ELISA试剂盒(上海西唐生物科技有限公司);TRIzol(invitrogen);SYBR? Premix Ex Taq?(Takara);Anti-AQP 1(Abcam);Anti-AQP 3(Abcam);石蜡切片机(Leica,RM2255)荧光定量PCR仪(ABI,7500 Fast);多色熒光/化学发光成像(Protein simple,FluorChem M)。
2 方 法
2.1 模型制备 将45只SD大鼠随机分为空白对照组、模型对照组和塞来昔布组,每组15只。模型对照组和塞来昔布组采用关节腔注射木瓜蛋白酶制备模型[7-8],术前禁食不禁水,称重,质量分数为2%的戊巴比妥钠0.2 mL·(100 g)-1腹腔注射麻醉;电动剃毛刀剃毛、碘伏消毒,屈膝,髌韧带附着点外上方为进针点;质量分数为4%的木瓜蛋白酶关节腔内注射0.2 mL,每隔3 d注射一次,即第1,4,7 d,共注射3次;每次注射后给予20万U青霉素钠肌内注射以预防感染;末次注射7 d后,模型建立。
2.2 药物干预 模型建立后,根据人与实验动物等效剂量系数折算法[9],计算大鼠给药剂量,塞来昔布组给予塞来昔布17.85 mg·kg-1·d-1灌胃,空白对照组、模型对照组给予等量生理盐水灌胃,每日1次,连续4周。药物干预结束后取材,腹主动脉采血分离血清备用,取左侧膝关节质量分数为4%的多聚甲醛保存备用;取右侧膝关节快速刮取透明软骨,过液氮后转移至-80 ℃保存备用。
2.3 病理学观察 膝关节采用质量分数为4%的
多聚甲醛常温固定48 h,质量分数为10%的EDTA常温脱钙,每3日更换脱钙液至刀切无阻力感,水洗,梯度乙醇脱水、二甲苯透明、石蜡包埋,矢状面为切面,4 μm厚连续切片,42 ℃摊片,60 ℃
烤片,切片脱蜡至水。苏木素染液染色40 min,水洗,盐酸酒精分色,伊红染液染色1 min,水洗。甲苯胺蓝染液染色30 min,水洗,反梯度脱水透明,封片,半定量分析蛋白多糖含量,并结合HE染色结果行Mankin评分[10]。
2.4 免疫组织化学 切片脱蜡至水,灭活过氧化物酶,微波抗原修复,封闭,分别加入1∶500 AQP1、1∶100 AQP3一抗4 ℃孵育过夜,PBS洗涤;Bio-羊抗小鼠/兔IgG工作液室温孵育
30 min,洗涤;链酶亲和素-POD工作液室温孵育30 min,洗涤;DAB显色,苏木素复染,反梯度脱水透明,封片,镜下观察分析。
2.5 ELISA 血清、ELISA试剂盒恢复至室温备用,严格按照说明书操作,酶标仪450 nm处测OD值。标准曲线为横坐标,OD值为纵坐标,作标准曲线,将OD值代入公式,计算血清IL-1β含量。
2.6 Real-time PCR TRIzol法提取软骨组织总RNA,Nanodrop2000读取OD260/280比值,总RNA逆转录合成cDNA。采用20 μL反应体系,引物见表1,ABI 7500Fast扩增仪,反应条件:
95 ℃预变性30 s,1个循环;95 ℃变性3 s、60 ℃退火30 s,40个循环。测定目标基因Ct值,2-ΔΔCt计算目的基因相对表达量。
2.7 Western Blot 提取软骨组织总蛋白,BCA定量,蛋白变性,上样,SDS-PAGE电泳,转膜,常温封闭,TBST洗涤;分别加入1∶5000 β-actin、1∶1000 AQP1、1∶200 AQP3一抗,4 ℃孵育过夜,洗涤;加入相应二抗,常温孵育1 h,洗涤,BeyoECL化学发光成像,软件分析条带灰度值,计算目的蛋白相对表达量。
2.8 统计学方法 采用SPSS 22.0软件进行统计分析。计量资料符合正态分布以表示,采用单因素方差分析;不符合正态分布采用非参数检验。以P < 0.05为差异有统计学意义。
3 结 果
3.1 3组病理变化比较 空白对照组软骨表面光滑,未见裂隙、缺损,4层结构清晰,放射层软骨细胞成群分布、柱状排列,软骨细胞囊呈强嗜碱性,基质染色均匀。模型对照组软骨面可见缺损,缺损达移行层、部分可至放射层,缺損下方部分软骨陷窝内未见细胞核,软骨数量减少,排列尚规则、未见明显紊乱,细胞囊、软骨基质未见明显苏木素着色,OA建模成功,处于病变早期。与模型对照组比较,塞来昔布组软骨面较光滑,未见明显缺损,软骨细胞数量稍多,排列较规则,基质染色较均匀。见图1。
3.2 3组蛋白多糖表达量比较 空白对照组软骨基质甲苯胺蓝深染、呈深蓝色,染色均匀,显示蛋白多糖含量丰富。模型对照组软骨全层染色重度减弱,未见明显着色、染色分布不均,与空白对照组比较,模型对照组含量显著降低(P < 0.01),蛋白多糖大量丢失。塞来昔布组较模型对照组深染,以放射层深处较为显著,与模型对照组比较,塞来昔布组蛋白多糖含量略增,但差异无统计学意义(P > 0.05)。见图2、表2。
3.3 3组Mankin评分比较 每个样本随机选取相同倍数下5个不同视野,HE染色结合甲苯胺蓝染色结果做Mankin评分,对病程分期:0~
4分为Ⅰ期,5~8分为Ⅱ期,9~11分为Ⅲ期,12~14分为Ⅳ期。空白对照组Mankin得分最低,近似为零;与空白对照组比较,模型对照组得分显著升高(P < 0.01);与模型对照组比较,塞来昔布组得分降低(P < 0.05)。见表3。
3.4 3组软骨组织AQP1、AQP3表达变化比较 空白对照组AQP1主要分布移行层、放射层浅层细胞膜和细胞质,放射层深层表达较弱。模型对照组AQP1表达显著增强,全层软骨细胞染色增强,切线层损伤区可见阳性表达软骨细胞聚集,移行层、放射层强阳性表达,定位细胞膜和细胞质。塞来昔布组AQP1表达显著增强,全层软骨细胞染色较强,以移行层、放射层较为显著。见图3。空白对照组AQP3主要分布于移行层、放射层浅层细胞膜和细胞质,弱阳性表达。模型对照组移行层软骨细胞聚集、体积增大,细胞质呈强阳性染色,AQP3表达显著增强。塞来昔布组AQP3表达增强,主要分布于移行层软骨细胞质,染色较模型对照组稍弱。见图4。
半定量分析显示,空白对照组AQP1累积光密度最低,与空白对照组比较,模型对照组、塞来昔布组表达显著升高(P < 0.05);与模型对照组比较,塞来昔布组表达差异无统计学意义(P > 0.05)。空白对照组AQP3表达最低,与空白对照组比较,模型对照组、塞来昔布组表达显著升高(P < 0.01);与模型对照组比较,塞来昔布组表达降低(P < 0.05)。
见表4。
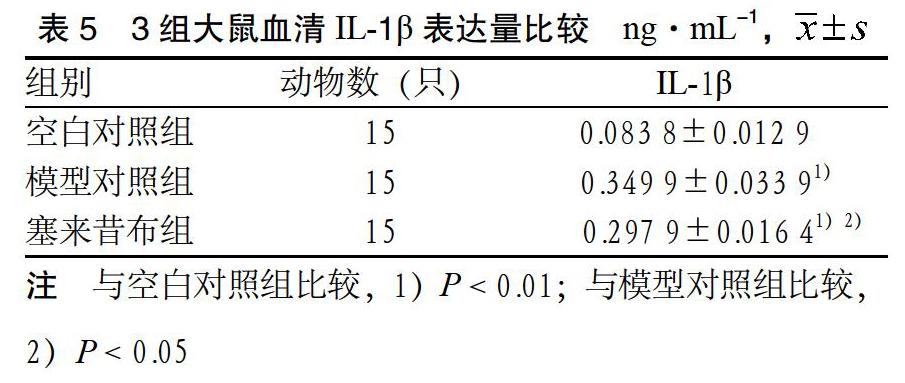
3.5 3组血清IL-1β表达量比较 空白对照组血清IL-1β含量最低,与空白对照组比较,模型对照组、塞来昔布组IL-1β含量均显著升高(P < 0.01);与模型对照组比较,塞来昔布组IL-1β含量降低(P < 0.05)。见表5。
3.6 3组软骨组织AQP1、AQP3 mRNA和蛋白相对表达量比较 与空白对照组比较,模型对照组软骨组织AQP1、AQP3 mRNA相对表达量均显著上升(P < 0.05或P < 0.01)。与模型对照组比较,塞来昔布组AQP1 mRNA表达略低,但差异无统计学意义(P > 0.05);AQP3 mRNA表达下调
(P < 0.01)。见表6。与空白对照组比较,模型对照组AQP1、AQP3蛋白相对表达显著上升(P < 0.01);与模型对照组比较,塞来昔布组AQP1、AQP3蛋白相对表达一定程度下调(P < 0.01)。见表7。
4 讨 论
透明软骨由软骨细胞和细胞外基质组成,软骨细胞负责合成细胞外基质并维持其含量,细胞外基质由有机固相(Ⅱ型胶原纤维、蛋白多糖)和液相(水)等组成,水是基质的重要成分,为软骨组织提供一定的膨胀压,使软骨组织具有刚性和抗变形能力;软骨细胞对渗透压非常敏感,可通过调节自身体积的大小来适应渗透压的改变。软骨组织在负载和卸载过程中,水分子可带走软骨细胞的代谢产物,亦可将关节液中的营养物质带回软骨组织,为软骨细胞提供营养,并提供良好的细胞外环境。
AQPs是疏水性、高度保守的跨膜蛋白,属于主要内源性蛋白质(MIP)家族,是介导水分子被动跨膜转运的物质基础,可增加细胞膜上水的通透性,提供液体快速转运以维持细胞内外的水平衡,目
前研究发现软骨细胞上存在AQP1和AQP3[11-13],
正常软骨组织中基质合成和分解处于动态平衡中,软骨细胞外环境较为稳定,AQPs正常表达。高航飞等[14]发现,大鼠OA模型软骨组织中AQP1 mRNA和Caspase-3 mRNA表达呈正相关,提示AQP1的异常表达可能与软骨细胞凋亡呈正相关,参与OA的病理进程。MENG等[15]发现,大鼠OA模型软骨组织AQP3 mRNA表达上调,AQP3的高表达与软骨周围组织肿胀、关节腔积液有密切关系。本实验结果显示,空白对照组软骨组织蛋白多糖含量丰富、少量表达AQP1和AQP3,流动水分子少,软骨渗透性小,摩擦力较大,流体动力压力大,液相液压是软骨负重的主要形式;模型对照组软骨组织蛋白多糖含量显著降低、AQP1和AQP3分布范围更广并且表达量上升,流动水分子增多,软骨渗透性增强,水分子流动摩擦力减小,液相承重减弱而有机固相承重增加,软骨水肿破坏组织正常结构功能和生物力学性质,导致软骨组织进一步变性。
IL-1β是促炎性细胞因子,生理状态下仅存于个别软骨细胞中,OA患者IL-1β高表达,且与疾病严重程度呈正相关性[16];IL-1β促使一氧化氮、前列腺素E2(PGE2)等物质合成,增强基质金属蛋白酶(MMP)-3、MMP-9和MMP-13表达,抑制软骨细胞增殖并促进其凋亡,增强软骨基质中胶原和蛋白多糖的降解,破坏软骨组织[17-19]。本实验中空白对照组血清IL-1β含量在正常范围之内,而模型对照组血清IL-1β含量显著增加,高达正常水平的3~4倍,循环血液中致炎性细胞因子含量增加,进一步引发关节软骨的炎症反应。
塞来昔布胶囊是最早上市的选择性环氧合酶-2(COX-2)抑制剂,是新一代非甾体抗炎药,传统认为其通过特异性抑制COX-2生成,降低PGE2生成,抑制IL-1、肿瘤坏死因子-α的促炎作用,抗炎镇痛以缓解OA临床症状[20-22]。而近年研究发现,塞来昔布可增加OA患者血清中基质金属蛋白酶组织抑制因子3(TIMP-3)的表达,从而抑制聚蛋白多糖酶1(Agase-1)的活性,减缓关节软骨中蛋白多糖的降解,缓解症状[23]。因此,本实验以水分子跨膜转运为切入点,探讨塞来昔布是否通过调节AQP1、AQP3的表达,降低软骨渗透性而起抗炎消肿作用。结果显示,塞来昔布干预4周后,一定程度抑制血清IL-1β表达,关节软骨面较光滑,软骨基质甲苯胺蓝染色较均匀,Mankin评分较模型對照组略低,表明药物对OA软骨结构和成分具一定保护作用;AQP3表达显著减弱,散在分布于核周细胞质中,分布范围稍小,Real-time PCR、Western Blot显示AQP3表达显著降低,而AQP1降低不显著,表明药物可一定程度下调AQP3的分布范围和表达量。
综上所述,塞来昔布胶囊可降低软骨组织中AQP3的分布范围和表达量,调控水分子跨膜转运功能,降低软骨渗透性以消肿,可能是其治疗OA的潜在作用机制之一。
5 参考文献
[1] 中华中医药学会.骨性关节炎[J].风湿病与关节炎,2013,2(2):71-72.
[2] PRESTON GM,CARROLL TP,GUGGINO WB,et al.
Appearance of water channels in Xenopus oocytes expressing red cell CHIP28 protein[J].Science,1992,
256(5055):385-387.
[3] MOBASHERI A,MARPLES D.Expression of the AQP-1 water channel in normal human tissues:a semiquantitative study using tissue microarray technology[J].Am J Physiol Cell Physiol,2004,286(3):529-537.
[4] 程加峰,耿家金,赵平,等.水通道蛋白3在膝骨关节炎患者退变关节软骨细胞中的表达及意义[J].中国骨与关节损伤杂志,2014,29(5):465-467.
[5] 袁普卫,何辉,康武林,等.膝骨性关节炎患者滑膜水通道蛋白-1表达与血管生成的相关性研究[J].中国矫形外科杂志,2015,23(11):1025-1032.
[6] 唐进,吉明,徐立新.探讨AQP1、AQP3及IL-1β在膝关节炎滑膜中的表达及意义[J].陕西医学杂志,2017,46(12):1749-1750,1752.
[7] 段文秀,汪宗保,张浩,等.木瓜蛋白酶诱导早期膝骨关节炎模型大鼠软骨超微结构的动态变化[J].中国组织工程研究,2015,19(18):2789-2793.
[8] 汪宗保,徐亚林,廖威明,等.木瓜蛋白酶诱导大鼠膝早期骨关节炎软骨表面的电镜扫描[J].中国组织工程研究,2014,18(2):177-182.
[9] 赵伟,孙国志.不同种实验动物间用药量换算[J].畜牧兽医科技信息,2010,26(5):52-53.
[10] MANKIN HJ,DORFMAN H,LIPPIELLO L,et al.Biochemical and metabolic abnormalities in articular cartilage from osteoarthritic human hips.Ⅱ.Correlation of morphology with biochemical and metabolic data[J].J Bone Joint Surg Am,1971,53(3):523-537.
[11] MOBASHERI A,WRAY S,MARPLES D.Distribution of AQP2 and AQP3 water channels in human tissue microarrays[J].J Mol Histol,2005,36(1/2):1-14.
[12] 秦彦国,谷长跃,姜彤伟.退变关节软骨中水通道蛋白的表达差异及其意义[J].中国实验诊断学,2009,13(6):802-803.
[13] 李绍波,张永涛,杨开舜.水通道蛋白1和3在腰椎间盘退变组织中的表达[J].中国组织工程研究,2012,16(48):9034-9038.
[14] 高航飞,任戈亮,徐燕,等.骨性关节炎水通道蛋白1
的表达与软骨细胞凋亡相关性研究[J].中国修复重建外科杂志,2011,25(3):279-284.
[15] MENG JH,MA XC,LI ZM,et al.Aquaporin-1 and aquaporin-3 expressions in the temporo-mandibular joint condylar cartilage after an experimentally induced osteoarthritis[J].Chinese Medical Journal,2007,120(24):2191-2194.
[16] 何启荣,林伟文.关节液中TNF-α、IL-1、MMPs水平对膝骨性关节炎患者的预后的评估价值[J].中国医学创新,2016,13(21):1-4.
[17] 程晓平,林炜,陈兆榕.独活寄生汤含药血清抑制IL-1β诱导的软骨细胞炎症反应的机制研究[J].风湿病与关节炎,2017,6(4):5-8.
[18] ZHANG Z,LEONG DJ,XU L,et al.Symptoms in a post-traumatic Osteoarthritis mouse model[J].Arthritis Research Ther,2016,18(1):128.
[19] 黄媛霞,徐海斌,郭春.白细胞介素-1β、肿瘤坏死因子α及基质金属蛋白酶13在骨性关节炎中的表达及相关性[J].广东医学,2017,38(15):2301-2304.
[20] 肖超,陈臣,陈荣富,等.塞来昔布对膝骨关节炎患者血清IL-1及TNF-α水平的影响[J].重庆医学,2015,44(5):700-702.
[21] 杨安忠,姚勇,吴昊,等.塞来昔布对骨关节炎患者相关炎性因子影响[J].中华实用诊断与治疗杂志,2018,32(4):382-384.
[22] 奕兵,王超.塞来昔布对老年膝骨性关节炎患者炎症因子、骨代谢和血液流变学指标的影响[J].中国老年学杂志,2018,38(19):4713-4715.
[23] 刘甬民,冯智英,顾鹏程,等.塞来昔布影响聚蛋白多糖酶在骨关节炎患者血清中的表达[J].中国疼痛医学杂志,2011,17(11):670-673.
收稿日期:2019-05-26;修回日期:2019-07-21
