HPLC-MS/MS测定大鼠血浆中的叶酸浓度及其药动学研究
2019-12-19逯海燕刘爱明徐玲玲贾庆文王本伟
戚 敏,王 芳,逯海燕,刘 琳,刘爱明,徐玲玲,陈 凯,贾庆文,王本伟
(山东省药学科学院 新药评价中心,山东 济南 250101)
叶酸是一种水溶性维生素,其母体化合物是由喋啶、对氨基苯甲酸和谷氨酸3种成分结合而成的。叶酸在人体内主要参与嘌呤和嘧啶核苷酸的合成和转化,参与构成含铁的血红蛋白,参与蛋白质的代谢等,是细胞生长和繁殖所必需的物质[1-2],临床可用于预防神经管畸形,还可用于治疗慢性萎缩性胃炎、抑制支气管鳞状转化及防治高同型半胱氨酸血症引起的冠状动脉硬化症、心肌损伤与心肌梗塞等[3-4]。研究表明叶酸还能抑制肿瘤细胞中癌基因的表达,从而阻断恶性肿瘤的进展[5],但有研究认为过量摄入叶酸可能会增加发生乳腺癌的风险[6-8],因此准确定量血中叶酸含量的尤为重要。目前叶酸在机体内的检测主要有微生物测定法[9]、放射免疫测定法、色谱分析法[10]等,这些方法在专属性、灵敏度等方面都存在一定的局限性,且样品用量比较大,处理也较费时费力。本研究基于高效液相色谱和三重四极杆质谱技术的联用(HPLC-MS/MS)建立了一种灵敏度高、重现性好、分析速度快的新型叶酸检测方法,并用于药动学研究,为其临床用药提供有益的参考。
1 仪器、试剂与动物
1.1 仪器
Agilent 1260-6430液相质谱联用系统(LCMS/MS,安捷伦),包括G1379B型脱气机,G1312B型二元输液泵,G1367E型自动进样器,G1330B型控温模块,G1316A型柱温箱,6430 MS/MS系统及Mass Hunter数据采集软件;XL16K-T台式高速冷冻离心机(湖南湘立科学仪器公司);Advantage A10 Milli-Q超纯水机[默克化工技术(上海)公司];Vortex Genius 3涡旋仪(广州仪科实验技术公司)。
1.2 试剂
叶酸(批号:100074-201214,纯度89.7 %),格列本脲(批号:100135-201105,内标,纯度99.5 %,中国食品药品检定研究院);乙腈(批号:154451,色谱纯,Fisher scientific);甲酸(批号:BCBM5443V,色谱纯,Sigma-Aldrich);二甲亚砜(分析纯,国药集团);超纯水。
1.3 动物
SD大鼠24只,体重180~220 g,由北京维通利华实验动物有限公司提供[动物许可证号:SCXK(京)2012-0001],在温度25 ℃、湿度60 %±5 %条件下适应1周。随机分成3组,每组8只,雌雄各半,灌胃给予叶酸溶液,给药剂量分别为0.8,2.4,8 mg/kg体重。给药前12 h禁食,自由饮水。分别于给药前,给药结束0.5,1,2,4,6,8,24 h颈静脉取血0.2 ml,置入预涂肝素钠的离心管,4℃、4000 r/min离心10 min,取上层血浆,-20 ℃冰箱中保存备用。
2 方法学验证
2.1 HPLC-MS/MS条件
色谱条件:色谱柱为Thermo Accucore C18柱(50 mm×2.1 mm,2.6 μm);流动相为0.1 %甲酸-水(A)与乙腈(B),洗脱梯度:0~0.5 min,5 % B;0.5~2.2 min,5 %→95 %B;2.2~3.2 min,95 %B;3.21~6 min,5 %B。样品检测时间:6 min;流速:0.4 ml/min;进样量:5 μl;柱温:40 ℃。
质谱条件:离子化方式:电喷雾-正离子;干燥气:N2;干燥气流速10 L/min,干燥气压力40 psi,干燥气温度350 ℃,毛细管电压4000 V。监测方式:多反应监测(MRM)。叶酸母离子及子离子为m/z442.2→295.1,碎片电压100 V,碰撞能量10 eV;格列本脲母离子及子离子为m/z494.2/369.0,碎片电压130 V,碰撞能量9 eV。
2.2 溶液配制
精密称取叶酸10 mg,置入10 ml量瓶,加二甲亚砜5 ml超声溶解,乙腈定容至刻度,配制浓度为1.0 mg/ml的储备液 ,加乙腈稀释,分别配制不同浓度的叶酸溶液。精密称取格列苯脲10 mg,置入10 ml量瓶,乙腈溶解并定容至刻度,配制浓度为1.0 mg/ml的内标储备液。
2.3 样本处理方法
取血浆样品30 μl,置入1.5 ml离心管,加入乙腈(含内标50 ng/ml)150 μl,涡旋混匀1 min,加超纯水100 μl,涡旋混匀1 min,12 000 r/min 4 ℃,离心5 min,取上清进样检测。
2.4 专属性
取空白血浆30 μl,按2.3项方法操作,得空白质谱图(见图1A);取1000 ng/ml的叶酸溶液10 μl,加空白血浆90 μl,涡旋后取30 μl,按2.3项方法操作,得分析物质谱图(见图1B);取给药后2 h的血浆样品30 μl,按2.3项方法操作,得血浆样品质谱图(见图1C)。叶酸和内标的保留时间分别为2.58,3.63 min,内源性物质不干扰待测物的准确定量。
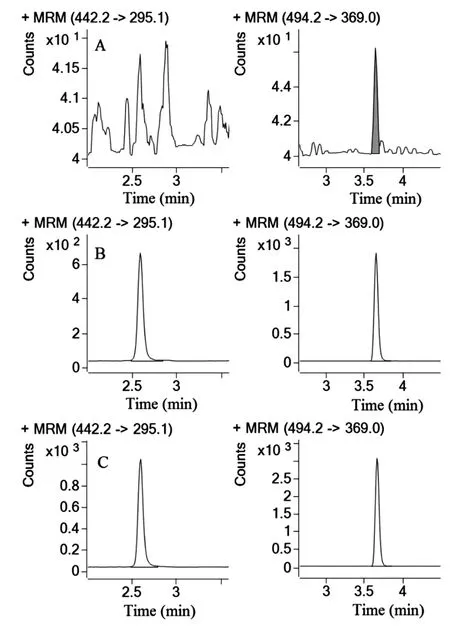
图1 叶酸和内标物质谱图
2.5 残留效应
在进样标准曲线浓度最高点后进样空白样品,评价残留效应,结果显示叶酸的残留量小于定量下限的10 %,说明残留不影响叶酸的准确定量。
2.6 线性和定量下限
分别配制10,25,50,100,250,500,1000 ng/ml的血浆样本溶液,按2.3项方法操作处理。以叶酸的浓度为横坐标(X),叶酸与内标物的峰面积比值为纵坐标(Y),用加权最小二乘法(权重为1/X2)进行回归运算,求得的直线方程即为标准曲线。回归方程为Y=0.1272(±0.0050)X+0.0056(±0.0021),r=0.9971,表明叶酸在10~1000 ng/ml范围内线性关系良好。取浓度为10 ng/ml的血浆样本,按2.3项方法操作处理,进样检测,平行测定6个样本。结果准确度为89.1 %,精密度为6.0 %。均符合生物样本的检测要求。
2.7 准确度和精密度
分别配制定量下限(10 ng/ml)、低(20 ng/ml)、中(80 ng/ml)、高(800 ng/ml)4个浓度的血浆标准样本溶液,按2.3项方法操作,每一浓度5个平行样本,以标准曲线算得叶酸的浓度,并计算其批内准确度和精密度。连续处理3个分析批,计算叶酸的批间准确度和精密度。结果见表1。

表1 叶酸的批内和批间准确度与精密度(n=5)
2.8 回收率和基质效应
分别配制低(20 ng/ml)、中(80 ng/ml)、高(800 ng/ml)3个浓度的标准溶液,每一浓度6个平行样本,按2.3项方法操作,得到的峰面积为set1。分别配制低(20 ng/ml)、中(80 ng/ml)、高(800 ng/ml)3个浓度的血浆样本溶液,每一浓度6个平行样本,按2.3项方法操作,得到的峰面积为set2。分别取低(20 ng/ml)、中(80 ng/ml)、高(800 ng/ml)3个浓度的标准溶液30 μl,加入提取后的空白血浆溶液150 μl,再加入100 μl水,涡旋混匀,每一浓度6个平行样本,进样检测,峰面积为set3。以set3/set1计算基质效应;以set2/set3计算提取回收率。结果见表2。
表2 叶酸和内标的回收率和基质效应(,n=6)

表2 叶酸和内标的回收率和基质效应(,n=6)
化合物 理论浓度/ng·ml-1回收率/%基质效应/%叶酸 20 80.0±4.1 102.9±4.4 80 95.4±4.4 103.0±5.6 800 93.0±4.7 104.8±5.1内标 50 95.6±5.1 93.5±3.2
2.9 稳定性考察
分别配制低(10 ng/ml)、中(100 ng/ml)、高(800 ng/ml)3个浓度的血浆标准样本溶液,每一浓度6个平行样本,分别考察3个冷冻(-20 ℃)-解冻(室温)周期稳定性、室温短期6 h稳定性、长期30 d稳定性(-20 ℃)和样品制备后在自动进样器15 ℃放置24 h稳定性。结果见表3。

表3 叶酸的稳定性(n=6)
2.10 药动学结果
大鼠血浆样本从冰箱取出,室温解冻,取30 μl,置入1.5 ml离心管,按2.3项方法操作,依随行标准曲线计算血浆样本的浓度。用DAS3.0软件采用非房室模型计算药动学参数。结果见表4和图2。
3 讨论
3.1 空白血浆的选择
由于叶酸是内源性化合物,空白血浆可能会产生干扰,因此在方法学验证中对大鼠空白血浆进行了筛选,最终选择不干扰叶酸准确定量(干扰较小)的空白血浆进行方法学验证。
表4 大鼠灌胃给予叶酸溶液后药动学参数( ,n=8)

表4 大鼠灌胃给予叶酸溶液后药动学参数( ,n=8)
参数 剂量/mg·kg-1 0.8 2.4 8 Cmax/ng·ml-1 157.4±69 259.9±126 335.0±98 Tmax/h 0.8±0.3 1.1±0.5 1.4±0.6 t1/2/h 5.4±1.2 5.1±1.2 4.4±0.9 AUC0-24 h/h·ng·ml-1 710.0±176 1092.1±567 2047.8±654 AUC0-∞/h·ng·ml-1 791.0±199 1156.0±563 2234.2±717 AUC0-24 h/AUC0-∞/% 89.8 94.5 91.7
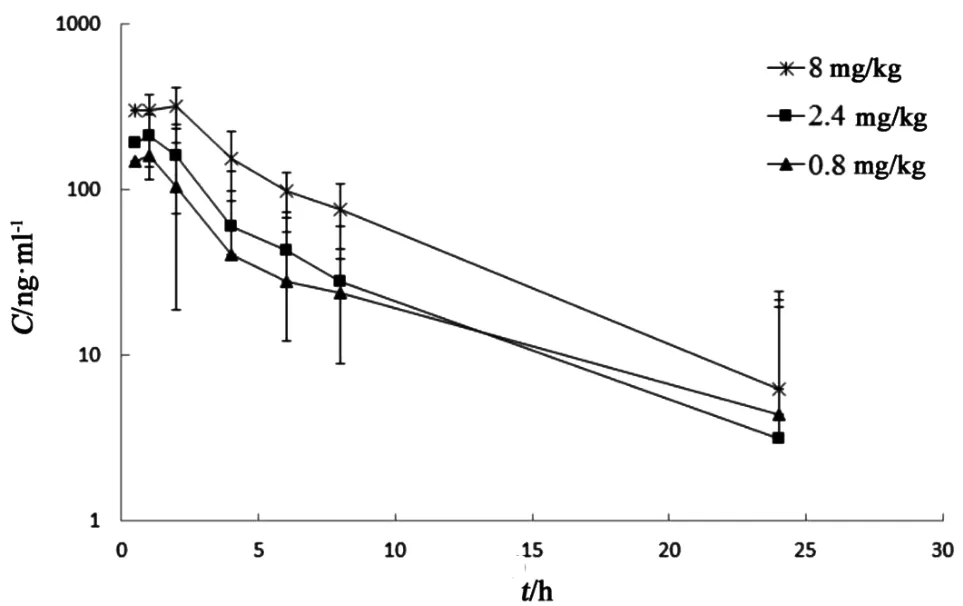
图2 大鼠灌胃给药后血浆中平均药物浓度-时间曲线
3.2 色谱条件优化
本研究对不同的流动相和色谱柱进行了考察,最终选择乙腈和0.1 %的甲酸-水做为流动相,梯度洗脱;色谱柱选择Thermo Accucore C18柱(50 mm×2.1 mm,2.6 μm);具有较好的分离度和色谱峰型,且血浆中内源性化合物不会干扰分析物和内标的离子化。
叶酸和内标格列本脲的质谱参数采用Agilent optimizer软件自动优化,获得的离子对、碎片电压和碰撞能量均能满足方法灵敏度要求。
3.3 血浆样本处理方法的优化
叶酸是水溶性维生素,极性相对较大,采用血浆加有机溶剂的蛋白沉淀方法进行预处理,叶酸的回收率小于10 %,重现性较差。固相萃取方法虽能满足方法学要求,但处理过程繁琐、耗时,成本高。我们在研究中发现采用有机溶剂进行蛋白沉淀后添加适量的纯化水,叶酸的回收率达80 %。因此在本研究中样本处理方法采用在蛋白沉淀后添加水的方式,既能保证方法的重现性,又可提高检测效率。
3.4 药动学结果
由于大鼠血浆中存在叶酸,因此本研究选择先扣除零点基线,再进行药动学参数统计。大鼠灌胃给药后叶酸在1 h左右达到最大浓度,且随着给药剂量的增加达峰时间有延后的趋势。Cmax和AUC0-∞在低、中、高3个剂量下的比值分别为1:1.7:2.1和1:1.5:2.9,叶酸在大鼠体内的最大血药浓度和暴露量随剂量的增加而增大,但和剂量不成线性相关。低、中、高3个剂量下AUC0-24h和AUC0-∞的比值均在90 %左右,说明采样点设计较合理,采集24 h内的血浆样品能满足对药动学参数的评估。
本研究基于HPLC-MS/MS技术建立了大鼠血浆中叶酸的分离分析方法,并进行了方法学考察,成功应用于SD大鼠灌胃给予叶酸溶液后血浆中叶酸的浓度检测。此方法血浆用量少,灵敏度高,重现性好。
