土荆皮化学成分及其抗黄嘌呤氧化酶活性研究
2019-12-19杜洪芳贾献慧赵焕新肖成梅王子潇杜成林唐文照
杜洪芳,贾献慧,赵焕新,肖成梅,蔡 敏,王子潇,杜成林,唐文照*
(1.济南大学 山东省医学科学院 医学与生命科学学院,山东 济南 250200;2.山东省医学科学院 药物研究所国家卫生部生物技术药物重点实验室 山东省罕少见病重点实验室,山东 济南 250062)
土荆皮又名土槿皮、荆树皮、金钱松皮,是松科植物金钱松(Pseudolarix kaempferiGord.)的干燥根皮或近根树皮,是《中华人民共和国药典》收载的常用中药,具有杀虫、止痒、治癣疥等功效,分布于江苏、安徽、浙江、江西等地长江中下游温暖地区 。研究发现土荆皮中含二萜、三萜、甾体、挥发油、有机酸和酚类化合物,其中以土荆皮乙酸(pseudolaric acid B)为主的二萜类化合物具有抗癌、抗肿瘤、抗炎、抗血管生成等作用[1]。
在筛选治疗痛风疾病的中草药过程中,我们发现土荆皮的乙醇提取物具有抗黄嘌呤氧化酶活性,利用柱层析法,从活性最强的乙酸乙酯部位分离得到13个化合物,主要为土荆皮二萜酸与多酚(酸)类物质,分别是土荆皮乙酸(1),土荆皮甲酸(2),土荆皮丙酸(3),土荆皮乙酸甲酯(4),土荆皮乙酸乙酯(5),土荆皮乙酸葡糖苷(6),杨梅素(7),二氢去氢二愈创木基醇(8),罗汉松脂素(9),cedrusin(10),ligraminol E(11),原儿茶酸(12),3, 5-二羟基-2-[2-(4-羟苯乙酰基)]苯甲酸 (13),其中化合物8,11,12,13为首次从金钱松植物中分离得到。黄嘌呤氧化酶抑制活性实验结果显示,除了土荆皮乙酸(1)具有一定的活性[半数抑制浓度(IC50)=0.85 mmol/L]外,其他5种土荆皮二萜酸的活性均较弱。多酚(酸)类物质的活性较高,其中化合物7,12,13的IC50分别为 0.32,0.38,0.29 mmol/L,土荆皮所含的多酚(酸)类化合物应为其抗黄嘌呤氧化酶活性的物质基础。
1 仪器与材料
1.1 仪器与分离材料
Bruker AVANCE 600 MHz 核磁共振波谱仪(TMS为内标),Agilent Trap VL型质谱仪,Agilent 1200 series 高效液相色谱仪(美国安捷伦);岛津LC-20AR型高效液相色谱仪(日本岛津公司);制备色谱柱ODS-A(21.2 mm× 250 mm,5 μm,YMC公司),C18分析色谱柱(4.6 mm× 250 mm,5 μm,美国安捷伦),柱层析硅胶,薄层色谱硅胶GF254 (青岛海洋化工厂);Sephadex LH-20 (Amersham Biosciences公司);ODS柱色谱填料(50~75 μm,YMC公司)。
1.2 药材与试剂
土荆皮于2017年10月购自济南山东建联盛嘉中药有限公司,产地为湖北荆门。黄嘌呤氧化酶(Sigma);别嘌呤醇(阿拉丁);黄嘌呤(阿拉丁);甲醇,乙腈(色谱纯,Tedia),其他有机试剂均为国产分析纯。
2 实验过程
2.1 提取与分离
干燥土荆皮5 kg,粉碎,用70 %乙醇(10 L)回流提取2次,每次2 h。提取液合并,减压浓缩,得浓浸膏280 g,浓浸膏加热水溶解,依次用石油醚 (5 L)、乙酸乙酯 (5 L)和正丁醇 (5 L)各萃取3次,乙酸乙酯萃取液减压浓缩,得乙酸乙酯萃取物64 g。乙酸乙酯经硅胶柱层析 (200~300目,1200 g),石油醚/乙酸乙酯(10:1→7:3)、二氯甲烷/甲醇(8:2→6:4)梯度洗脱,相同部分合并,得16个流份 (Fr.1~Fr.16),Fr.11和Fr.13用甲醇重结晶得化合物1 (1.3 g),2 (0.2 g)。Fr.4 经ODS柱层析,甲醇/水 50:50→100:0梯度洗脱,得SFr.1~10 10个流份,SFr.2再次经ODS柱层析(甲醇/水,30:70→ 100:0),制备HPLC纯化得化合物4(20 mg),6(30 mg),9(11 mg),11(23 mg)。SFr.4经重结晶得到化合物3(30 mg)。SFr.7经制备HPLC (乙腈/水,70:30)纯化得化合物5(28 mg)。Fr.7 经ODS柱层析 (甲醇/水,40:60→100:0洗脱),得SFr.1~10 10个流份,SFr.6经制备HPLC纯化(甲醇/水,55:45),得化合物7(70 mg)。SFr.3经Sephadex LH-20凝胶柱层析,甲醇洗脱,得4部分,其中第2部分经制备HPLC纯化(甲醇/水,40:60),得化合物12(35 mg),13(9.7 mg)。SFr.4经制备HPLC纯化(MeOH/H2O,35:75),得化合物10(60 mg)。Fr.10 再次进行硅胶柱层析 (200~300目,200 g),二氯甲烷/甲醇(10:1→7:3) 梯度洗脱,得SFr.1~44个流份,SFr.2经制备HPLC纯化(甲醇/水,75:25),得化合物8(9 mg)。
2.2 抗黄嘌呤氧化酶活性实验
本实验体外筛选化合物抗黄嘌呤氧化酶的活性采用HPLC,以反应体系中的底物黄嘌呤在反应前后的含量变化为指标,考察化合物对黄嘌呤氧化酶的抑制作用,具体过程参考实验室此前建立的测定方法[2]。
3 结果
3.1 结构鉴定
化合物1:白色无定形粉末,ESI-MS:m/z433.5[M+H]+,分子式为C23H28O8,1H-NMR数据见表1,13C-NMR数据见表2,NMR数据与文献报道土荆皮乙酸数据基本一致[3],故鉴定化合物1为土荆皮乙酸。
化合物2:白色无定形粉末,ESI-MS:m/z389.3[M+H]+,分子式为C22H28O6,1H-NMR数据见表1,13C-NMR数据见表2,NMR数据与文献报道土荆皮甲酸数据基本一致[3],故鉴定化合物2为土荆皮甲酸。
化合物3:白色无定形粉末,ESI-MSm/z391.3[M+H]+1,分子式为C21H26O7,1H-NMR数据见表1,13C-NMR数据见表2,NMR数据与文献报道土荆皮丙酸数据基本一致[3],故鉴定化合物3为土荆皮丙酸。
化合物4:白色无定形粉末,ESI-MSm/z:447.1[M+H]+,分子式为C24H30O8,1H-NMR数据见表3,13C-NMR数据见表2,NMR数据与文献报道的土荆皮乙酸甲酯数据基本一致[4],故鉴定化合物4为土荆皮乙酸甲酯。
化合物5:白色无定形粉末,ESI-MSm/z:461.5[M+H]+,分子式为C25H32O8,1H-NMR数据见表3,13C-NMR数据见表2,NMR数据与文献报道土荆皮乙酸乙酯数据基本一致[5],故鉴定化合物5为土荆皮乙酸乙酯。
化合物6:白色无定形粉末,ESI-MSm/z:617.3[M+Na]+,分子式为C29H38O13,5 %NaOH水解,薄层色谱(TLC)检出葡萄糖。苷元的1H-NMR数据见表3,13C-NMR数据见表2,葡糖基1H-NMR:δ 5.55(1H, d,J=7.8 Hz,H-1'), 3.84(1H, dd,J=1.8,12.0 Hz,H-6a'), 3.69(1H, dd,J=4.2,12.0 Hz,H-6b'),3.34~3.46(4H, m, H-2' - H-5');13C-NMR:δ 96.1(C-1'), 74.0(C-2'), 78.8(C-3'), 71.1(C-4'), 78.0(C-5'), 62.3(C-6'),NMR数据与文献报道土荆皮乙酸葡糖苷数据基本一致[6],故鉴定化合物6为土荆皮乙酸葡糖苷。

表1 化合物1~3的1H-NMR数据(600 MHz,氘代甲醇)

表2 化合物1~6的13C-NMR数据(150 MHz,氘代甲醇)
化合物7:淡黄色粉末,ESI-MSm/z:341.7[M+Na]+,分子式为C15H10O8,1H-NMR(600 MHz, CD3OD):δ 6.18(1H,br.s,H-6),6.37 (1H,br.s,H-8), 7.35 (2H,br.s,H-2',6')。13C-NMR(150 MHz,CD3OD):δ 94.5(C-8), 99.3 (C-6), 104.6(C-10),108.6(C-2',6'), 123.2(C-1'), 137.4(C-3), 137.0 (C-4'), 146.8(C-3',5'),148.1(C-2), 158.3(C-9), 162.6(C-5),165.6 (C-7), 177.4(C-4)。NMR数据与文献报道的杨梅素基本一致[7],故鉴定化合物7为杨梅素。
化合物8:白色无定形粉末,ESI-MSm/z:383.3[M+Na]+,分子量为360,分子式为C20H24O6,1H-NMR数据(600 MHz,氘代甲醇)与13C-NMR(150 MHz,氘代甲醇)数据见表4,NMR数据与文献报道的二氢去氢二愈创木基醇数据基本一致[8],故鉴定化合物8为二氢去氢二愈创木基醇。
化合物9:白色无定形粉末,ESI-MSm/z:381[M+Na]+,分子量为358,分子式为C20H22O6,1H-NMR数据(600 MHz,氘代甲醇)与13C-NMR(150 MHz,氘代甲醇)数据见表4,NMR数据与文献报道的罗汉松脂素数据基本一致[9],故鉴定化合物9为罗汉松脂素。

表3 化合物4~6的1H-NMR数据(600 MHz,氘代甲醇)
化合物10:白色无定形粉末,ESI-MSm/z:355.7[M+Na]+,分子量为332,分子式为C19H22O6,1H-NMR数据(600 MHz,氘代甲醇)与13C-NMR(150 MHz,氘代甲醇)数据见表4,NMR数据与文献报道的cedrusin 数据基本一致[10],故鉴定化合物10为cedrusin。
化合物11:白色无定形粉末,ESI-MSm/z:385.3[M+Na]+,分子量为362,分子式为C20H26O6,1H-NMR数据(600 MHz,氘代甲醇)与13C-NMR(150 MHz,氘代甲醇)数据见表4,NMR数据与文献报道的ligraminol E数据基本一致[11],故鉴定化合物11为ligraminol E。
化合物 12:白色无定形粉末,溶于甲醇;ESI-MSm/z:155 .2[M+H]+,分子式 C7H6O4。1H-NMR(600 MHz,CD3OD):δ 7.44(1H,br.s,H-2), 7.42 (1H,J=7.8 Hz,H-6),6.80(1H,d,J=7.8 Hz,H-5)。与文献数据对比[12],并与原儿茶酸对照品薄层色谱比较,Rf值一致,故鉴定化合物12 为原儿茶酸。
化合物 13:白色无定形粉末,溶于甲醇;ESI-MSm/z:289.4[M + H]+,分子式 C15H12O6。1H-NMR(600 MHz,CD3OD):δ 7.00(2H,d,J=7.2 Hz, H-2',6'),6.58(2H,d,J=7.2 Hz,H-3',5'),5.75(1H,br.s,H-6),5.72(1H,br.s,H-4),3.05(2H,s,H-8);13C-NMR(150 MHz, CD3OD):δ 103.1(C-1), 107.5(C-2), 159.8(C-3), 96.7(C-4), 171.1(C-5), 91.2(C-6), 196.9 (C-7), 42.8(C-8), 173.8(C-9), 125.8(C-1'), 132.6(C-2',6'), 115.8(C-3',5'),157.3(C-4')。NMR数据与文献报道的3, 5-二羟基-2-[2-(4-羟苯乙酰基]苯甲酸数据基本一致[13]。
3.2 黄嘌呤氧化酶抑制活性
采用HPLC,以酶促反应体系中底物黄嘌呤在反应前后的含量变化为指标,比较各化合物对黄嘌呤氧化酶的抑制作用。结果显示,以别嘌呤醇为阳性对照(IC50:0.053 mmol/L),除土荆皮乙酸(1)具有一定的活性外(IC50: 0.45 mmol/L),其他5种土荆皮二萜酸的活性均较弱。多酚(酸)类物质的活性较高,化合物7~13的IC50值分别为0.32,0.45, 0.48, 0.43, 0.40, 0.38, 0.29 mmol/L,以7, 12, 13的活性较好。
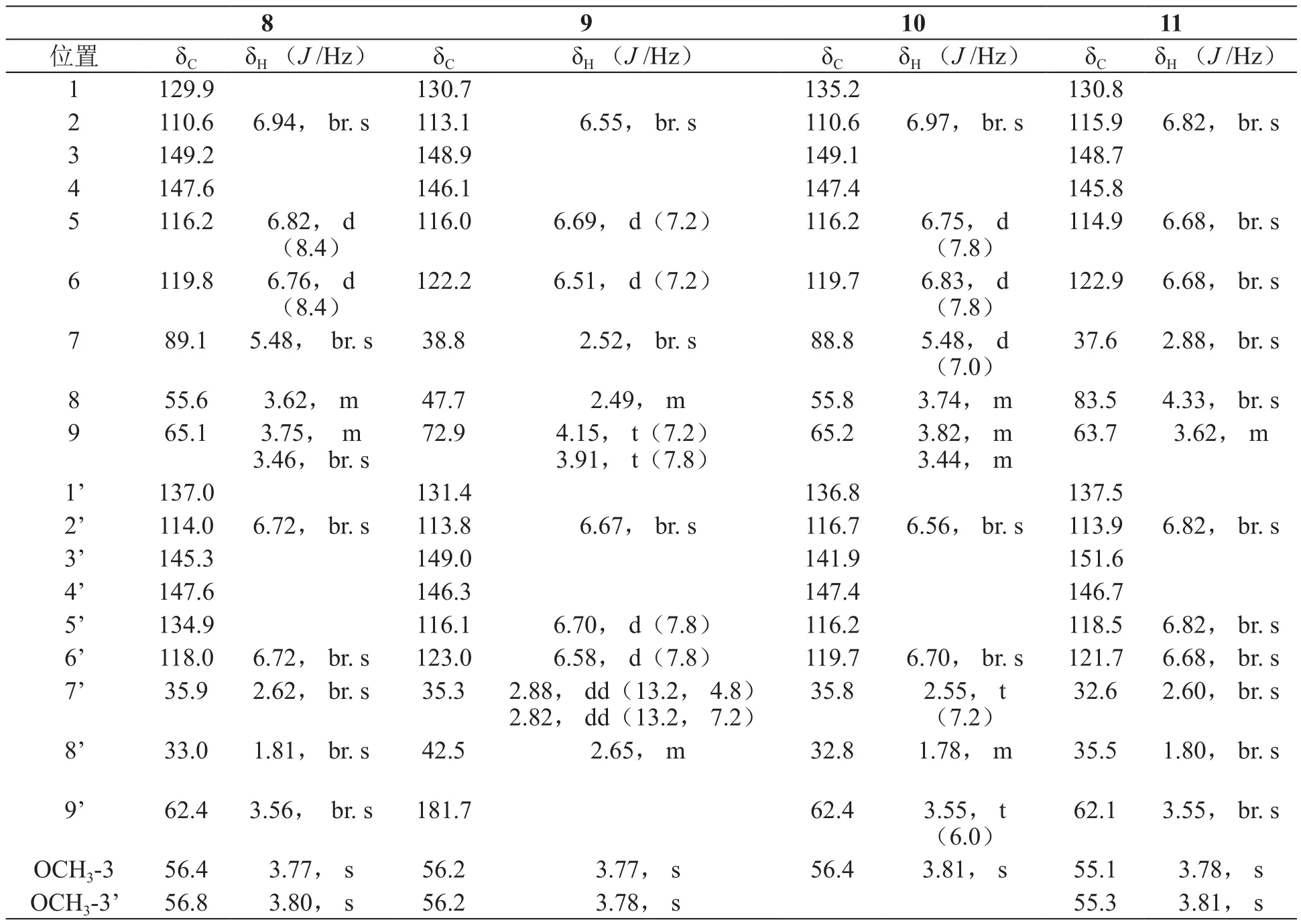
表4 化合物8~11的1H-NMR与13C-NMR数据
4 讨论
土荆皮是一味传统中草药,中医临床用于疥癣瘙痒的治疗,我们发现其具有一定的抑制黄嘌呤氧化酶的活性。活性较好的乙酸乙酯萃取物经成分分离与结构鉴定发现,其主要含土荆皮二萜酸与多酚(酸)类物质,其中多酚(酸)类物质的活性高于土荆皮的代表性成分二萜酸类物质,应为其抗黄嘌呤氧化酶活性的物质基础,这可能与多酚(酸)类物质具有的抗氧化活性有关。土荆皮二萜酸具有反式环合薁骈合六元内酯环的结构骨架,结构新颖,土荆皮乙酸在药材中的含量较高,国内外对其进行了较深入的抗炎与抗肿瘤活性研究,我们首次发现其具有一定的抗黄嘌呤氧化酶的活性,值得对其进行结构修饰,有希望发现活性增强的土荆皮乙酸衍生物。
目前体外筛选黄嘌呤氧化酶抑制剂的方法主要采用紫外分光光度法,由于供试物大多具有紫外吸收,筛选结果准确度不高,有时会出现假阳性或假阴性结果,本文利用HPLC对底物黄嘌呤反应前后含量的变化进行测定,计算待测样品的抑制率,与紫外分光光度法相比较,准确性较高,更能真实反映供试物的活性强弱。
