食用菌子实体采后软化机制的研究进展
2019-12-14丁树东李艳杰
丁树东,李艳杰
(山东理工大学农业工程与食品科学学院,山东淄博 255000)
食用菌(edible fungi)是食用真菌的简称,指那些可供人类食用的大型真菌。近年来我国食用菌产量和产值不断增加,截至2015 年,食用菌产业已成为继粮食、蔬菜、果树、油料之后的第五大产业[1]。食用菌味道鲜美,营养丰富,与其他果蔬等植物性食品相比,具有蛋白质、多糖、维生素含量高,脂肪含量低的特点[2];且食用菌还有一定的生理活性功能,如抗肿瘤[3]、免疫调节[4]和降脂保肝等作用,因此受到广大消费者的青睐。
食用菌采后进行着许多复杂的生理变化及形态学变化,包括水分、营养物质、风味、色泽和质地的变化等。其中子实体软化一直是食用菌采后贮藏领域讨论的焦点。而细胞壁组分的降解及结构的改变被认为是导致子实体质地软化的主要原因。本文通过综述食用菌子实体老化过程中细胞壁组分的降解及结构的改变、细胞壁降解酶与食用菌子实体软化的关系,探讨了食用菌子实体质地软化的机制,为进一步研究食用菌贮运、保鲜提供理论依据。
1 食用菌采后的主要生理变化
食用菌采后呼吸作用和蒸腾作用旺盛,是缺乏保护性的表皮结构,因此极易受到机械损伤和微生物侵染,造成品质下降。食用菌品质的劣变是一个复杂的、多方面生理生化变化参与的综合过程,包括细胞壁的变化、营养物质的消耗、呼吸作用和各种代谢过程。研究表明,室温状态下,食用菌在3~5 d 便会出现褐变、质地变化、开伞、菇柄伸长、出现异味,在贮藏后期甚至出现自溶、腐烂等问题,这些现象大大地降低了食用菌的食用价值和商品价值。其中,质地变化是影响消费者对产品接受性的重要因素[5],主要表现为子实体硬度下降、后熟软化。因此,子实体软化一直是食用菌采后贮藏领域讨论的焦点。
2 食用菌采后软化机理
目前,研究发现采后食用菌软化的原因大致分为细胞壁代谢[6]、活性氧代谢[7]和微生物侵染[8]等方面。其中,细胞壁代谢导致的细胞壁组分的降解及结构的改变被认为是子实体质地软化的主要原因。
2.1 细胞壁组分及结构的变化
食用菌细胞壁是一个动态的环境,具有一定的大小和强度,可以起到维持细胞形态及组织结构稳定、提供机械强度、维持渗透压和细胞间信号介导等作用。与植物细胞壁不同,植物细胞壁以纤维素和果胶成分为主,真菌细胞壁主要是由中性多糖、几丁质和蛋白质组成[9],通常不含有果胶物质[10]。不同类型真菌所含细胞壁多糖类型不同,低等真菌细胞壁多糖以纤维素为主,而包含大部分食用菌在内的高等真菌细胞壁多糖则以几丁质为主[11]。食用菌细胞壁结构独特,由葡聚糖(主要为β-1,3 葡聚糖、β-1,6 葡聚糖、α-1,3 葡聚糖等)、几丁质、糖蛋白和交联蛋白组成的多层复杂组织[12]。在采后软化过程中,食用菌细胞壁组分降解,结构发生改变,此时细胞壁聚合物的溶解度上升[13],这导致细胞塌陷,组织结构松散,最终使食用菌质地品质下降。
2.1.1 细胞壁多糖
(1)细胞壁葡聚糖
葡聚糖是真菌细胞壁的主要成分,约占真菌细胞壁干质量的50%~60%[14]。真菌细胞壁中大多数葡聚糖以带有β-1,6 分支的β-1,3-D-葡聚糖骨架为主链的,通过β-1,3-糖苷键连接形成的葡萄糖分子聚合物[15],少部分葡聚糖是通过β-1,6、β-1,3/-1,4、β-1,4 糖苷键连接形成的。β-1,3 葡聚糖为螺旋状微纤维结构,是食用菌细胞壁葡聚糖的主要成分,它可以同其他细胞壁成分共价交联形成复杂的网状结构,赋予细胞壁一定的弹性和张力[16]。而β-1,6 葡聚糖同样是真菌细胞壁的重要组成成分。与β-1,3 葡聚糖相比,β-1,6 葡聚糖链较短,可以形成交联的无定形结构,对酿酒酵母细胞壁基质的形成发挥重要作用[17]。Jiang 等[18]研究发现,气调包装处理可以显著抑制采后香菇在软化期间细胞壁葡聚糖含量的下降,并认为贮藏期间被降解的细胞壁葡聚糖可作为机体代谢活动碳水化合物的来源。Ni 等[19]发现,采后香菇的细胞壁葡聚糖含量随贮藏期间延长而下降,与此同时,主要细胞壁降解相关酶的活性得到增强,编码与细胞壁降解相关酶的主要基因的表达水平也被上调。
(2)细胞壁几丁质
几丁质是维持食用菌细胞壁稳定的主要结构成分,含量相对较少。它是通过β-1,4 糖苷键连接的由N-乙酰氨基葡糖残基组成的线性大分子聚合物,结构与纤维素相似,具有高度结晶态且不溶于水[20]。真菌细胞壁中几丁质最主要的存在形式为α-chitin[21]。细胞壁中的几丁质具有高强度的氢键,它连接的微纤维具有很强的张力,这对于维持细胞壁的完整性和硬度具有重要的作用[22]。Zivanovic[23]、李顺峰[24]、Jiang 等[18]发现贮藏期间食用菌硬度下降,但几丁质含量不断升高,从而使得双孢蘑菇保持一定韧性。
(3)细胞壁纤维素
纤维素是由β-D-葡萄糖残基通过β-1,4-糖苷键连接成的线性聚合物组成的,纤维素分子之间通过氢键进一步聚合形成含有结晶区和无定形区的微纤丝[25]。纤维素结构稳定,不易被细胞内的水解酶降解,因此其在细胞壁中起着维持细胞形状,提高细胞壁强度的骨架作用[26]。丁树东等[27]研究发现,外源亚精胺处理可以抑制香菇纤维素含量的下降,他认为纤维素含量与硬度呈正相关,这表明纤维素对食用菌质地起着重要的作用。
2.1.2 细胞壁蛋白
细胞壁蛋白(cell wall proteins,CWPs)同样是真菌细胞壁的重要成分,根据功能可分为细胞壁结构蛋白和细胞壁酶蛋白。结构蛋白主要功能包括维持细胞的形态,在细胞迁移和融合时介导粘附,保护细胞免受外来物质的伤害、介导物质的吸收,以及在细胞内传递外界刺激诱导的信号、合成和重构细胞壁组分等[28-29]。研究表明,采后食用菌细胞壁蛋白质由于蛋白酶的作用而被降解为游离氨基酸,用于贮藏后期生理代谢活动以及几丁质的合成[30]。
2.2 降解酶的变化
采后食用菌软化过程中,细胞壁成分、结构变化主要是通过各种细胞壁降解酶的协同作用发生的。一般认为,食用菌细胞壁降解酶主要分为β-葡聚糖酶和几丁质酶两种。
2.2.1 β-葡聚糖酶
β-葡聚糖酶是指能够降解β-1,6、β-1,3、β-1,3/-1,4、β-1,4 葡聚糖的水解酶的总称。根据葡聚糖酶水解的糖苷键连接类型和对特异性底物水解作用方式,可以将β-葡聚糖酶分为外切β-葡聚糖酶和内切β-葡聚糖酶。当外切β-葡聚糖酶水解时,会从葡萄糖链非还原末端按顺序逐个切下葡萄糖残基,生成葡萄糖[31];而当内切β-葡聚糖酶水解时,会在葡萄糖链表面任意位点随机切开糖苷键,生成一些小片段的寡糖[32]。目前,对β-葡聚糖酶结构与功能的研究多集中在酵母菌[33,34]、Corallococcus sp.[35]、Bispora sp.[36]等病原菌上,而食用菌领域研究较少,下面将着重介绍外切-β-1,3 葡聚糖酶、内切-β-1,3 葡聚糖酶、内切-β-1,6 葡聚糖酶和几丁质酶在食用菌采后贮藏中的功能。
(1)外切-β-1,3 葡聚糖酶
外切-β-1,3 葡聚糖酶是一种作用于1,3 糖苷键,切割葡聚糖链生成葡萄糖的多糖水解酶。目前已从酿酒酵母中克隆表征出3 种编码外切-β-1,3 葡聚糖酶的基因,分别是exg1、exg2和ssg1[37]。exg1基因编码两种主要的胞外外切-β-1,3-葡聚糖酶[34],exg2基因编码附着于质膜的外切-β-1,3 葡聚糖酶[38],ssg1基因编码孢子形成特异性外切-β-1,3-葡聚糖酶[39]。
在担子菌类蘑菇中,关于编码基因的外切-β-1,3-葡聚糖酶的信息很少。Sakamoto 等[40]纯化并表征了来自香菇的外切-β-1,3-葡聚糖酶,命名为exg1。exg1是归类于GH5 家族的β-1,3-葡聚糖酶,并且与双孢蘑菇中的外切-β-1,3-葡聚糖酶序列具有高度相似性[41]。试验表明,exg1基因在子实体中特异性表达,但在营养菌丝体中不表达,并且在采后下调;同时,exg1编码蛋白可降解β-1,3-葡聚糖和昆布多糖,但不降解香菇多糖。这些观察结果表明,exg1基因不参与香菇多糖降解或子实体衰老。另一方面,exg1基因在生长的柄中显著表达,因此,exg1可能在香菇子实体的菌柄伸长中起到了一定作用。Sakamoto 等[42]纯化并表征了另一种来自GH55 家族的香菇外切-β-1,3-葡聚糖酶,命名为exg2。实验表明,exg2在采后3 d 显著上调,并具有很高的降解香菇多糖的能力。这些观察结果表明,香菇中的exg2主要与收获后的香菇多糖降解有关。与exg1基因一样,exg2基因也在生长过程中大量表达,这表明exg2可能在菌柄伸长和子实体衰老方面具有双重功能[42]。
(2)内切-β-1,3 葡聚糖酶
目前已从香菇中克隆表征出两种编码内切-β-1,3葡聚糖酶基因,即tlg1和glu1。Sakamoto 等[43]纯化了一种与植物中高度保守的奇异果甜蛋白(thaumatin-like,TL)具有相似性的内切-β-1,3-葡聚糖酶tlg1,并分离出与TL 蛋白具有高度相似性的编码基因tlg1。tlg1表现出β-1,3-葡聚糖结合和β-1,3-内切葡聚糖酶活性。试验表明,tlg1基因在香菇营养菌丝体生长的茎和新鲜子实体中的表达不显著,然而,tlg1在采后在子实体中大量表达;同时,tlg1具有香菇多糖和细胞壁降解活性,这表明tlg1特异性参与了香菇多糖降解和子实体衰老。
随后,Sakamoto 等[44]从采后香菇子实体中分离纯化出另一种内切-β-1,3 葡聚糖酶glu1。glu1作用于昆布多糖时显示出比对香菇多糖更高的水解活性,证明其具有显著的底物特异性。同时,glu1与已知的β-1,3-葡聚糖酶或任何糖苷水解酶没有显著的相似性。此外,氨基酸序列分析显示,glu1与任何先前描述的功能蛋白没有显著的同源性,该酶和其他类似蛋白被分类在新的GH 家族GH128 中。与tlg1基因相似,glu1基因在香菇营养菌丝体和新鲜子实体中的表达不显著,但在采后子实体中大量表达,证明glu1也特异性参与了香菇多糖的降解和子实体的衰老。
(3)内切-β-1,6 葡聚糖酶
Konno 等[45]从采后香菇子实体中纯化了一种属于GH30家族的内切型β-1,6-葡聚糖氢化酶pus30a,其与灰拟鬼伞等担子菌类物种中的β-1,6-葡聚糖酶蛋白质具有高水平的相似性。试验表明,pus30a 基因在采后2~4 d 表达上调;pus30a 对香菇多糖无活性,但可以降解β-1,6-连接的低聚葡糖苷的细胞壁葡聚糖。这表明pus30a 在采后子实体衰老及特异性降解细胞壁多糖方面具有重要意义。
2.2.2 几丁质酶
真菌几丁质酶具有多重生理功能,包括降解外源几丁质、菌丝生长过程中细胞壁重构、菌丝子实体自溶等[46]。Sakamoto 等[47]在采后香菇中鉴定出3 个编码几丁质降解酶的基因,即chi1、chi2和chi3,且3 个基因在采后表达显著上调,表明几丁质酶的表达增加在收获后的子实体衰老中具有重要作用。另外,已经从采后子实体中克隆了编码与几丁质修饰有关的推定酶的其他基因,包括几丁质脱乙酰酶(chd1)和壳聚糖酶(cho1)。据报道,采后香菇子实体中,chd1与cho1基因表达显著上调。与此同时,chi1、chi2和cho1基因与其他担子菌基因没有显著相似性,这表明与其他担子菌相比,香菇具有独特的几丁质和壳聚糖代谢系统[47]。
2.2.3 细胞壁降解酶之间的相互作用
综上所述,包括外切-β-1,3-葡聚糖酶exg2 和内切-β-1,3-葡聚糖酶tlg1 和glu1 在内的细胞壁降解酶参与了收获后的香菇多糖降解。为研究几种细胞壁降解酶之间的相互作用,Sakamoto[6]通过使用pachyman 作为底物分析酶切得到的产物。结果表明(见图1),内切-β-1,3-葡聚糖酶tlg1和glu1会首先缩短香菇多糖的主链长度,形成各种长度的寡糖;然后exg2再将寡糖进一步降解为葡萄糖和二糖;另外pus30a 会切断部分降解的香菇多糖的侧链[6]。因此,采后香菇子实体细胞壁降解是通过多种细胞壁降解酶的协同作用完成的。
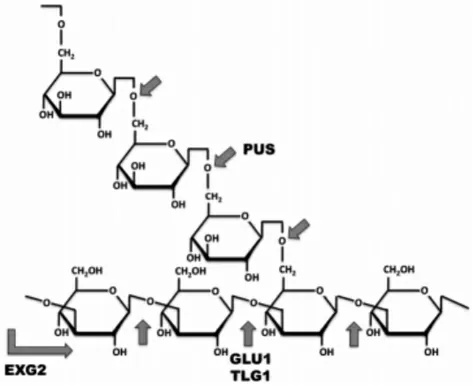
图1 细胞壁中香菇多糖降解机制Fig.1 Degradation mechanism of lentinan in cell wall
2.3 其他方面
活性氧代谢也是食用菌软化的原因之一[7]。活性氧在果实采后贮藏期间不断积累,可以与周围分子发生反应从而引起细胞损伤、破坏核酸结构;同时,活性氧可以启动膜脂过氧化,破坏细胞膜结构并最终促进整个机体的衰老和死亡。目前,已有研究表明,活性氧代谢在龙眼[48]、香蕉[49]等园艺作物的软化过程中起到直接的作用。然而,活性氧代谢与食用菌软化之间的直接关系尚未完全明确。Poovaiah 等[50]认为活性氧代谢对食用菌软化起间接作用,他发现细胞膜的变化与软化之间没有关联,但活性氧代谢诱导的细胞膜完整性的改变与子实体衰老直接存在显著的相关性。Beelman[51]则认为,活性氧代谢诱导的细胞膜完整性丧失可能引起膜通透性的增加,进而导致细胞膨胀压力的降低,间接地降低食用菌质地。
此外,微生物侵染对食用菌软化也起着一定的作用。Nasiri[52]认为微生物通过分解胞内基质和减小中央液泡的体积来改变细胞结构,进而导致细胞部分结构塌陷引起软化。而陈素芹[8]则认为,微生物活动仅可以起到加速食用菌自溶过程的作用,并不是导致双孢蘑菇自溶软化的直接起因。
3 食用菌软化控制机理分析
食用菌的软化被认为是一个多因素调控的综合过程,需要采取适当的采后保鲜措施进行抑制。目前,传统的气调包装处理[18]和化学试剂浸泡处理[53]已经广泛用于食用菌采后品质的研究。值得注意的是,超声波处理[54]、涂膜包装[55]、辐照处理[56]、电解水处理[57]等非热加工技术也逐步应用于食用菌采后生理生化的研究,这为食用菌采后品质的保持提供了新的思路与方式。
本文从食用菌子实体细胞壁组分与结构、细胞壁降解酶两大方面对食用菌子实体软化进行了简要的阐述,这表明食用菌子实体采后软化是一个多方面、多原因的综合协同作用。然而,食用菌存在种类差异性和品种差异性,有的甚至还会存在栽培差异性,这导致食用菌种类之间、品种之间的细胞壁成分和结构存在一定的差异,无法简单地用几种模型作物的细胞壁成分、结构变化情况来反映所有食用菌的细胞壁降解结果及原因;另外,目前基因组测序技术的不完善,食用菌中只有少数菌种完成了测序,这意味着大多数食用菌只能从生理代谢角度来探究子实体软化的原因,而无法进一步通过分子技术来研究各菌种子实体软化的原因。相信随着食用菌“育种-种植-采收-贮运”领域研究的不断深入与分子技术的不断发展,再辅以各种新的分析思路和分析方法,食用菌采后子实体软化的原因一定会进一步阐明。
