大白菜贮藏过程中脂类代谢基因的表达
2019-12-14田少楠刘思佳王拓一
田少楠,刘思佳,王拓一
(齐齐哈尔大学食品与生物工程学院,黑龙江齐齐哈尔 161000)
大白菜是十字花科芸薹属蔬菜作物,原产于我国,同时兼备食用价值与药用价值[1]。据农业部种植业管理司统计数据显示,我国大白菜秋播面积约165 万hm2,居各类蔬菜之首,是最重要的“秋储菜”品种之一。近年来的研究表明,大白菜贮藏过程中损失较大,尤其是营养与风味损失严重[2]。
有学者前期对贮藏过程中的大白菜基因表达进行了转录组分析,发现LIP2和LOX2是脂肪代谢过程中的两个关键调控基因。LIP2基因是从脂溶性酵母Yarrowialipolytica中分离得到的[3],其脂肪酶LIP2是一种优良的脂肪酶,有很高的酯化、水解、转酯活性[4]。脂氧合酶(lipoxygenase,LOX)也称为氧合酶,即亚油酸氧化还原酶,是植物十八碳酸代谢途径的关键酶,广泛存在于高等植物与动物体内,与种子的生长发育、衰老等植物生化、生理密切相关[5-6]。LOX2是植物脂氧合酶多基因家族成员[7-8]。LIP2和LOX2在大白菜贮藏过程中的生理功能尚不明确。因此,开展LIP2和LOX2大白菜贮藏过程中生理功能的研究,旨在提高大白菜在贮藏过程中的品质,同时为大白菜贮藏方式的选择提供技术依据。
1 材料与方法
1.1 材料与试剂
大白菜:购于黑龙江省齐齐哈尔市农贸市场。
试剂:Trizol、三氯甲烷、无水乙醇、异丙醇、盐酸、石油醚(30~60 ℃沸程)、DEPC 处理水、DNAmarker,6×loading buffer、TB GreenTMPremix Ex TaqTMII、PrimeScriptTMRT reagent Kit、琼脂糖、Super GelRed、50×TAE 缓冲溶液、qRT-PCR 引物。
1.2 仪器与设备
DYY-10C 电泳仪,北京市六一仪器厂;CFX96 Real-Time PCR 仪,Bio-Rad 公司;BS-223-S 电子分析天平,常州润华电器有限公司;TD5Z 冷冻离心机,盐城市凯特实验仪器有限公司;P70D20TJ-D3 微波炉,格兰仕微波炉电器邮箱公司;WD-9403C 紫外分析仪,北京市六一仪器厂;HH-S 型水浴锅,巩义市予华仪器有限责任公司;101-1-BS 电热恒温鼓风干燥箱,上海跃进医疗器械厂。
1.3 试验方法
1.3.1 大白菜叶、根的总RNA 提取
称取0.1 g 大白菜叶组织和根组织放入1.5 mL RNase-free EP 管中,分别在两支EP 管中加入0.5 mL Trizol 试剂,冰上进行研磨后,按照Trizol 试剂盒提取RNA 步骤进行分离提取,70%乙醇洗涤后离心得到RNA,室温干燥沉淀;加入20 μL DEPC 处理水溶解,取1 μL RNA 样品进行电泳检测,紫外分光光度测量RNA 浓度,并于-80 ℃进行保存。
1.3.2 cDNA 的合成
根据5×PrimeScript RT Master Mix 6 μL、RNA 4 μL、ddH2O 10 μL 配置20 μL 标准反应体系;混合均匀后离心,反应条件为37 ℃、30 min,85 ℃、5 s,4 ℃无限循环,反应循环数为40 个;反转录合成的cDNA 稀释10 倍使用。
1.3.3 Real-time qPCR 分析
用Real-time qPCR 检测大白菜叶部和根部差异表达mRNA 的表达量。反应体系包括5 μL TB-Green、0.5 μL PCR Forward Primer(10 μmol)、0.5 μL PCR Reverse Primer(10 μmol)、3 μL ddH2O、1 μL 样品cDNA,构成总体积为10 μL 反应体系。反应条件为95 ℃30 s,95 ℃、5 s,60 ℃、10 s,40 个PCR 循环,采用默认设置自动生成Ct值。每个样品设置3 个重复,用相对定量2-ΔΔCt 法计算分析基因的表达水平。
1.3.4 基因引物序列
基因序列来自brassicadb.org,并利用NCBI-BLAST进行对比。基因引物序列获取自https://biodb.swu.edu.cn/qprimerdb/primers,并利用NCBI-Primer-BLAST 进行验证[9],见表1。
1.3.5 大白菜脂肪提取
参考GB 5009.6-85 对食品脂肪的检验方法,选择酸水解法,并根据郭盛斌[10]的改进方法进行操作。称取样品约2 g 于50 mL 大试管中,对样品进行酸水解、脂肪提取,依据公式计算出脂肪含量。
2 结果与分析
2.1 大白菜中脂肪代谢基因在光照与黑暗条件下的表达
2.1.1 大白菜中LIP2基因在光照与黑暗条件下的表达
如图1、图2 所示,大白菜叶部和根部LIP2基因mRNA 表达量在黑暗条件下均随贮藏时间的增加而增加,并且在脂肪含量测定中叶部在光照和黑暗条件下随贮藏时间增加而下降,仅根部在黑暗条件下增加。由此,可以推断LIP2基因在贮藏过程中可能具有脂肪代谢作用。王景乐[11]研究也指出,LIP2基因对于脂合成、脂水解、脂交换等均具有重要的催化作用,这与本研究的结果一致。
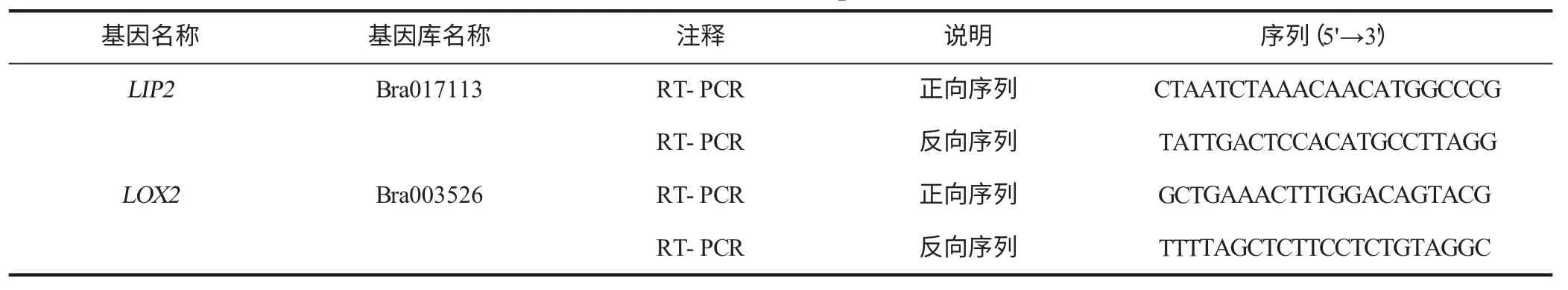
表1 引物序列表Table 1 List of primers
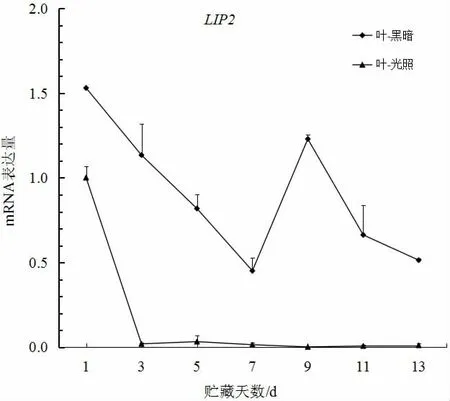
图1 大白菜LIP2 基因叶部在光照和黑暗条件下的表达Fig.1 The expression of LIP2 gene in leaves under light and night condition in Chinese cabbage
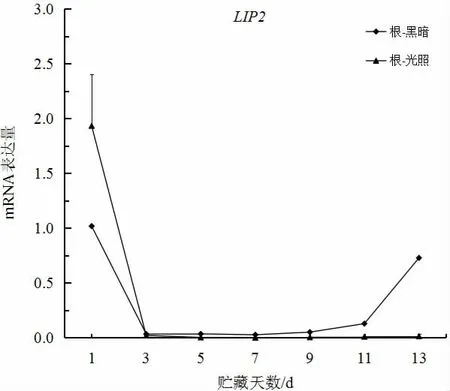
图2 大白菜LIP2 基因根部在光照和黑暗条件下的表达Fig.2 The expression of LIP2 gene in roots under light and night condition in Chinese cabbage
2.1.2 大白菜中LOX2基因在光照与黑暗条件下的表达
如图3、4 所示,大白菜在贮藏过程中叶部和根部的LOX2基因mRNA 表达量在黑暗条件下比在光照条件下高,且随贮藏时间增加而增加。在脂肪含量测定过程中,叶部和根部的脂肪含量处于下降趋势。因此,可以推断LOX2基因在贮藏过程中对脂肪起到了一定的代谢作用。同时,有研究表明,LOX表达可导致细胞膜功能紊乱,通过多不饱和脂肪酸的过氧化作用导致细胞破坏,并且LOX可能参与乙烯刺激和生产的反馈回路,从而促进成熟过程[12-13]。ERIN BELL 等[14]的研究表明,LOX的同工酶主要在叶片以外的组织中表达,这与本研究结果较为一致。由此,可以推断大白菜LOX2基因可能为其脂肪代谢基因。
图3 大白菜LOX2 基因叶部在光照和黑暗条件下的表达Fig.3 The expression of LOX2 gene in leaves under light and night condition in Chinese cabbage
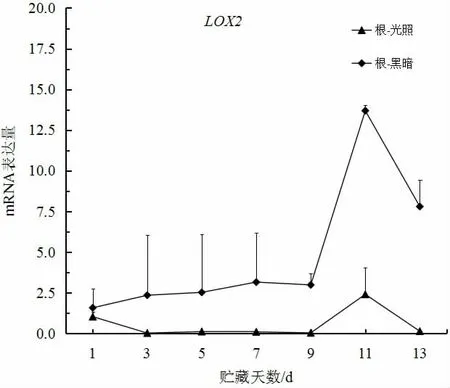
图4 大白菜LOX2 基因根部在光照和黑暗条件下的表达Fig.4 The expression of LOX2 gene in roots under light and night condition in Chinese cabbage
2.2 大白菜在光照和黑暗条件下贮藏过程中的脂肪含量
图5(见下页)为大白菜叶部与根部在光照和黑暗条件下脂肪含量的表达。根据基因表达差异分析,可以得出在光照贮藏条件下,叶部P=0.011 835(图5A),根部P=0.749 379(图5B),大白菜叶部脂肪含量随贮藏时间的增加而下降的趋势明显,而在黑暗贮藏条件下,叶部P=0.441 014(图5C),根部P=0.663 504(图5D),大白菜叶部和根部的脂肪含量随贮藏时间的增加均表现不显著。这与我们所做脂肪代谢基因所得到的结论一致。由此,我们认为在贮藏过程中光照会对脂肪代谢产生影响。郭兵等[15]研究也表明,过低和过高的光照强度都不利于不饱和脂肪酸的积累,适宜的光照可以对植物的脂肪含量产生影响,这与本研究结果一致。

图5 大白菜叶部与根部在光照和黑暗条件下脂肪含量的表达Fig.5 Expression of Chinese cabbage leaves and roots under light and night conditions
2.3 目标基因表达的差异性
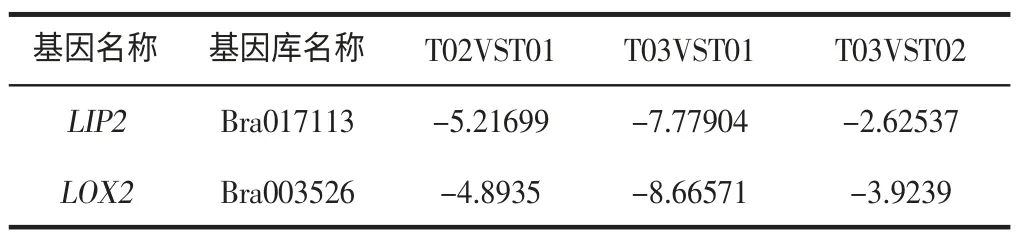
表2 目标基因差异表达Table 2 Differential gene expression
由表2 可知,对贮藏过程中大白菜基因表达的转录组分析中,发现LIP2和LOX2随贮藏时间的增加,呈现差异表达。
3 结论
通过以上研究,我们可以得出LIP2和LOX2在大白菜贮藏过程中均对脂肪起到代谢作用,并且在对贮藏过程中大白菜基因表达的转录组分析中,发现LIP2和LOX2随贮藏时间的增加,呈现差异表达。利用光照对大白菜进行贮藏,调控脂肪代谢基因,能减少大白菜中脂肪的流失,提高大白菜在贮藏过程中的营养价值。研究还发现,可以认为在大白菜贮藏方式上给予光照处理,可以起到延长大白菜货架期的效果。
