不同贮藏温度对黄秋葵保鲜效果的影响研究
2019-12-14张碧青林恒进徐怀德
张碧青,林恒进,徐怀德*
(1.西安天丰生物科技有限公司,陕西西安 710016;2.西北农林科技大学食品科学与工程学院,陕西杨凌 712100)
黄秋葵属锦葵科秋葵属草本植物。目前,市场上常见的秋葵分为黄秋葵和红秋葵。收获的最佳果荚长度为8~10 cm,此时果荚鲜绿、果肉脆嫩、种子未老化。黄秋葵营养价值高,嫩果中含有丰富的蛋白质、氨基酸、维生素、矿物质、果胶和多糖等组成的粘性物质。黄秋葵营养丰富,保健效果好,如具有抗疲劳[1-3]、抗氧化功效[4-6],能降低人体内血糖、血脂、胆固醇等[7-8];黄秋葵的脂肪、糖、纤维素和半纤维素含量低,可用作减肥食品。
每年5~9 月为黄秋葵的采收季节,由于天气炎热,常温下收获的嫩荚几小时内就会减重、失水萎蔫、严重纤维化,导致腐烂变质,无法食用。再加上黄秋葵鲜果水分含量高,呼吸强度大,在贮藏、运输、加工等过程中极易萎蔫、腐烂,给生产加工带来困难。因此目前黄秋葵主要以鲜食为主,深加工产品较少。鉴于此,本试验分析了不同温度贮藏过程中黄秋葵的生理变化和品质变化,以延长黄秋葵的保质期,为进一步生产加工提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 原料
黄秋葵品种为日本五角,2015 年7 月采收自陕西杨凌奥达果蔬生产基地,果荚嫩绿,长度8~10 cm,形态基本一致;聚乙烯食品级保鲜盒(170 mm×118 mm×70 mm,1 000 mL)由陕西杨凌奥达果蔬生产基地提供。
1.1.2 试剂
芦丁(纯度≥95%),国药集团化学试剂有限公司生产;抗坏血酸(纯度≥99.7%),天津博迪化工股份有限公司;Folin-Ciocalteu 试剂,美国Sigma 公司;没食子酸(纯度≥95%),国药集团化学试剂有限公司;咖啡碱(纯度≥98%),南京森贝伽生物科技有限公司;硫酸、盐酸、硼酸、硝酸铝、碱式醋酸铅、碳酸钠、氢氧化钠、氢氧化钾、硫酸铜、2,6-二氯酚靛酚钠、碳酸氢钠、草酸、三氯乙酸、硫代巴比妥酸、乙酸钠、聚乙二醇6000、聚乙烯吡咯烷酮、TritonX-100、愈创木酚、邻苯二酚、乙醇、乙酸、乙醚等均为分析纯。
1.2 仪器与设备
UV-mini1240 型紫外-可见分光光度计,日本岛津公司;DHG-9123A 型电热恒温鼓风干燥箱,上海精宏实验设备有限公司;ALC-210.3 型电子分析天平,赛多利斯艾科勒公司;DDS-307 型数显电导率仪,济南捷岛分析仪器有限公司;Talaire-7001 型呼吸强度仪,北京康高特科技有限公司;K9840 型定氮仪,济南海能仪器有限公司;KDC-40 型低速离心机,科大创新股份有限公司中佳分公司;HC-3018R 型高速冷冻离心机,安徽中科中佳科学仪器有限公司;HY-4 型调速多用振荡器,常州金城教学仪器厂;PAL-1 型数显糖度计,日本Atago 公司。
1.3 试验方法
将新采摘的黄秋葵置于干净试验台面,用鼓风法进行降温,散去田间热,选择果实嫩绿、大小适中、外形良好的原料进行试验。试验中,将原料以(500±5) g 的质量分装于聚乙烯保鲜盒中,加盖,分别置于4、8、25 ℃(常温)条件下进行贮藏。贮藏过程中,25 ℃条件贮藏的原料每2 d 抽样测定指标,4 ℃和8 ℃条件贮藏的原料每3 d 抽样测定指标。
1.4 指标测定
1.4.1 失重率
失重率的计算公式见式(1)。

式中,ωt为样品失重率,%;m为新鲜样品质量,g;m0为贮藏后样品的质量,g。
1.4.2 相对电导率
取黄秋葵果皮用打孔器打成大小一致的果皮圆片,取10 片于三角瓶中,同时加入30 mL 蒸馏水,于振荡器上匀速振荡30 min,测定电导率P1;之后将三角瓶于沸水浴加热10 min,冷却后再测定电导率P2。重复3 次,取平均值。电导率的计算方法见式(2)。
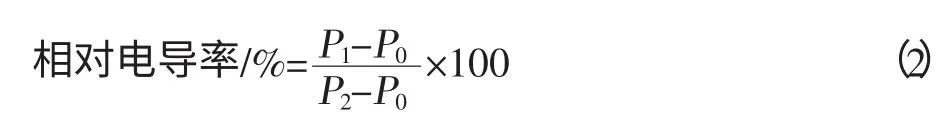
式中,P0为蒸馏水的电导率值。
1.4.3 呼吸强度
分别取不同温度贮藏下的黄秋葵样品100 g,将其与呼吸强度仪一同放入5 L 的密闭干燥器中,放置于各自的贮藏环境中平衡30 min,之后每隔2 h 读一次数。重复3 次取平均值。呼吸强度的计算公式见式(3)。

式中,Q为呼吸强度,mg CO2/(kg·h);1.96 为相关系数;ΔA为呼吸强度仪读数变化,mg/kg;V为干燥器体积,L;m为样品质量,kg;Δt为每两次读数间的时间间隔,h。
1.4.4 叶绿素
称取1.0 g 样品,加入少量碳酸钙、石英砂和10 mL、80%丙酮溶液,研磨成匀浆至组织变白,过滤到50 mL 棕色容量瓶中,冲洗研钵、残渣数次,直到滤纸和残渣无绿色。以80%丙酮溶液定容,摇匀,在652 nm 波长条件下测吸光度值。重复3 次,取平均值。计算方法见式(4):
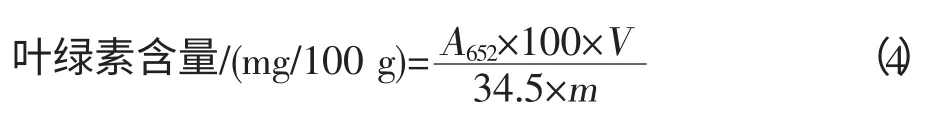
式中,A652为652 nm 波长条件下测得的吸光度值;V为样品提取液总体积,L;m为样品质量,g。
1.4.5 粗纤维
称取20.00 g 捣碎的黄秋葵样品,放入锥形瓶中,加200 mL 煮沸的1.25%硫酸溶液,加热微沸,每5 min 摇动一次使其充分混合,维持30 min,过滤,以沸水洗涤至洗液不呈酸性。用200 mL 煮沸的12.5 g/L 氢氧化钾溶液将残留物洗入锥形瓶中,煮沸30 min,过滤,再以沸水洗涤3 次,将残留物移入已干燥至恒重的G2 垂熔坩埚中,抽滤,热水洗涤,抽干,用乙醇和乙醚依次洗涤。将坩埚和残渣一起放入105 ℃烘箱烘至恒重[9]。计算公式见式(5)。

式中,m1为残余物恒重后质量,g;m2为样品质量,g。
1.4.6 丙二醛
准确称取1 g 样品,加入2 mL 10%三氯乙酸和石英砂,研磨成匀浆,加8 mL、10%三氯乙酸继续研磨,4 000 r/min 离心10 min,收集上清液,即为丙二醛提取液。
取2 mL 丙二醛提取液至10 mL 具塞试管,对照为蒸馏水,再加入2 mL、0.6%硫代巴比妥酸溶液。摇匀,于沸水浴中反应15 min,迅速冷却,离心,收集上清液。分别在532、600、450 nm 的波长条件下测定吸光度。重复3次,取平均值。
1.4.7 多酚氧化酶活性
参考采用邻苯二酚法的相关研究方法[9],略做修改。准确称取5 g 黄秋葵样品,加5 mL 提取缓冲液,研磨成匀浆(冰浴),4 ℃、12 000 r/min 离心30 min,收集上层酶提取液,低温保存备用。
吸取200 μL 酶提取液,分别加入50 mmol/L、pH 5.5乙酸-乙酸钠溶液4 mL 及50 mmol/L 邻苯二酚溶液1 mL,将反应液迅速置于分光光度室中,以蒸馏水为对照,420 nm 波长条件下进行测定,并开始计时,每隔15 s记录一次吸光值,至少连续读取8 组吸光值。重复3 次,取平均值。
1.4.8 过氧化物酶活性
参考采用愈创木酚法[9],略做修改,酶提取液制备方法同多酚氧化酶。吸取100 μL 酶提取液,加入25 mmol/L愈创木酚溶液3 mL 和0.5 mol/L 过氧化氢溶液200 μL,将反应液迅速倒入比色皿中,置于分光光度室中,以蒸馏水为对照,470 nm 波长条件下进行测定,并开始计时,每隔15 s 记录一次吸光值,至少连续读取8 组吸光值。重复3 次,取平均值。
1.4.9 可溶性固形物
取黄秋葵样品20 g,加入100 g 水,打浆,用手持数显糖度仪测定可溶性固形物含量。重复3 次,取平均值。
1.4.10 蛋白质
采用GB5009.5-2010《食品中蛋白质的测定》中的凯氏定氮法进行测定。
1.4.11 抗坏血酸
参考采用2,6-二氯酚靛酚滴定法测定[10]。
1.4.12 总酚
参考采用Folin-Ciocaileu 比色法测定的相关研究方法[11,12],略做修改。配制0.1 mg/mL 没食子酸标准溶液,准确吸取标准溶液0、0.1、0.5、1、1.4、1.8、2、2.4、2.8、3 mL 于25 mL 具塞刻度管中,蒸馏水稀释至10 mL,加入0.5 mL福林酚试剂,混匀,加入10 mL、7.5%碳酸钠溶液,混匀,25 ℃水浴60 min,蒸馏水定容至刻度。以不加样品液为对照,在750 nm 波长条件下测吸光度值,绘制标准曲线。
称取10 g 黄秋葵样品,加入100 mL、60%乙醇溶液,在40 ℃条件下超声提取40 min,3 500 r/min 离心10 min,收集上清液,得到提取液。吸取提取液0.5 mL,按标准曲线制作方法进行测定,得到总酚含量。
1.4.13 总黄酮
参考采用硝酸铝比色法测定的相关研究方法[13],略做修改。配制0.2 mg/mL 芦丁标准溶液,准确吸取标准溶液0、0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0 mL 于10 mL 容量瓶中,加5%亚硝酸钠溶液0.3 mL,摇匀,静置6 min;加10%硝酸铝溶液0.3 mL,摇匀,静置6 min;加4%氢氧化钠溶液4 mL,30%乙醇稀释至刻度,摇匀,静置10~15 min。以不加样品液为对照,在510 nm 波长条件下测吸光度值,绘制标准曲线。
提取液制备方法同总酚测定。吸取提取液2 mL,按标准曲线制作方法进行测定,换算出总黄酮含量。
2 结果与分析
2.1 不同贮藏温度对黄秋葵贮藏时间及感官的影响

表1 不同温度下黄秋葵的贮藏时间Table 1 Storage time of okra at different storage temperature
如表1 所示,黄秋葵在不同温度条件下贮藏,表现出不同感官质量的变化特性。在贮藏中后期,25、8、4 ℃条件下贮藏的黄秋葵分别在第5、9、20 d 时,表面开始出现黑色斑点,然后逐渐失去食用价值。25 ℃下黄秋葵的贮藏期最短,为10 d;其次是8 ℃,为15 d;4 ℃条件下的贮藏期最长,达到24 d,且此时黄秋葵组织结构纤维化不明显。可见,4 ℃能够有效延长黄秋葵的贮藏时间。
2.2 不同贮藏温度对黄秋葵生理特性及品质的影响
2.2.1 不同贮藏温度对黄秋葵失重率的影响
失重率是反映果蔬生理及品质的一项重要指标。图1 显示了不同贮藏温度对黄秋葵失重率的影响,由图可知,黄秋葵的失重率随贮藏时间的延长而增加。在25 ℃时失重率上升速度最快,第8 d 达到2.2%,在第10 d 迅速升高到4.3%,且通过感官鉴定发现,此时的黄秋葵萎蔫和纤维化非常严重,已失去食用价值。8 ℃和4 ℃保存的黄秋葵与25 ℃保存的黄秋葵,其失重率有显著差异,但在贮藏的前9 d,8 ℃和4 ℃条件下贮藏的黄秋葵失重率差异不明显,从第12 d 开始二者表现出明显差异。第12~15 d,8 ℃条件下黄秋葵失重率急剧上升,由1.6%上升至4.1%,表现出与25 ℃条件贮藏后期一样的变化趋势,也失去了食用价值。虽然4 ℃条件贮藏的黄秋葵失重率从第12 d 起,也有较为明显的上升趋势,但较8 ℃条件贮藏的失重少,且在这一时间还具有较好的食用价值,直到第24 d 时,该条件下贮藏的黄秋葵失重率达到3.9%,失去食用价值。
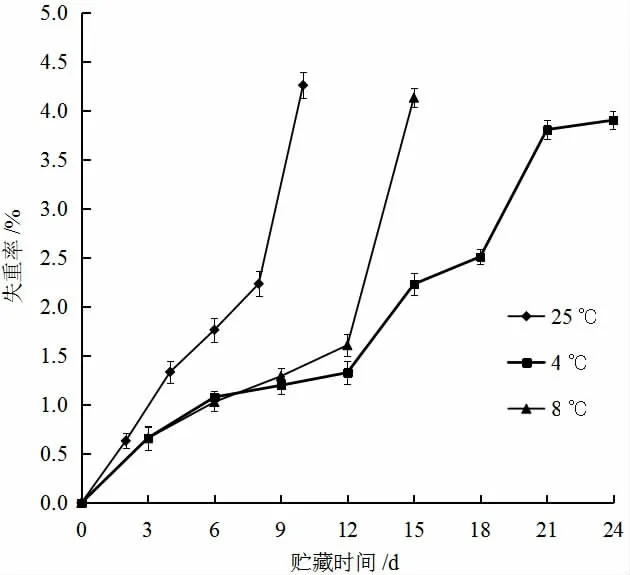
图1 不同贮藏温度对黄秋葵失重率的影响Fig.1 Effect of storage temperature on weight loss of okra
2.2.2 不同贮藏温度对黄秋葵相对电导率的影响

图2 不同贮藏温度对黄秋葵相对电导率的影响Fig.2 Effect of different storage temperature on the relative electric conductivity of okra
果蔬的相对电导率是反映果实细胞膜透性的重要指标[14],如图2 所示,三个温度下贮藏的黄秋葵相对电导率均呈现出随时间延长先下降后上升的趋势。这是由于果蔬采后进入新环境后,对环境产生应激反应,导致贮藏前期相对电导率下降,适应新环境后,随着果实的衰老,相对电导率呈现出逐渐升高的趋势。由图可知,4 ℃条件能够有效阻止细胞膜透性增加,抑制黄秋葵衰老,延长贮藏时间。
2.2.3 不同贮藏温度对黄秋葵呼吸强度的影响
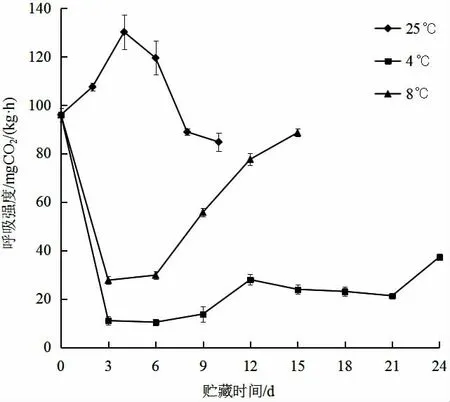
图3 不同贮藏温度对黄秋葵呼吸强度的影响Fig.3 Effect of different storage temperature on the respiration intensity of okra
果蔬采后仍进行呼吸作用,并与其他生理生化过程密切相关。呼吸浓度能够反映果蔬采后物质代谢和能量代谢的速率,因此是评价果蔬贮藏保鲜效果的一项重要指标[14]。由图3 可知,25 ℃条件下,黄秋葵的呼吸强度较高,在前4 d 呈上升趋势,第4 d 呼吸强度最大,达到130.10 mgCO2/(kg·h),然后逐渐下降。8 ℃和4 ℃条件下,黄秋葵的呼吸强度较低。8 ℃条件下,黄秋葵在第3 d 的呼吸强度最低,为27.68 mgCO2/(kg·h),4 ℃条件下,黄秋葵在第6 d 的呼吸强度最低,为10.36 mgCO2/(kg·h),说明降低贮藏环境温度能够有效抑制黄秋葵的呼吸速率,从而减缓果实中蛋白质、糖类等物质的消耗,使果实品质得以保持,二者在贮藏中后期呼吸强度有所上升,营养物质消耗加速,果实逐渐失去食用品质。
2.2.4 不同贮藏温度对黄秋葵叶绿素含量的影响
图4 表明,黄秋葵在贮藏过程中,叶绿素不断分解,类胡萝卜素等其他色素逐渐显现,使果实表现色泽变黄变暗,影响其感官品质,降低果实新鲜度,使其失去商品价值。图5 表明,在三种不同温度下,黄秋葵叶绿素含量随贮藏时间的延长而降低,25 ℃时叶绿素含量下降最快,其次为8 ℃,4 ℃下降最慢。因此,降低贮藏环境温度能够在一定程度上抑制黄秋葵叶绿素的分解。本试验中,在4 ℃条件下贮藏至24 d 时,黄秋葵叶绿素含量为9.05 mg/100 g,这与国内相关研究中得到的黄秋葵失去食用价值时的叶绿素含量为7.96 mg/100 g 的结果基本一致[15]。
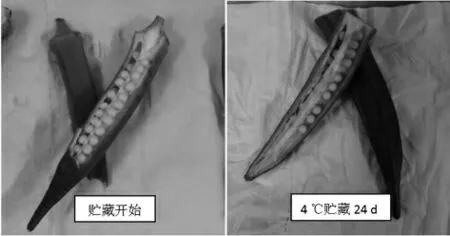
图4 黄秋葵贮藏前后色泽对比图Fig.4 Color contrast of okra before and after storage
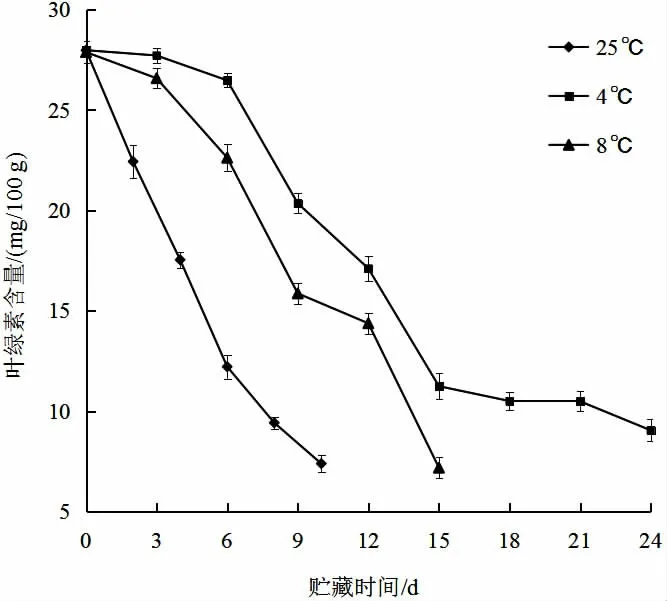
图5 不同贮藏温度对黄秋葵叶绿素含量的影响Fig.5 Effect of different storage temperature on the chlorophyll content of okra
2.2.5 不同贮藏温度对黄秋葵粗纤维含量的影响
黄秋葵在贮藏过程中,随着果实的衰老,组织结构逐渐纤维化,食用品质下降,因此可通过粗纤维含量来评定黄秋葵的食用价值。如图6(见下页)所示,三个温度条件下贮藏的黄秋葵中,粗纤维含量均随贮藏时间的延长而增加,但差异非常明显,25 ℃条件的粗纤维含量增加最快最多,贮藏结束时达到4.57%;其次为8 ℃条件的,贮藏结束时达到3.51%;4 ℃条件下的粗纤维含量增加最为缓慢,且贮藏结束时含量最低,为3.23%,这与感官评价中通过观察所得结果相吻合。
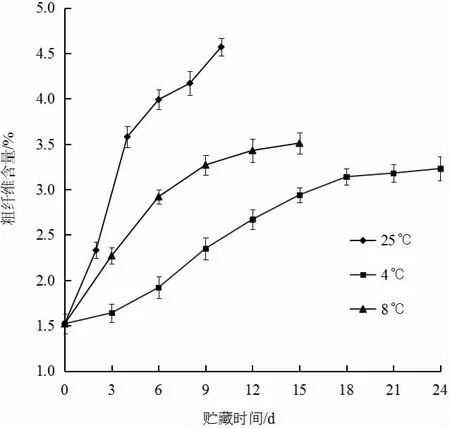
图6 不同贮藏温度对黄秋葵粗纤维含量的影响Fig.6 Effect of different storage temperature on the crude fiber content of okra
2.3 不同贮藏温度对黄秋葵衰老指标的影响
2.3.1 不同贮藏温度对黄秋葵丙二醛(MDA)含量的影响
MDA 是果蔬膜脂过氧化的主要产物之一,其含量可以反映膜脂过氧化的程度、衡量果实衰老进程[14]。从图7可知,黄秋葵在三种贮藏温度下,丙二醛含量均为先降低后升高,这与相对电导率的变化趋势一致,进一步论证了黄秋葵贮藏过程中的衰老过程。可见,4 ℃条件能够有效抑制黄秋葵中MDA 的生成,延缓衰老,延长贮藏期。
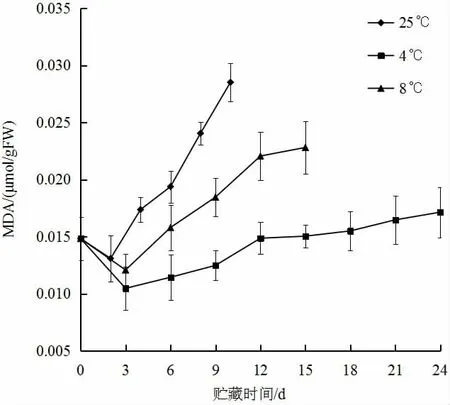
图7 不同贮藏温度对黄秋葵MDA 含量的影响Fig.7 Effect of different storage temperature on MDA content of okra
2.3.2 不同贮藏温度对黄秋葵多酚氧化酶活性的影响
图8 显示了不同贮藏温度对黄秋葵多酚氧化酶活性的影响,由图可知,黄秋葵多酚氧化酶活性在贮藏过程中先降低后升高。25 ℃贮藏到第4 d,黄秋葵中的多酚氧化酶活性降到最低,为21.82 ΔOD420/(min·g),然后逐渐上升到49.28 ΔOD420/(min·g);8 ℃条件下,第6 d,黄秋葵中多酚氧化酶活性降到最低,为21.09 ΔOD420/(min·g),再上升到43.96 ΔOD420/(min·g);4 ℃条件下,第3 d,黄秋葵中多酚氧化酶活性降到最低,为12.14 ΔOD420/(min·g),然后逐步上升,达到42.17 ΔOD420/(min·g)。可见,降低贮藏温度能够有效抑制黄秋葵多酚氧化酶的活性,从而减缓多酚类物质的分解速率。

图8 不同贮藏温度对黄秋葵多酚氧化酶活性的影响Fig.8 Effect of different storage temperature on the polyphenol oxidase activity of okra
2.3.3 不同贮藏温度对黄秋葵过氧化物酶活性的影响

图9 不同贮藏温度对黄秋葵过氧化物酶活性的影响Fig.9 Effect of different storage temperature on the peroxidase activity of okra
不同贮藏温度对黄秋葵过氧化物酶活性的影响如图9 所示,由图知,随着贮藏时间的延长,黄秋葵中过氧化物酶活性逐渐升高,25 ℃条件下,其活性逐渐上升至4.99 ΔOD470//(min·g);8 ℃条件下,过氧化物酶活性最终达到4.90 ΔOD470//(min·g);4 ℃条件下,黄秋葵的过氧化物酶活性在贮藏至24 d 时为4.29 ΔOD470//(min·g)。由此可知,降低贮藏温度能够明显抑制黄秋葵的过氧化物酶活性,从而延缓果实的褐变速率。
2.4 不同贮藏温度对黄秋葵营养成分的影响
2.4.1 不同贮藏温度对黄秋葵可溶性固形物含量的影响
黄秋葵中的可溶性固形物能直接反映出黄秋葵中可溶性糖、酸、维生素、矿物质等含量,影响黄秋葵果实的风味和口感,因而是一项评价黄秋葵生理品质的重要指标[14]。图10 显示了不同贮藏温度对黄秋葵可溶性固形物含量的影响,由图可知,在贮藏期间,可溶性固形物变化趋势为先降低后升高又降低,这是由于在贮藏开始时,黄秋葵为适应新的环境,通过降低可溶性固形物含量来抵抗外界的逆境伤害;当适应新环境后,可溶性固形物含量又会上升,而后随着贮藏期的延长,由于变质及微生物的消耗和破坏,可溶性固形物含量逐渐降低[16]。在贮藏后期,25 ℃条件下,黄秋葵的可溶性固形物含量下降最快,从6.13 °Brix 下降到3.83 °Brix。4 ℃条件下的黄秋葵可溶性固形物含量下降最慢,到贮藏的第24 d 才下降到3.57°Brix,与常温条件贮藏的黄秋葵有显著差异,这说明在4 ℃条件下贮藏能够很好地保持黄秋葵可溶性固形物的含量。
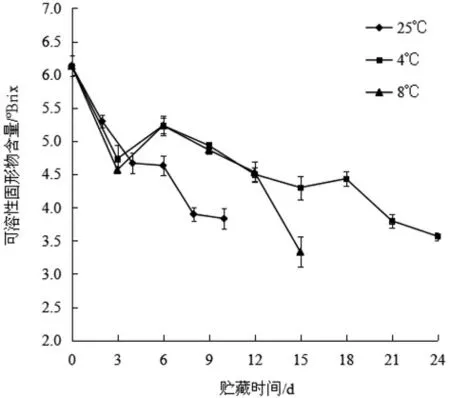
图10 不同贮藏温度对黄秋葵可溶性固形物含量的影响Fig.10 Effect of different storage temperature on the total soluble solids of okra
2.4.2 不同贮藏温度对黄秋葵蛋白质含量的影响
由于黄秋葵采后仍进行呼吸等生理作用,会消耗掉果实中的部分蛋白质,因此蛋白质含量也是反映黄秋葵品质的重要指标之一。如图11 所示,黄秋葵在三个不同温度条件下贮藏,蛋白质含量均随着贮藏时间的延长而下降。4 ℃条件蛋白质含量下降速率最为缓慢,贮藏结束时含量为1.74%。由此可知,降低温度可抑制黄秋葵的呼吸速率,减少对蛋白质的消耗,使蛋白质含量下降的速度减缓。

图11 不同贮藏温度对黄秋葵蛋白质含量的影响Fig.11 Effect of storage temperature on protein content of okra
2.4.3 不同贮藏温度对黄秋葵抗坏血酸含量的影响
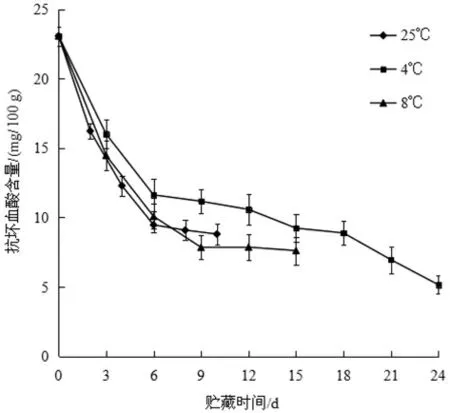
图12 不同贮藏温度对黄秋葵抗坏血酸含量的影响Fig.12 Effect of different storage temperature on the asco rbic acid content of okra
抗坏血酸为还原型维生素C,是人体所需最重要的维生素之一,而人体每天摄入维生素C 的98%来源于果蔬,因此抗坏血酸含量变化是衡量果蔬贮藏条件的一个重要指标[14]。图12 表明,三个不同温度条件下,黄秋葵中抗坏血酸含量随着贮藏时间延长而下降,其中25 ℃和8℃条件下,抗坏血酸含量下降的趋势基本一致,4 ℃条件下黄秋葵的抗坏血酸含量下降速度相对较慢,说明4 ℃条件贮藏有助于减缓黄秋葵中抗坏血酸的分解速度。本试验结果中,得到黄秋葵在4 ℃条件下贮藏时抗坏血酸含量由23.07 mg/100 g 降低到5.16 mg/100 g,与国内相关研究中测得的黄秋葵中抗坏血酸含量结果基本一致[15,17]。
2.4.4 不同贮藏温度对黄秋葵总酚含量的影响
在贮藏过程中,黄秋葵果实里含有的各种酶使酚类物质分解,降低了总酚含量[14]。图13 表明,三个不同温度条件下,黄秋葵中的总酚含量逐渐下降,在第10 d 时,25℃条件下黄秋葵的总酚含量为9.09 mgGAE/g,在第15 d时,8 ℃条件下总酚含量为9.31 mgGAE/g,4 ℃条件下总酚含量为10.04 mgGAE/g。可见,25 ℃条件下的总酚含量下降最快,4 ℃条件下的总酚含量下降最慢。
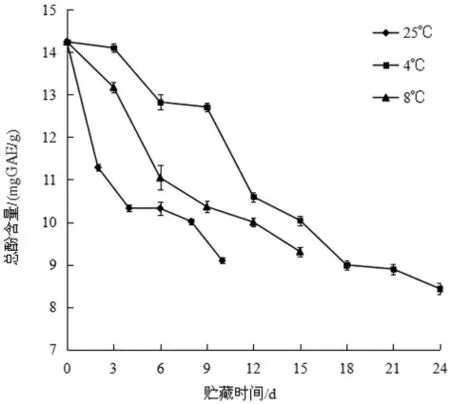
图13 不同贮藏温度对黄秋葵总酚含量的影响Fig.13 Effect of different storage temperature on the total phenol content of okra
2.4.5 不同贮藏温度对黄秋葵总黄酮含量的影响
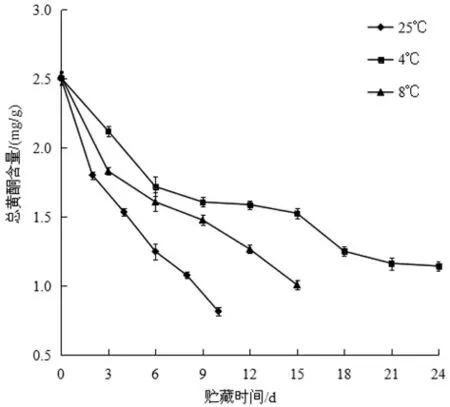
图14 不同贮藏温度对黄秋葵总黄酮含量的影响Fig.14 Effect of different storage temperature on the total flavonoids content of okra
图14 显示了不同贮藏温度对黄秋葵总黄酮含量的影响。由图可知,在三种不同温度下,黄秋葵总黄酮含量均逐渐下降,25 ℃条件下的总黄酮含量下降最快,4 ℃条件下的总黄酮含量下降最慢。在贮藏至24 d 时,25 ℃条件的黄秋葵总黄酮含量为0.82 mg/g,8 ℃条件的总黄酮含量为1.01 mg/g,4 ℃条件的总黄酮含量为1.14 mg/g。由此可知,较低的贮藏温度有利于减缓黄秋葵中总黄酮含量的降低。
3 结论
本文以黄秋葵为原材料,研究了不同贮藏温度对其品质的影响,为黄秋葵的贮藏保鲜技术提供理论依据。通过试验发现,4 ℃为黄秋葵的最佳贮藏温度。在该温度下贮藏黄秋葵,能够有效抑制其呼吸速率,使呼吸强度维持在10.36~21.26 mgCO2/(kg·h)的较低水平,有效抑制了细胞膜脂过氧化作用,相对电导率升高速率和丙二醛含量增加速率也明显减缓,从而使黄秋葵营养成分得到保存,明显减缓了果实的衰老进程。而且,该条件下,黄秋葵的贮藏期能够达到24 d,表面黑色斑点出现的时间最晚,感官品质也最好。4 ℃条件下贮藏至24 d 时,叶绿素含量为9.05 mg/100 g,粗纤维含量为3.23%;黄秋葵的营养成分保持较好,其可溶性固形物含量为3.57 °Brix,蛋白质含量为1.74%,抗坏血酸含量为5.16 mg/100 g,总酚含量为8.43 mgGAE/g,总黄酮含量为1.14 mg/g。
