H9亚型禽流感病毒实时荧光RT-PCR检测方法的建立与应用
2019-12-06王楷宬王素春樊擎莹孙亚伟康京丽刘华雷黄保续
王楷宬 ,王素春,樊擎莹,孙亚伟,康京丽,汪 洋,刘华雷,黄保续
(1.中国动物卫生与流行病学中心,山东青岛 266032;2.河南科技大学动物科技学院,河南洛阳 471023)
禽流感(avian influenza,AI)是由禽流感病毒(avian influenza virus,AIV)引起的一种严重危害公共卫生和养禽业发展的传染病之一。AIV属于正黏病毒科A 型流感病毒属成员,由于其病毒基因组为分节段的单股负链RNA,故极易发生变异[1]。根据AIV 的致病性可将其分为低致病性禽流感病毒(low pathogenic avian influenza virus,LPAIV)、高致病性禽流感病毒(high pathogenic avian influenza virus,HPAIV)和非致病性禽流感病毒(non-pathogenic avian influenza virus,NPAIV)。以H5和H7亚型为代表的HPAIV 不仅严重危害养禽业发展,也严重威胁到了人类健康,因而得到了极大关注[2-4]。以H9亚型为代表的LPAIV 引起的症状相对轻微且死亡率低,因而未能引起足够重视,以至于H9亚型成为当前我国禽流感的主要流行型[5-6]。H9亚型AIV 在世界范围内广泛分布,在遗传进化上,可以分为北美系和欧亚系两大分支,其中欧亚系又进一步衍生出以BJ/94-like 或Y280-like、G1-like、Y439-like 以及F/98-like 等为代表的病毒亚群。根据新的亚系命名系统,我国H9亚型AIV 分离毒株主要来源于H9.4.2分支,其中4.2分支又演化为4.2.1~4.2.6分支。近年来,我国分离的H9亚型AIV 毒株主要为H9.4.2.5分支[7]。
研究[8-9]发现,H9N2亚型AIV 可由禽类跨种传播给其他哺乳动物,甚至是人类。葛菲菲等[10]报道,H9N2亚型AIV 在家禽中短期传播后,可突变成高致病性病毒。研究[11]显示,2013年在我国华东地区出现的H7N9亚型流感病毒中有部分基因片段来自H9N2亚型AIV。随着我国养禽业的飞速发展,在规模化养殖、活禽流通交易以及免疫压力之下,H9亚型AIV 势必威胁到公共卫生安全以及养禽业发展。H9亚型AIV 感染临床上主要表现为呼吸道症状,与其他呼吸系统疾病难以区分,更值得关注的是H9亚型AIV 可引起免疫抑制,故临床上常表现为H9亚型AIV 和其他病原的混合感染[12]。
为满足快速准确特异性检测H9亚型AIV 的需求,本研究建立了针对H9亚型AIV 的实时荧光RT-PCR 检测方法,评估了该方法的灵敏度和特异性,并将该方法应用于临床样品检测。
1 材料与方法
1.1 试剂与仪器
PrimeScriptTMOne Step RT-PCR Kit(Perfect Real Time)、Primescript One step RT-PCR Kit Ver.2:宝生物工程(大连)有限公司;QIAamp Viral RNA Mini Kit 核酸提取试剂盒:德 国QIAGEN 公 司;Low-Profile PCR Tubes 8-tube strip:BIO-RAD;Optically clear flat 8 Cap Strips:Thermo Scientific。异丙醇、无水乙醇、RNaseA 等,均为国产分析纯试剂。
Qubit 核酸浓度测定仪及配套试剂:购自Life Technologies 公司;超净工作台:美国Forma Scientific 公司;移液器:Eppendorf;孵化器:德州诚信孵化设备有限公司;高速台式离心机:德国Heraeus Biofuge primoR;荧光定量PCR 仪:Bio-Rad CFX96 Real-time PCR System。
1.2 毒株与核酸提取
各亚型甲型流感病毒、新城疫病毒(Newcastle disease virus,NDV)、传染性支气管炎病毒(infectious bronchitis virus,IBV)、传染性喉气管炎病毒(infectious laryngotracheitis virus,ILTV)等毒株,均由中国动物卫生与流行病学中心禽病监测室保存,毒株详细信息见表1。按照说明书操作,使用QIAamp Viral RNA Mini Kit(Qiagen,德国)提取病毒RNA,并使用Qubit 核酸浓度测定仪及配套试剂测定RNA 浓度。
1.3 引物与探针筛选
参照NCBI GenBank 上发表的H9亚型AIV的血凝素(hemagglutinin,HA)基因序列,采用MEGA 6.0[13-14]进行序列比对分析,选取保守区域进行荧光检测引物和探针设计,并对多条引物、探针进行组合、筛选与检验,以筛选出最优引物和探针。
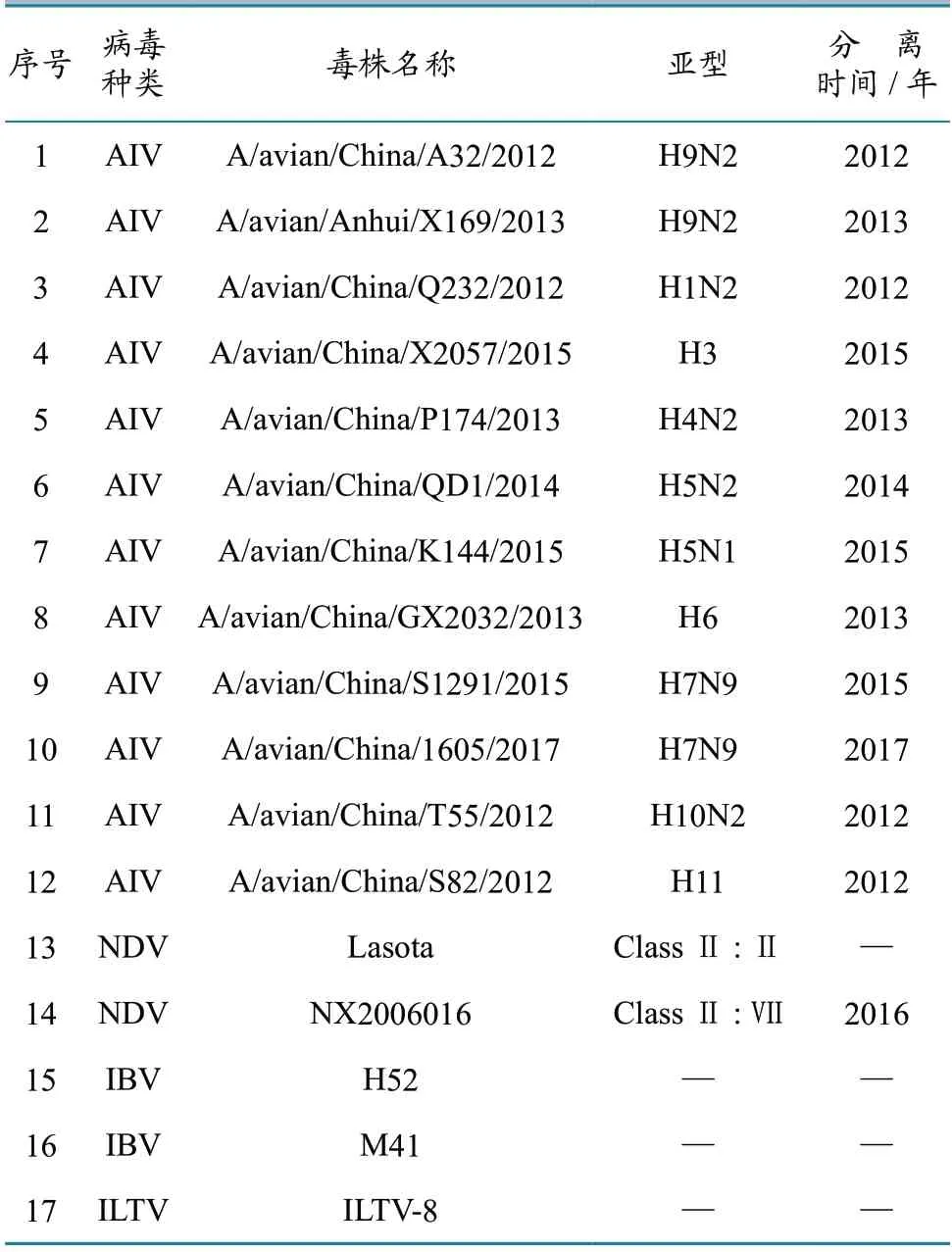
表1 病毒毒株信息
1.4 反应体系与条件
配制荧光定量RT-PCR 反应液,每管25 μL,含有2×One Step RT-PCR Buffer Ⅲ 12.5 μL、5U/μL TaKaRa ExTaqHS 0.5 μL、PrimeScript RT Enzyme Mix Ⅱ 0.5 μL,以 及10 pmol/μL H9 forward、H9 reverse 和H9 probe 各0.5 μL,RNase Free H2O 8.0 μL,待检测样品RNA 模板2 μL。将检测反应条件设置为:第1阶段,42 ℃/5 min;第2阶段,95 ℃/10 s;第3阶段,95 ℃/5 s,60 ℃/20 s(收集荧光),40个循环。无Ct 值并且无扩增曲线,样品判为阴性;Ct ≤36,且出现典型扩增曲线,样品判为阳性。
1.5 特异性与灵敏度评估
采用上述反应体系与反应条件,检测表1中的病毒RNA,以评估该检测方法的特异性。提取的核酸经Qubit 核酸浓度测定仪测定RNA 浓度后,将此病毒RNA 稀释为1 ng/μL,再依次10倍梯度稀释为10-1~10-6ng/μL;分别取2 μL 作为反应模板,按照前述加样方法进行实时荧光定量RT-PCR 核酸扩增。
1.6 临床样品检测
采集我国某市13个场点的禽咽喉拭子共384份,置于含有10% 甘油和抗生素(含青霉素2 000 IU/mL、链霉素2 000 IU/mL、制霉菌素1 000 IU/mL、BSA 5 mg/mL)的PBS(pH7.2)缓冲液中,-80 ℃保存。将采集的样品涡旋混匀后,4 ℃ 10 000 r/min 离心5 min;取上清,使用QIAamp Viral RNA Mini Kit(Qiagen,德 国)提取病毒核酸,-80 ℃保存。使用96孔反应管,加入上述反应体系,再分别加入待检样品RNA 进行检测。同时用国家标准《H9亚型禽流感病毒荧光RT-PCR 检测方法》(GB/T 19438.3—2004)中的荧光RT-PCR 检测方法,对384份临床样品进行检测,然后对比检测结果,分析本试验建立的方法在临床检测中的适用性。
2 结果与分析
2.1 引物与探针筛选
最终筛选出最适引物(H9 forward、H9 reverse)和探针(H9 probe),其中H9 probe 为TaqMan 荧光探针,标记HEX 荧光(表2)。

表2 最适引物及探针序列
2.2 特异性与灵敏度
结果显示,除H9亚型AIV RNA 模板对应的试验组出现了正常荧光检测曲线外,其他非特异性病毒的试验组及阴性对照组均未出现扩增曲线。结果表明,此方法可以实现对AIV 的特异性检测,与其他相关病毒不发生交叉反应(图1)。本研究筛选的引物和探针组合能够保证检测时的灵敏性,检测灵敏度为RNA 终浓度10-4ng/μL(1.30×104copies/μL)。灵敏性试验结果见图2。

图1 H9亚型AIV 实时荧光定量RT-PCR检测特异性试验结果
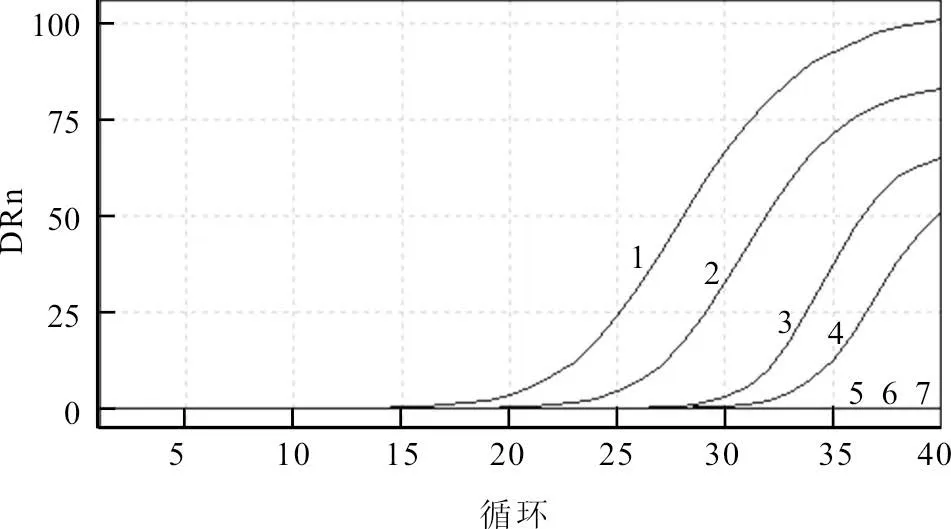
图2 H9亚型AIV 实时荧光定量RT-PCR检测灵敏性试验结果
2.3 临床样品检测
用本研究建立的方法检出66份样品在CY5通道中有荧光信号,判定此66份样品为H9亚型AIV 阳性,与国标方法检测结果一致,符合率达到100%,表明本试验筛选的引物和探针通过荧光RT-PCR 方法检测H9亚型AIV 准确可信度高,可用于临床样品检测。
3 讨论
目前针对H9亚型AIV 的分子生物学检测方法有反转录-聚合酶链式反应(RT-PCR)、环介导的等温核酸扩增技术和荧光RT-PCR 技术等[15]。实时荧光PCR 是在PCR 定性技术基础上发展起来的核酸定量技术,是在PCR 反应体系中加入荧光基团,利用荧光信号积累实时监测整个PCR 进程,最后通过标准曲线对未知模板进行定量分析的方法。实时荧光PCR 可以分为SYBR-Green 荧光染料法和TaqMan 探针法。相比荧光染料法,探针法特异性强、灵敏度高,数据更准确[16-17]。
据研究[18-19],自我国1994年首次报道从鸡群中分离到 H9亚型AIV 以来,绝大部分省份都有H9亚型AIV 的流行,给我国养禽业造成了巨大经济损失。目前国内研究[6,19-20]均显示,H9亚型AIV 在我国长期处于较高的流行态势,感染率仍在增高。本研究检测的临床样品H9亚型个体阳性率为13.75%,与其他调查报告基本相符,也表明了我国H9亚型AIV 感染率较高。
近年来,有关H9亚型AIV 混合感染的报道不断增多。H9亚型AIV 既可与其他亚型禽流感病毒混合感染,又可以其他病毒或细菌混合感染[21]。例如,H9亚型AIV 与禽偏肺病毒、IBV、NDV、大肠杆菌、金黄色葡萄球菌等混合感染,使得临床症状更加复杂,不易被确诊[22-25]。此外,混合感染往往呈现高发病率和高死亡率。
随着我国养禽业的飞速发展,家禽养殖集约化程度大幅提高,活禽运输交易越发频繁,导致AI 防控越发困难。在疫苗免疫压力以及环境压力下,H9亚型AIV 正逐渐发生变异。已有的研究[26-28]显示,我国不同地区H9亚型AIV 分离株的编码基因在遗传进化方面均发生了一定程度的变异,以至于现有疫苗不能提供充分的免疫保护。
H9N2亚型AIV 也参与了H7N9亚型病毒的重组,更有报道[11,29-30]称,H9N2亚型AIV 已跨越种间屏障,可直接感染人。近些年来,国内学者对我国不同地区H9亚型AIV 的HA 基因分子特征及遗传进化开展了相关研究[26,31-32],均发现H9亚型AIV 呈现出了典型的人流感受体结合特征,只是目前尚未突破种间屏障,获得感染哺乳动物的能力,提示国内应加强对H9亚型AIV 的防控。
综上可见,H9亚型AIV 不仅严重影响养禽业发展,更是威胁人类健康的一大隐患。且我国的H9亚型AIV 基因还将进一步发生变异,故更需要加强H9亚型AIV 的监测。
H9亚型AIV 的不断重组变异,导致以往检测方法已经不能满足当前流行株检测的需要。故本研究根据H9亚型AIV HA 基因进行引物设计,根据基因比对,分析保守区域,经同源性分析后,筛选出一组特异性好、检测下限达10-4ng/μL 的探针、引物,并建立了高通量检测方法,应用于临床检测。经验证,该方法能够特异性地检测H9亚型AIV,可满足目前国内H9亚型AIV 流行株的检测需要,与国家标准GB/T 19438.3—2004中的荧光RT-PCR检测方法符合率达到100%,且能在1 h 能完成对未经培养临床样品的高通量检测,可以满足大规模流行病学调查的需要。
