阿魏酸对粪肠球菌和屎肠球菌产酪胺机制的影响
2019-12-04薛林林李彬彬王庆玲卢士玲
薛林林,王 远,李彬彬,王庆玲,卢士玲,*
(1.石河子大学食品学院,新疆 石河子 832003;2.新疆农垦科学院,新疆 石河子 832000)
酪胺是一种生物胺,广泛存在于奶酪、酒和发酵肉制品等食品中[1-3]。适量的酪胺对人体的某些生理机能具有调节作用,而摄入过量便会引起偏头痛、高血压以及脑出血等严重问题[4-6]。肠球菌被认为是酪胺的主要产生菌。Ladero等[7]研究发现,无论是存在于动物、人体或是食品原料中的肠球菌都可以通过酪氨酸脱羧(tyrosine decarboxylase,TDC)途径将酪氨酸转化为酪胺。大量研究表明,在肠球菌TDC基因簇中编码氨基酸脱羧酶(tyrosine decarboxylase,tyrDC)和酪氨酸/酪胺透性酶(tyrosine/tyramine permease,tyrP)的基因通常是相邻的,还具有酪氨酰-tRNA合成酶(tyrosyltRNA synthetase,tyrS)基因以及编码Na+/H+转运蛋白(Na+/H+antiporter,nhaC)的基因[1,8]。
酚类化合物是食用植物中最多样化的次级代谢物之一,许多研究报道植物多酚提取物对不同的细菌活性具有抑制作用[9-11]。阿魏酸是酚类化合物的一种,存在于粮食、蔬菜、水果和坚果等原料中[12]。Chan等[10]证实阿魏酸可以抑制金黄色葡萄球菌、大肠杆菌和鼠伤寒沙门氏菌等致病菌的生长。Lemos等[13]也表明阿魏酸和水杨酸可以破坏蜡状芽孢杆菌和荧光假单胞菌生物膜结构,起到抑制其生长的作用。魏延玲等[14]发现阿魏酸能显著抑制风干鲈鱼加工及贮藏过程中微生物的生长及生物胺的产生。而目前关于阿魏酸对肠球菌中酪胺产生影响以及产酪胺途径中相关基因表达的研究鲜见报道。
本实验旨在利用阿魏酸对熏马肠中高产酪胺的粪肠球菌和屎肠球菌产酪胺作用效果,并从分子生物学角度研究阿魏酸对肠球菌产酪胺TDC基因簇相关基因表达水平的影响,明确了阿魏酸影响肠球菌产酪胺的机制,为将阿魏酸应用于发酵食品中以提高其安全性提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
屎肠球菌XL-M76(Enterococcus faeciumXLM76),GenBank登录号为MK201640;粪肠球菌XL-M66(E. faecalisXL-M66),GenBank登录号为MK201639,由本实验室从熏马肠中分离保存并送往华大基因测序鉴定。
阿魏酸(≥98%)、酪氨酸 北京博奥拓达科技有限公司;M17肉汤 青岛高科园海博生物技术有限公司;酪胺标准品(≥99%)、甲醇、乙腈(均为色谱纯)美国Sigma公司;Trizol试剂 美国Invitrogen公司;5×All-In-One RT MasterMix (with AccuRT Genomic DNA Removal Kit) cDNA合成试剂盒、EvaGreen 2×qPCR MasterMix-No Dye 加拿大ABM公司。
1.2 仪器与设备
ND2000C型微量核酸测定仪 基因有限公司;LDZX-30KBS立式压力蒸汽灭菌器 上海申安医疗器械厂;5417R型高速冷冻离心机 德国Eppendorf公司;多功能酶标仪 美国BioTek仪器有限公司;LightCycler®480型荧光定量PCR仪 瑞士Roche公司;ACQUITY Arc System高效液相色谱(high performance liquid chromatography,HPLC)仪 美国Waters公司;SPX-150B-Z型生化培养箱 上海博迅实业有限公司。
1.3 方法
1.3.1 供试菌菌悬液的制备
将本实验室从熏马肠中分离的肠球菌菌株(-18 ℃甘油保藏)接种于M17肉汤培养基(pH 5.5)中,37 ℃培养24 h,活化3 次,以用于后续实验。
1.3.2 阿魏酸对供试菌生长的作用
准备一批10 mL M17肉汤培养基,分为4 组,第1组为空白对照组,不添加酪氨酸和阿魏酸;第2组仅添加0.071%阿魏酸;第3组仅添加0.2%酪氨酸;第4组同时添加0.071%阿魏酸和0.2%酪氨酸。每组均含不添加供试菌株的阴性对照。接入200 μL供试菌株于37 ℃恒温培养,在0、4、8、12、16、20、24、28、32、36、48 h取样,用多功能酶标仪测菌悬液OD600nm值,并测量pH值,每组样品各做3 个平行。
1.3.3 TDC基因簇相关基因表达量的测定
1.3.3.1 RNA的提取及cDNA的合成
取1.3.2节中生长至稳定期的各组菌悬液2.0 mL,于4 ℃、10 000 r/min离心3 min得菌体沉淀后,采用Trizol法提取细菌总RNA。提取完成后采用1%琼脂糖凝胶电泳检测RNA的完整性,并使用微量核酸定量仪测定各组总RNA浓度及其OD260nm/OD280nm值。待RNA完整性、浓度以及纯度达到要求后使用去除gDNA污染的cDNA合成试剂盒进行cDNA的合成。20 μL体系加入2 μg总RNA。
1.3.3.2 RT-qPCR基因表达

表1 RT-qPCR所用引物Table 1 Primer sequences used for RT-qPCR
向无酶八连管中加入10.0 μL的EvaGreen 2×qPCR MasterMix,2 μL的cDNA模板,上下引物各0.6 μL,加入无酶水补足至20 μL,轻微离心将反应液混匀,用于反转录实时荧光定量聚合酶链式反应(reverse transcription quantitative polymerase chain reaction,RT-qPCR)体系上机检测。扩增程序为:95 ℃预变性10 min;95 ℃变性15 s,60 ℃退火/延伸60 s,40 个循环。每组样品(包括阴性空白对照)做3 个平行。采用2-ΔΔCt计算方法[15]计算TDC基因簇基因的相对表达量。
1.3.4 HPLC法测定菌悬液中酪胺质量浓度变化
1.3.4.1 酪胺标准溶液的配制
准确称量10 mg酪胺标准品,用0.4 mol/L的高氯酸溶解并定容至50 mL棕色容量瓶中,分别稀释成终质量浓度为5、10、20、50、100、200 μg/mL的标准溶液。
1.3.4.2 样品的制备
取1.3.2节中供试菌菌悬液,于0、4、8、12、16、20、24、28、32、36、48 h取样,4 ℃、12 000 r/min离心10 min收集无细胞上清液。
1.3.4.3 衍生化
吸取标准品溶液和无细胞上清液样品各1 mL,置于5 mL棕色容量瓶中,按照Lu Shiling等[19]的方法进行衍生化。衍生后样品经0.22 μm滤膜过滤到样品瓶中,用于上机检测。每组样品做3 个平行。
1.3.4.4 HPLC条件
色谱柱为Symmetry C18(4.6 mm×250 mm,5 μm),流动相A为超纯水,流动相B为乙腈,色谱柱流速0.8 mL/min,紫外检测波长254 nm,进样体积10 μL,柱温30 ℃,洗脱过程如表2所示。

表2 梯度洗脱程序Table 2 Gradient elution program
1.4 数据分析
所有实验数据使用Microsoft Excel 2016建立数据库,采用Origin 2018b绘图,并用SPSS 25做显著性分析。
2 结果与分析
2.1 阿魏酸对屎肠球菌和粪肠球菌生长的影响
如图1所示,未添加阿魏酸的空白对照组细菌OD600nm值始终高于添加阿魏酸组,说明阿魏酸有效抑制了粪肠球菌XL-M66和屎肠球菌XL-M76的生长,使最终菌体数量减少,但阿魏酸并没有改变2 株菌的生长趋势,只是延长了其对数生长期。这与先前报道的阿魏酸对其他菌的抑制效果类似[20-21]。这是由于阿魏酸可以引起细菌细胞膜表面负电荷和疏水性改变,细胞膜局部破裂或形成孔洞导致细胞内溶物外泄,从而达到良好的抑菌效果[13,22]。而添加酪氨酸对2 株肠球菌的生长没有明显的影响(P>0.05)。这与Bargossi等[23]研究得出酪氨酸可以加快粪肠球菌生长速度的结果不同,这可能是因为其在菌株活化阶段分别接种于含或不含酪氨酸的培养基中,菌株已经进行酪氨酸的预适应,而本实验中供试菌均在不含酪氨酸的培养基中活化,菌株利用酪氨酸生长代谢较为缓慢。此外,由图1可以看出,粪肠球菌XL-M66阿魏酸组最终OD600nm值较空白组降低了0.69,屎肠球菌XL-M76仅降低0.39;图2中也发现粪肠球菌XL-M66阿魏酸组pH值下降趋于平缓,最终与空白组相差0.53,而屎肠球菌XL-M76 pH值下降较为迅速,仅相差0.30。综合OD600nm值和pH值可以看出,粪肠球菌XL-M66对阿魏酸的敏感性更强。

图1 阿魏酸对粪肠球菌XL-M66(A)和屎肠球菌XL-M76(B)生长抑制作用Fig. 1 Effect of ferulic acid on the growth of E. faecalis XL-M66 (A)and E. faecium XL-M76 (B)


图2 阿魏酸对粪肠球菌XL-M66(A)和屎肠球菌XL-M76(B)48 h生长过程中pH 值的变化Fig. 2 Effect of ferulic acid on pH changes during growth of E. faecalis XL-M66 (A) and E. faecium XL-M76 (B)
如图2所示,空白组培养液的pH值均在4 h后迅速下降,20 h后趋于平稳,最终pH值稳定在4.1左右。说明2 株供试菌对数期均有较强的产酸能力,进入稳定期之后,菌落数达到最大,培养基中能量被迅速消耗,代谢废物增多,菌落活性减弱,pH值下降也随之减慢。添加酪氨酸组的pH值始终高于空白组,且在菌株生长初期,培养液pH值有微弱上升。这是由于酪氨酸是合成酪胺的必要物质,随着供试菌株的生长繁殖,培养基中酪胺的质量浓度在不断积累,而酪胺属于一类碱性物质,可以中和培养液中产生的酸性物质,且在生长初期,酪胺的产生速度略高于酸性物质的产生速度。Fernández等[24]也证实在酪氨酸存在的情况下,产酪胺的坚忍肠球菌能够引起培养基pH值增加,而不产酪胺的突变体pH值则没有变化。添加阿魏酸组的曲线较为平稳且趋于稳定后pH值要高于空白组,表明阿魏酸对2 株供试菌的生长具有一定程度的抑制作用。
2.2 阿魏酸对供试菌株基因表达分析
肠球菌TDC基因簇中tyrDC、tyrP、tyrS和nhaC四种基因共同调节酪胺的生物合成,其中tyrDC负责酪胺的合成,tyrP则负责胞内胞外酪氨酸-酪胺的交换[25-26]。通过RT-qPCR可以具体检测TDC基因簇中4 种基因的表达情况。2 株肠球菌在不同条件下4 种基因的相对表达量如图3所示。
由图3可知,2 株菌添加酪氨酸组tyrDC、tyrP和nhaC的3 个基因在转录水平上均显著上调(P<0.05),其中粪肠球菌XL-M66酪氨酸组3 种基因表达水平分别达到空白组的30.1、40.0 倍和9.7 倍,屎肠球菌XL-M76为22.8、15.3 倍和47.8 倍。这是因为在酸性条件下,酪氨酸为细胞碱化脱羧反应提供了前体物质,诱导tyrDC和tyrP基因的表达进而合成酪胺抵抗胞外酸性环境[23,27]。虽然nhaC基因参与酪胺合成的具体功能作用还未可知,但可以确定的是酪氨酸可以促进nhaC基因的表达。而tyrS基因的表达量随酪氨酸的添加显著减少(P<0.05),其中粪肠球菌XL-M66和屎肠球菌XL-M76空白组基因表达量分别是酪氨酸组的11.9 倍和17.9 倍。Coton[28]和Linares[29]等研究发现粪肠球菌中tyrDC基因表达量与酪氨酸浓度呈正相关,而在缺乏酪氨酸情况下,tyrS基因被最大化转录,这与本实验研究结果一致。说明tyrS基因可能是作为TDC基因簇遗传调控的负调节系统,用来防止酪氨酸的大量脱羧,确保有可用的酪氨酸用于细胞生长和蛋白质合成。与空白组相比,添加阿魏酸促进了tyrS基因的表达,这可能是因为阿魏酸降低了肠球菌菌株活性,使之利用培养基中营养物质合成酪氨酸能力降低,培养液中游离的酪氨酸质量浓度减少,所以tyrS基因转录增多,促使酪氨酸合成相应的蛋白质。而与酪氨酸组相比,添加阿魏酸对2 株供试菌的tyrS基因表达均无显著影响(P>0.05)。
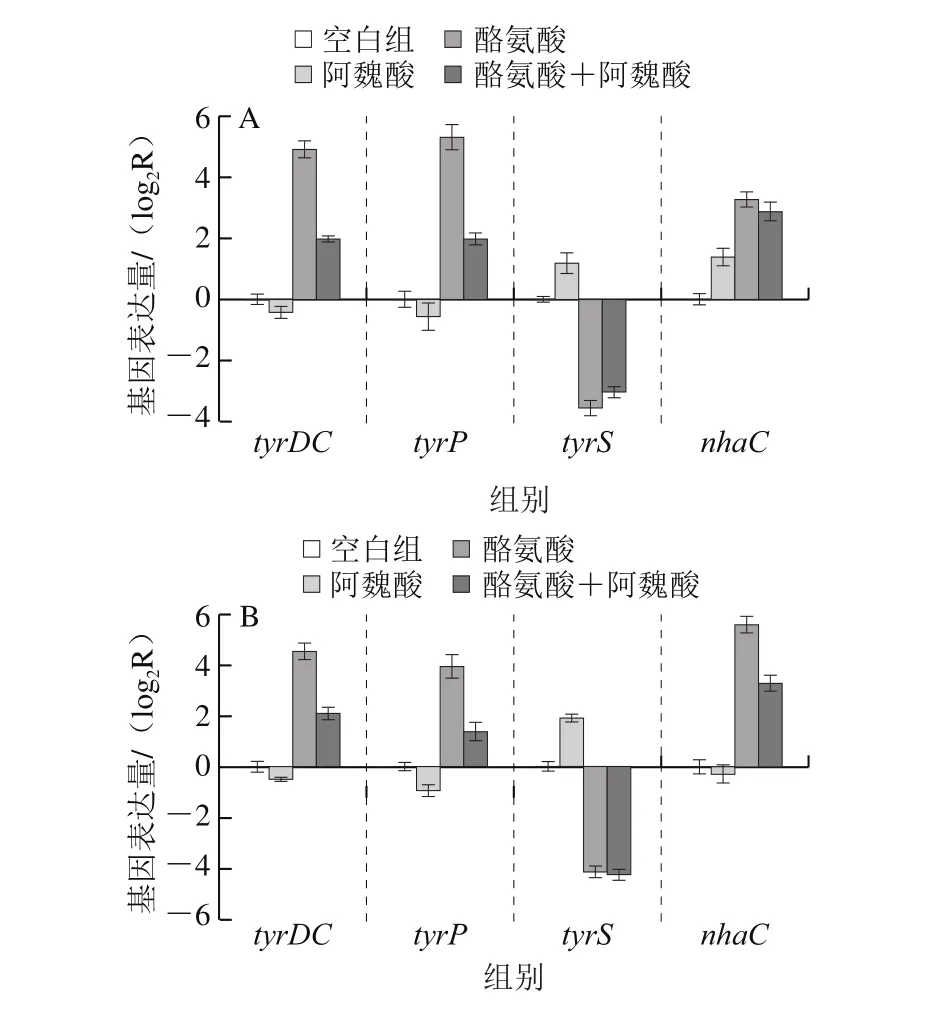
图3 阿魏酸对粪肠球菌XL-M66(A)和屎肠球菌XL-M76(B)TDC相关基因表达量影响Fig. 3 Effect of ferulic acid on the expression of tyramine synthesisrelated genes in E. faecalis XL-M66 (A) and E. faecium XL-M76 (B)
在酪氨酸存在情况下,添加阿魏酸可显著降低2 株肠球菌tyrDC、tyrP基因的表达(P<0.05),粪肠球菌XL-M66酪氨酸组tyrDC和tyrP基因表达量为酪氨酸+阿魏酸组的7.6 倍和10.3 倍,而屎肠球菌XL-M76仅为5.4 倍和5.8 倍。表明阿魏酸对粪肠球菌XL-M66 tyrDC和tyrP基因转录影响要大于屎肠球菌XL-M76。而阿魏酸影响tyrDC和tyrP基因的转录,可能是影响了酪氨酸脱羧酶以及转运蛋白的活性,使之对酪氨酸的感应能力降低,从而使相关基因表达量降低。Kang等[30]研究表明烟酸可以显著抑制屎肠球菌酪氨酸脱羧酶的活性和tyrDC基因的表达。此外,阿魏酸组与空白组的tyrDC和tyrP基因表达量无显著性差异,这表明只有在TDC途径被诱导激活情况下,阿魏酸才会对tyrDC和tyrP基因起到抑制作用,进一步说明,阿魏酸是通过影响酪氨酸脱羧酶和转运蛋白的活性控制相关基因的转录,从而减少酪胺的产生。由图3B发现,阿魏酸显著降低nhaC基因的表达(P<0.05),其中酪氨酸组的nhaC基因表达量达到酪氨酸+阿魏酸组的5.0 倍,而图3A中,阿魏酸对粪肠球菌XL-M66 nhaC基因表达没有显著作用(P>0.05)。
一些研究发现pH值是影响TDC基因簇表达的重要因素,相对较低的pH值更有利于TDC基因的诱导表达,且酪氨酸脱羧酶活性更高[18]。在酸性pH值和高浓度酪氨酸存在情况下,tyrDC和tyrP共同编码的tyrDC-tyrP多顺反子信使被诱导激活,从而激活tyrDC和tyrP基因的表达[27]。图3A中粪肠球菌XL-M66酪氨酸组tyrDC和tyrP基因表达量是酪氨酸+阿魏酸组的7.6 倍和10.3 倍,而图2A中酪胺酸组pH值始终高于酪氨酸+阿魏酸组,最终pH差值在0.3左右。图3B中,屎肠球菌XL-M76酪氨酸组tyrDC和tyrP基因表达量均达到了酪氨酸+阿魏酸组5 倍以上,相同的是图2B中酪氨酸组的pH值也处于较高水平,两组pH差值为0.2左右。这说明添加阿魏酸不仅直接抑制tyrDC和tyrP基因表达,也通过调控pH值的升高间接影响tyrDC和tyrP基因的转录表达。黄笠原等[31]在大蒜精油对德氏乳杆菌产腐胺机制影响研究中也表述了相同的结果。
2.3 阿魏酸对供试菌株产酪胺能力分析

图4 阿魏酸对粪肠球菌XL-M66(A)和屎肠球菌XL-M76(B)培养48 h酪胺积累的影响Fig. 4 Effects of ferulic acid on accumulation of tyramine in E. faecalis XL-M66 (A) and E. faecium XL-M76 (B)
如图4所示,在仅添加酪氨酸情况下,粪肠球菌XL-M66和屎肠球菌XL-M76在4~16 h均快速产生大量酪胺,20 h后酪胺产生速率明显减慢,质量浓度趋于稳定,最终分别达到227.0 μg/mL和216.6 μg/mL。这是因为细菌对数生长期代谢能力最强,能够充分利用底物合成酪胺,而到达稳定期后,由于培养基中前体物质酪氨酸被大量消耗,质量浓度降低,且酪氨酸脱羧酶的活性降低,所以酪胺的产生速率也随之减慢。由空白组可以看出,粪肠球菌XL-M66在12 h内未检出酪胺,屎肠球菌XL-M76在16 h未检出酪胺,48 h时2 株肠球菌酪胺质量浓度分别为36.6 μg/mL和26.9 μg/mL。这是由于菌株在自身生长代谢过程中会利用外界营养成分合成相应的氨基酸,但因为生长初期培养液中菌落总数少,合成的氨基酸浓度较低,无法诱导tyrDC基因的表达[27]。
由酪氨酸+阿魏酸组也可以看出,粪肠球菌XL-M66和屎肠球菌XL-M76的产酪胺能力随着阿魏酸的添加均显著降低(P<0.05),较酪氨酸组酪胺质量浓度分别减少了27.0%和19.9%。赵利利等[20]研究也发现阿魏酸可以使大肠杆菌和蜡状芽孢杆菌产组胺质量浓度降低18.45%和25.78%,这与本实验结果类似。阿魏酸不仅能够抑制肠球菌的生长,还会抑制操纵子tyrDC和tyrP转录,使酪氨酸脱羧酶质量浓度降低,从而有效减少肠球菌酪胺的积累。
3 结 论
阿魏酸对粪肠球菌XL-M66和屎肠球菌XL-M76均具有显著的抑制作用(P<0.05),且对粪肠球菌XL-M66的抑制效果要强于屎肠球菌XL-M76。在不含酪氨酸底物情况下,阿魏酸对tyrDC和tyrP基因影响不大(P>0.05),但可以促进tyrS基因的表达;添加酪氨酸,使得整个酪胺合成TDC途径被彻底激活,tyrDC和tyrP基因大量表达,此时添加阿魏酸能显著抑制tyrDC、tyrP基因的表达(P<0.05)。添加阿魏酸也能够减慢2 株菌生长过程中pH值的下降,并且使得粪肠球菌XL-M66和屎肠球菌XL-M76的酪胺产量分别降低27.0%和19.9%。因此,阿魏酸通过抑制粪肠球菌XL-M66和屎肠球菌XL-M76的数量、控制pH值降低以及tyrDC和tyrP基因的表达抑制酪胺的产生。
