甲醇芽孢杆菌凝乳酶的重组表达及其结构特性
2019-12-04吴凤玉郝一江曹永强余志坚杨贞耐
李 柳,郑 喆,吴凤玉,郝一江,赵 笑,曹永强,余志坚,陈 超,杨贞耐,,*
(1.北京食品营养与人类健康高精尖创新中心,食品添加剂与配料北京高校工程研究中心,北京工商大学,北京 100048;2.东君乳业(禹城)有限公司,山东 禹城 251200)
甲醇芽孢杆菌凝乳酶是一种具有凝乳作用的微生物蛋白酶[1]。凝乳酶在干酪生产过程中不仅起凝乳作用,还会影响干酪的质构和风味[2]。小牛皱胃酶因具有高凝乳活性和低非特异性水解活性,所产干酪的质构和风味均符合生产要求[3],此酶已作为商品凝乳酶用于干酪的生产,但由于生产成本高以及屠宰动物引发的伦理问题[4],使得寻找小牛皱胃酶代替品显得尤为重要。植物凝乳酶来源广泛,价格低廉,但植物生长周期长,凝乳活性低[5]。微生物凝乳酶易提取,酶活力高,逐渐在干酪生产中占据主导地位[6-8]。近年来随着干酪需求量的日益增加,人们越来越重视微生物凝乳酶及其基因工程酶的研究开发。大肠杆菌基因克隆原核表达系统表达外源蛋白具有繁殖迅速、培养简单、操作方便、遗传稳定、外源蛋白表达量高、易于纯化等优点[9-10],重组表达出的凝乳酶可用于干酪的制备和酶特性的后续研究。
蛋白质是生物体功能的执行者和结构的构建者[11-12],蛋白质结构的研究一直是生物学领域的热点。由于技术手段的限制,利用实验方法(主要为X-射线晶体衍射、核磁共振)解析蛋白结构投入大、周期长,此外随着分子生物学技术的成熟,越来越多的基因序列可以轻松被找到,这种序列与结构间不平衡的现象极大地限制了对蛋白质功能及其相关作用机理的理解。蛋白质高级结构的在线模拟技术为蛋白质研究提供了一种新手段[13-15]。Singh等[16]通过氨基酸序列预测了来自蜡状芽孢杆菌的谷氨酰胺酶的3D模型结构,发现该模型的活性位点富含11 个保守氨基酸残基,该预测结果针对结肠癌(HCT-116)细胞系确认该酶的抗癌活性有一定的指导意义。杭锋[17]通过Paenibacillus spp. BD3526凝乳酶酶源的编码基因和氨基酸序列,对成熟酶进行N-端氨基酸测序,确定了酶源成熟过程中的水解位点,并利用氨基酸序列进行同源比对和亲缘关系分析,确定该酶的活性中心位点和酶的分类,基于同源建模方法对其三级结构进行了预测并对模型质量进行评价。
为进一步了解微生物凝乳酶的结构特性,利用从酒曲中分离纯化并获得氨基酸序列的甲醇芽孢杆菌凝乳酶进行实验[18],将该凝乳酶基因在大肠杆菌中重组表达,并采用生物信息学方法研究其结构特性。
1 材料与方法
1.1 材料与试剂
TOP 10克隆菌株、BL21(DE3)表达菌株 卡梅德生物技术有限公司;蛋白/DNA Marker 美国Thermo Fisher公司;Ni Sepharose Fast Flow 美国GE公司;异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactopyranoside,IPTG) 上海碧云天生物科技公司;琼脂糖 上海基因公司;质粒小提试剂盒 天根生化科技有限公司;限制性内切酶/T4 DNA连接酶 宝日医生物技术(北京)有限公司;其他试剂均为国产分析纯或化学纯。
LB培养基:10 g NaCl,10 g蛋白胨,5 g酵母浸粉,加去离子水至1 L,调pH值至7.0~7.2后分装灭菌。固体培养基另加琼脂粉15~20 g。
1.2 仪器与设备
Allegra 21R台式高速离心机 美国Beckman公司;Biologic LP层析系统、Mini Protean垂直平板电泳系统、Gel Doc2000成像系统 美国Bio-Rad公司;雪花状制冰机 日本Sanyo公司;PTC-200基因扩增仪 美国MJ Research公司。
1.3 方法
1.3.1 甲醇芽孢杆菌凝乳酶基因的合成
通过NCBI GenBank数据库(https://www.ncbi.nlm.nih.gov/genbank/)检索到凝乳酶(I3EB99)的氨基酸序列为759 个氨基酸[18]。根据此氨基酸序列,在DNAMAN软件的辅助下推导出该基因的核苷酸序列,并以大肠杆菌密码子使用频率为基准,对该基因的密码子进行优化。将优化后的基因序列翻译成氨基酸序列与优化前蛋白酶的原始氨基酸序列比对,确保优化前后氨基酸序列保持一致。然后将优化后的全基因序列委托卡梅德生物科技有限公司直接进行化学合成,基因序列两端分别带有NcoI和XhoI酶切位点。
1.3.2 甲醇芽孢杆菌凝乳酶重组质粒的构建与验证
1.3.2.1 重组质粒的构建
化学合成的甲醇芽孢杆菌凝乳酶全基因序列直接进行NcoI-XhoI双酶切,定向插入pET28a(+)质粒表达载体,用T4 DNA连接酶进行连接,构建pET28a(+)重组质粒。蛋白C端融合6×His标签进行表达纯化。
1.3.2.2 TOP10克隆菌株感受态的制备
取-80 ℃冰冻菌株,用划线法接种于LB固体中,于37 ℃倒置培养12 h。从平板上挑取单个菌落接种至含有3 mL LB培养液的试管中,37 ℃振荡培养12 h。取菌液1 mL接种至含有100 mL LB培养基的500 mL三角瓶中,37 ℃剧烈振荡培养约2~3 h(200~300 r/min),当菌落OD600nm值达到0.3~0.4时,将三角瓶取出放于冰上10~15 min,在无菌条件下把菌液倒入50 mL离心管中,并在4 ℃、4 000 r/min离心10 min,然后弃上清液,将管倒置于滤纸上1 min,吸干残留的培养液,加入10 mL 0.1 mol/L的CaCl2溶液到离心管中,振荡混匀,悬浮菌体,冰浴30 min,4 ℃、4 000 r/min离心10 min,弃上清液,将管倒置于干滤纸上1 min,吸干残留的培养液,加4 mL冰预冷的0.1 mol/L的CaCl2重悬浮菌体,每管0.2 mL分装,至4 ℃保存备用。
1.3.2.3 重组质粒转化感受态菌株
构建好的pET28a(+)重组质粒表达载体用无菌水溶解后取适量与TOP10克隆菌株感受态混合,冰浴30 min后于42 ℃水浴90 s,立即冰浴2 min。在无菌条件下加入1 mL LB培养基(按照1∶1 000比例稀释卡那霉素),37 ℃培养30~60 min后,进行涂板,于37 ℃培养箱中倒置培养12~16 h。
1.3.2.4 重组质粒的扩增及鉴定
挑取pET28a(+)重组质粒单个转化菌落接种至LB液体培养基中培养12 h后,用质粒提取试剂盒进行质粒抽提,用NcoI和XhoI双酶切重组质粒,酶切产物经1%琼脂糖凝胶电泳检测。将双酶切鉴定的阳性克隆送至卡梅德生物科技有限公司测序,通过DNAMAN软件对测序结果与优化后的甲醇芽孢杆菌凝乳酶全基因序列进行比对,序列完全正确的重组质粒即为构建成功的重组表达载体。
1.3.3 重组甲醇芽孢杆菌凝乳酶的表达纯化
1.3.3.1 pET28a(+)-I3EB99转化至大肠杆菌Rosetta
将质粒1 μL加入到100 μL感受态细菌中,置冰上20 min,42 ℃热激90 s,迅速置冰中5 min再加入600 μL LB培养液中,37 ℃、220 r/min振摇1 h。离心后全部涂布于含50 μg/mL Kan+的LB平板,37 ℃倒置培养12 h。
1.3.3.2 IPTG诱导pET28a(+)-I3EB99融合蛋白的表达
挑取转化平板上的单克隆接种于含50 μg/mL Kan+的10 mL LB培养液的试管中,37 ℃、220 r/min振摇12 h。次日向培养物中加入IPTG至终浓度为0.1 mmol/L,37 ℃、220 r/min振摇4 h,诱导融合蛋白表达。取出1 mL培养物,10 000 r/min条件下室温离心2 min,弃上清液,用100 μL 1×上样缓冲液重悬菌体沉淀并直接100 ℃煮样10 min后进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE),挑选诱导表达蛋白的克隆按1∶100接种于50 μg/mL Kan+的1~2 L LB培养液中,37 ℃、220 r/min振摇至菌体OD600nm值为0.6~0.8时向培养物中加入IPTG至终浓度0.1 mmol/L,37 ℃、220 r/min振摇4 h,诱导融合蛋白表达。
1.3.3.3 pET28a(+)-I3EB99融合蛋白的纯化
诱导表达融合蛋白的菌液在4 000 r/min条件下离心10 min,收集菌体弃上清液,用磷酸盐缓冲液重悬菌体再次离心收集菌体,将0.01 mol/L磷酸盐缓冲液重悬液进行超声波破碎后按1∶1 000的比例加入cocktail,4 ℃、8 000 r/min离心20 min,取上清液。
利用低压层析系统,以0.5 mL/min流速上样至Ni-IDA Binding-Buffer预平衡的Ni-IDA-Sepharose CL-6B亲和层析系柱。用Ni-IDA Binding-Buffer(20 mmol/L Tris-HCl,0.15 mol/L NaCl,pH 8.0)以0.5 mL/min流速冲洗,至流出液OD280nm值达到基线;用Ni-IDA Washing-Buffer(20 mmol/L Tris-HCl,10 mmol/L咪唑,0.15 mol/L NaCl,pH 8.0)以1 mL/min流速冲洗,至流出液OD280nm值达到基线;用Ni-IDA Elution-Buffer(20 mmol/L Tris-HCl,50 mmol/L咪唑,0.15 mol/L NaCl,pH 8.0)以1 mL/min流速洗脱目的蛋白,收集流出液;用Ni-IDA Elution-Buffer(20 mmol/L Tris-HCl,100 mmol/L咪唑,0.15 mol/L NaCl,pH 8.0)以1 mL/min流速洗脱目的蛋白,收集流出液;用Ni-IDA Elution-Buffer(20 mmol/L Tris-HCl,150 mmol/L咪唑,0.15 mol/L NaCl,pH 8.0)以1 mL/min流速洗脱目的蛋白,收集流出液;用Ni-IDA Elution-Buffer(20 mmol/L Tris-HCl,300 mmol/L咪唑,0.15 mol/L NaCl,pH 8.0)以1 mL/min流速洗脱目的蛋白,收集流出液。上述收集的蛋白溶液加入透析袋中,用0.01 mol/L磷酸盐缓冲液(pH 7.2~7.4)进行透析12 h。
1.3.4 凝乳活力的测定
采用Arima等[19]方法。将脱脂乳溶解在浓度为0.01 mol/L的CaCl2溶液中制成10%的脱脂乳溶液,室温静置30 min后各量取5 mL分装到小试管中,于35 ℃恒温水浴箱中保温5 min,在35 ℃取重组表达的酶液0.5 mL加入到5 mL装有10%脱脂乳溶液的试管中,摇匀后开始计时,当开始出现絮状沉淀时立即停止计时。凝乳活力计算如式(1)所示:
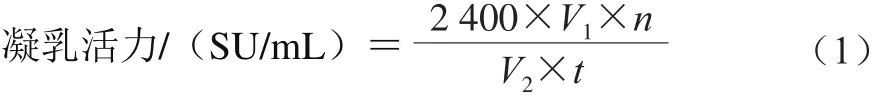
式中:V1为脱脂牛奶溶液体积/mL;t为凝乳时间/s;V2为所加酶液体积/mL;n为稀释倍数。
1.3.5 金属离子对甲醇芽孢杆菌凝乳酶凝乳活力的影响
为确定不同金属离子对凝乳酶凝乳活力的影响,分别用含有50 mmol/L的K+、Na+、Mg2+、Zn2+、Al3+、Cu2+、Fe2+、Ca2+溶液溶解凝乳酶,以去离子水为空白对照,25 ℃孵育30 min,分别按照1.3.4节方法测定凝乳活力。
1.3.6 蛋白水解活力的测定
根据张富新[20]的福林-酚试剂法测定。准确称取酪蛋白1.0 g用浓乳酸润湿后,加入pH 3.0的乳酸缓冲液80 mL,在沸水浴中边加热边搅拌直至完全溶解,冷却后用乳酸缓冲液稀释至100 mL,即为10 g/L的酪蛋白溶液。
取1 mL酶液于试管中,40 ℃保温2 min,加入10 g/L酪蛋白1 mL,摇匀后在相同温度下保温10 min,再加入0.4 mol/L三氯乙酸溶液2 mL,摇匀终止反应并取出静置10 min,过滤后加入0.4 mol/L碳酸钠溶液5 mL,福林试剂使用液1 mL,置于40 ℃水浴中显色20 min,取出于波长680 nm测定其吸光度,其标准曲线方程为:Y=0.009 5X+0.002 3。蛋白水解活力计算如式(2)所示:
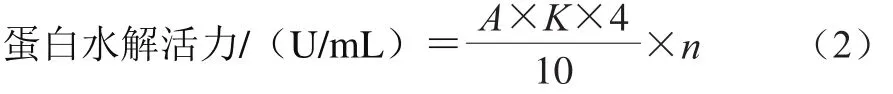
式中:A为样品吸光度;K为吸光常数;4为反应试剂总体积4 mL;10为反应时间10 min;n为稀释倍数。
1.3.7 重组甲醇芽孢杆菌凝乳酶质量浓度测定
凝乳酶含量采用Easy II Protein Quantitative Kit BCA试剂盒进行测定[21],实验步骤参照BCA蛋白定量试剂盒说明书进行:1)先将solution A摇晃混匀,根据样品数量,按solution A、solution B试剂体积比50∶1配制成BCA工作液,充分混匀;2)标准品的制备:完全溶解蛋白质标准品(2 mg/mL BSA,-20 ℃保存)按照说明书进行稀释;3)凝乳酶样品的制备:将凝乳酶样品进行稀释;4)将配备好后的标准品和样品每孔25 μL加入96 孔板中,并做复孔;5)每孔加入200 μL工作液,振荡混匀30 s;6)将酶标板37 ℃孵育30 min;7)冷却至室温后,用酶标仪测定吸光度A562nm;8)根据说明书,作标准曲线,确定凝乳酶终质量浓度。
1.3.8 SDS-PAGE分析
按照朱广廉等[22]方法进行测定。
1.3.9 甲醇芽孢杆菌凝乳酶的结构预测[23]
分别对甲醇芽孢杆菌凝乳酶的亲/疏水性(http://web.expasy.org/protscale/)、跨膜特性(http://www.cbs.dtu.dk/services/TMHMM/)、信号肽(http://www.cbs.dtu.dk/services/SignalP)和二级结构(http://www.cbs.dtu.dk/services/SignalP)进行预测。
登录PDB(Protein Data Bank)数据库(http:// www.rcsb.org/pdb/home/home.do)检索甲醇芽孢杆菌凝乳酶的同源蛋白质,作为其三级结构的预测模板,登录SWISS -MODEL在线网址(http://www.swissmodel.expasy.org/),选择Alignment Mode模式,分别上传凝乳酶的氨基酸序列和模板蛋白的氨基酸序列,对凝乳酶的三级结构进行预测。利用Swiss-Pdb Viewer(https://spdbv.vital-it.ch/)对建立的模型结构进行评估。
2 结果与分析
2.1 甲醇芽孢杆菌凝乳酶基因的密码子优化设计与全基因合成

图1 甲醇芽孢杆菌凝乳酶基因的优化Fig. 1 Optimization of MCE gene from B. methanolicus
按照所选宿主菌大肠杆菌的密码子使用频率、密码子分布和GC含量对甲醇芽孢杆菌凝乳酶基因的密码子进行优化,结果如图1所示。优化后的凝乳酶基因所含密码子大部分由大肠杆菌偏爱密码子构成而很少含有稀有密码子,并按照大肠杆菌密码子的使用频率进行分布,此外优化后的GC含量为47%,这有利于基因的直接合成(图1A)。通过化学合成获得了优化后的甲醇芽孢杆菌凝乳酶全基因序列(图1B)。将优化后的凝乳酶全基因序列通过DNAMAN软件翻译成相应的氨基酸序列,与NCBI中初始的氨基酸序列进行了比对,优化前后氨基酸序列完全一致。
2.2 甲醇芽孢杆菌凝乳酶重组表达载体的构建和鉴定结果
甲醇芽孢杆菌凝乳酶全基因和表达载体pET28a(+)经NcoI和XhoI双酶切并通过T4 DNA连接酶进行连接后,构建了重组表达载体pET28a(+)-I3EB99,然后转化到TOP10克隆菌株中发酵培养后用NcoI和XhoI双酶切,1%琼脂糖凝胶电泳检测,发现有2 条电泳条带(图2A),其大小刚好与5 369 bp长度的载体片段及2 214 bp长度的目的片段相符,表明目的基因片段已成功连接到表达载体上。
将双酶切鉴定为阳性的克隆送至卡梅德生物科技有限公司进行测序鉴定,然后将重组质粒的测序结果与甲醇芽孢杆菌凝乳酶的基因序列通过DNAMAN软件进行比对,发现测序结果与优化后的基因序列完全一致,部分比对结果见图2B,说明插入的目的基因序列正确,重组表达载体pET28a(+)-I3EB99已构建成功。

图2 甲醇芽孢杆菌凝乳酶重组表达载体的鉴定Fig. 2 Identification of recombinant expression vector
2.3 甲醇芽孢杆菌凝乳酶在大肠杆菌中的诱导表达
图3 为重组表达载体在大肠杆菌中诱导表达的SDSPAGE图,与未诱导相比,分子质量为80.34 kDa的甲醇芽孢杆菌凝乳酶在大肠杆菌中成功诱导表达,挑选表达成功的甲醇芽孢杆菌凝乳酶的克隆子在发酵液中进一步扩大培养,诱导融合蛋白大量表达。

图3 甲醇芽孢杆菌凝乳酶诱导表达结果Fig. 3 SDS-PAGE pattern showing induced expression of MCE
2.4 重组甲醇芽孢杆菌凝乳酶的分离纯化

图4 甲醇芽孢杆菌凝乳酶的纯化结果Fig. 4 Purification of recombinant MCE from B. methanolicus

表1 不同金属离子对甲醇芽孢杆菌凝乳酶凝乳活性的影响Table 1 Effect of different metal ions on recombinant MCA
IPTG诱导表达的融合蛋白pET28a(+)-I3EB99在低温条件下通过镍柱进行分离纯化,收集洗脱液浓缩透析后对各洗脱峰进行SDS-PAGE,结果发现咪唑浓度为150 mmol/L时蛋白洗脱效果最好(图4A),但经过反复实验均发现分子质量为80.34 kDa的目标凝乳酶在纯化后的SDS-PAGE结果中存在分子质量约为45 kDa和35 kDa的两个小分子蛋白,且二者分子质量总和为目标凝乳酶分子质量。因此可推测目标凝乳酶在纯化洗脱过程中可能发生了自身剪切,自主降解为两个小分子蛋白,最终得到的是3 个蛋白混合物,加入蛋白酶抑制剂cocktail后自身降解现象可被部分抑制,有文献报道指出,乙二胺四乙酸的存在可完全抑制蛋白酶的自身降解[24],但同时也会使酶活完全损失。一般而言内源蛋白的产生和降解都维持在一个平衡状态,因此在稳定的环境因素下细胞内的蛋白含量也是稳定的[25],但是在体外研究中,蛋白合成过程终止,从而降解大大增强。得到的该蛋白组分只有溶解在含50 mmol/L的Mg2+溶液中时会产生凝乳效果(表1),且具有凝乳活性的蛋白酶组分质量浓度测定结果为0.70 mg/mL,凝乳活力为(15 870±1.17)SU/g,蛋白水解活力为(263.81±0.94)U/g,即凝乳活力/蛋白水解活力(C/P)值为60.16,与文献中已报道的C/P值为80.45[26]相接近。该酶溶解在其他金属离子溶液中的蛋白酶不具有凝乳能力,说明此凝乳酶的凝乳活力可通过Mg2+进行活化。待蛋白酶完全降解后得到2 个小分子蛋白后(图4B),丧失了凝乳能力,说明该蛋白酶在分离纯化的同时会发生自我断裂使保持其具有凝乳活性的蛋白结构遭到破坏。将分离纯化后具有凝乳活性的凝乳酶放在-80 ℃保存备用。
2.5 重组甲醇芽孢杆菌凝乳酶的结构特性
2.5.1 甲醇芽孢杆菌凝乳酶的结构预测结果
通过在http://web.expasy.org/protscale/中对凝乳酶的亲/疏水性对比结果表明,甲醇芽孢杆菌凝乳酶具有很强的疏水性,在图5A中表现为负值,疏水性有利于蛋白质向内部折叠形成两亲性α-螺旋或β-折叠,蛋白结构的稳定在很大程度上有赖于分子内的疏水作用。甲醇芽孢杆菌凝乳酶的这一特性与周筠梅等[27]报道的胰凝乳蛋白酶强疏水性保持一致。图5B显示该凝乳酶含有少量跨膜区蛋白(膜蛋白),大部分蛋白位于膜外侧,膜蛋白是蛋白酶的催化组分,由疏水区组成,以α-螺旋形式存在,位于胞质内,可形成有生物功能的二聚体[28]。从图5C可以看出,凝乳酶的信号肽位于前30 个氨基酸,信号肽是引导新合成的蛋白质向分泌通路转移的短肽链,是在新合成多肽链中用于指导蛋白质跨膜转移(定位)的N-末端的氨基酸序列[29]。外源蛋白在宿主菌,如大肠杆菌中的表达形式多为细胞内不溶性表达即容易形成包涵体,少数为细胞外分泌表达,利用信号肽引导外源蛋白定位分泌到细胞特定区间,提高可溶性,可避免因包涵体复性带来的困难[30-31]。在甲醇芽孢杆菌凝乳酶的重组表达中,凝乳酶基因连接上信号肽后在大肠杆菌中得到了分泌表达。图5D显示甲醇芽孢杆菌凝乳酶的二级结构预测。二级结构是指多肽链中主链原子的局部空间排布构象,主要包括α-螺旋、β-折叠和无规卷曲,其中α-螺旋在二级结构中起主要的稳定作用[32],结果显示该凝乳酶的α-螺旋结构明显少于β-折叠结构,可能这是此凝乳酶在分离纯化过程中易降解的原因。
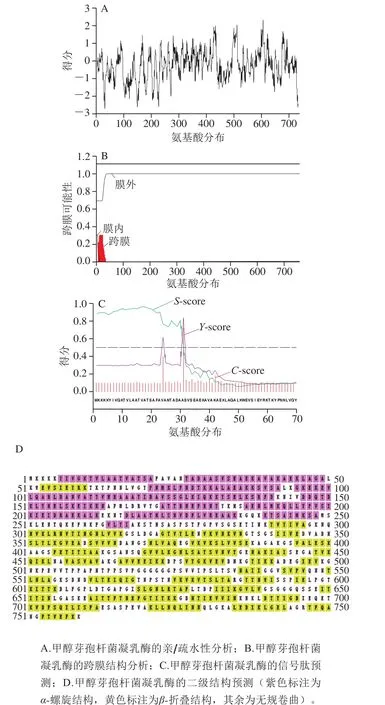
图5 甲醇芽孢杆菌凝乳酶的结构分析Fig. 5 Structural analysis of recombinant MCE from B. methanolicus
2.5.2 甲醇芽孢杆菌凝乳酶的序列鉴定
通过NCBI数据库对凝乳酶的氨基酸序列进行同源比对,选择序列同源性相似度高的蛋白质构建了发育树[33](图6A),发现凝乳酶的同源蛋白为hypothetical protein Bacillus methanolicus,且序列相似度为100%。进一步对这2 种蛋白的氨基酸进行全序列比对,图6B显示这2 种蛋白质氨基酸序列完全一致。甲醇芽孢杆菌凝乳酶的同源蛋白为来自甲醇芽孢杆菌的一种未知蛋白,也进一步说明了甲醇芽孢杆菌凝乳酶是一种未知蛋白酶,有广阔的研究开发前景。

图6 甲醇芽孢杆菌凝乳酶的同源性分析Fig. 6 Homology analysis of recombinant MCE from B. methanolicus
2.5.3 甲醇芽孢杆菌凝乳酶的高级结构
通过SWISS-MODEL同源建模的方法确定凝乳酶在PDB蛋白数据库中的模板蛋白2ra1.1.A,序列相似度为30.93%,有文献指出相似度大于30%即可用同源建模的方法进行蛋白结构预测[34],因此该方法适用于甲醇芽孢杆菌凝乳酶,且GMQE值为0.13,介于0~1之间,QMEAN值为-2.64均说明该模型拟合良好。进一步用Ramachandran图[35]对模型的可靠性进行评估,94.09%的氨基酸落入核心区,说明构建的三维结构二面角分布和立体构象均较为合理,符合立体化学二面角分布的要求,通过模型评估数据证明该模型可靠。最终得到的甲醇芽孢杆菌凝乳酶的三维结构模型如图7A所示。
蛋白质主要由碳、氢、氧、氮等化学元素组成,是一类重要的生物大分子。蛋白质维持自身稳定需要正确折叠为一个特定构型,主要通过大量的非共价键相互作用(氢键、离子键、范德华力和疏水作用)实现,此外在一些蛋白质折叠中,一些二硫键也起到关键作用。为进一步研究甲醇芽孢杆菌凝乳酶的三维结构特性,利用Swiss-Pdb Viewer对其原子构成、氢键分布和分子表面的电势情况进行预测。其中图7B为甲醇芽孢杆菌凝乳酶的原子分布情况,碳原子、氢原子、氧原子、氮原子共同形成了凝乳酶的结构,包括氨基、羧基以及进一步盘曲折叠形成的多肽链等,是必不可少的一部分。图7C为凝乳酶分子表面所形成的氢键,在二级结构如α-螺旋和β-折叠片中,氢键广泛存在并形成复杂网络[36],从而起到稳定蛋白质二级结构的作用。图7D为凝乳酶分子表面的静电势分布情况,凝乳酶的分子表面几乎全被高电势笼罩,使凝乳酶得到很好保护,利于结构的稳定,静电势高还可在蛋白互作研究中大大提高分子对接的效率和准确性[37]。

图7 甲醇芽孢杆菌凝乳酶的高级结构预测结果Fig. 7 Advanced structural prediction of recombinant MCE from B. methanolicus
3 结 论
本研究通过基因工程实验重组表达出甲醇芽孢杆菌凝乳酶,并对其结构进行了预测。发现该凝乳酶保持其具有凝乳活性的蛋白结构不稳定,在分离纯化过程中发生自我剪切主动降解为2 个小分子蛋白且完全降解后丧失凝乳活性,这与该凝乳酶二级结构中α-螺旋含量较少相吻合。此外该凝乳酶具有很强的疏水性,存在跨膜蛋白和信号肽,二级结构较不稳定,并且与来自甲醇芽孢杆菌的hypothetical protein具有同源性且氨基酸序列完全一致,SWISS-MODEL同源建模方法成功确定了甲醇芽孢杆菌凝乳酶在PDB蛋白数据库中的模板蛋白2ra1.1.A。本实验为进一步研究甲醇芽孢杆菌凝乳酶的作用机制和功能特性提供了良好的分析依据。
