地衣芽孢杆菌L-天冬酰胺酶I型 的克隆表达及其在降低薯条中丙烯酰胺的应用
2019-12-04陈菊花焦琳舒谢亚娟陆兆新吕凤霞
陈菊花,焦琳舒,谢亚娟,陆兆新,张 充,吕凤霞*
(南京农业大学食品科技学院,江苏 南京 210095)
L-天冬酰胺酶(EC.3.5.1.1)可将L-天冬酰胺侧链的酰胺基水解成天冬氨酸和氨,是一种氨基水解酶类。L-天冬酰胺酶可用于临床治疗急性淋巴细胞白血病,霍奇金淋巴瘤和淋巴系统恶性肿瘤等多种疾病[1-2],受到了国内外的高度关注。此外,L-天冬酰胺酶可有效降低热加工食品中潜在致癌物丙烯酰胺质量浓度,在食品加工领域中也显示出巨大的应用价值。丙烯酰胺具有潜在的神经毒性、遗传毒性以及致癌性,高淀粉类食品经高温油炸、烘焙或烧烤后都会产生丙烯酰胺[3-4]。L-天冬酰胺是丙烯酰胺形成的重要的前体物质,L-天冬酰胺和还原糖在高于120 ℃的温度下发生美拉德反应生成丙烯酰胺[5-6]。而经L-天冬酰胺酶处理后,食品原材料中的游离L-天冬酰胺被水解,可从源头上抑制食品中丙烯酰胺的产生。目前,仅有丹麦诺维信公司生产的来源于米曲霉的Acrylaway®和荷兰帝斯曼公司生产的黑曲霉来源的Prevent ASeTM商品酶,实现了在食品加工中的应用[7]。而国内在该领域的研究还相对薄弱,尚未有自主创新的商品化L-天冬酰胺酶制剂。因此,根据工业酶的需求出发,开发产量高、稳定性好、催化效率高的新型L-天冬酰胺酶制剂,从源头上控制热加工食品中丙烯酰胺形成具有十分重要的意义。
L-天冬酰胺酶来源广泛,从微生物(细菌、霉菌、酵母、放线菌和藻类),到高等生物(植物、脊椎动物和动物组织)均发现有L-天冬酰胺酶的存在[8],如豚鼠[9]、睡茄[10]、微藻[11]、欧文氏菌[12]、酿酒酵母[13]等。根据其序列及结构同源性的差异,L-天冬酰胺酶可被分为两种不同的类型:I型和II型。I型酶存在于细胞质中,通常具有较低的底物亲和力,无抗肿瘤活性,仅应用于食品加工领域;II型酶存在于细胞周质中[14],底物亲和力普遍较高,可应用于食品加工与医药领域[15-16]。近年来,L-天冬酰胺酶的应用研究多集中于II型酶,枯草芽孢杆菌[17]、巨大芽孢杆菌[18]、巴伦氏类芽孢杆菌[19]等多种不同来源的L-天冬酰胺酶II型皆被证实了具有抑制高热加工食品中丙烯酰胺生成的能力,而有关I型酶的应用研究相对较少,有关于地衣芽孢杆菌L-天冬酰胺酶I型的应用研究鲜见报道。
本实验室在前期研究中筛选到一株具有L-天冬酰胺酶活力的地衣芽孢杆菌(Bacillus licheniformis Z-1,菌种保藏号:CGMCC NO:17310)。为了提高地衣芽孢杆菌L-天冬酰胺酶的表达量,降低其纯化难度,将地衣芽孢杆菌L-天冬酰胺酶I型酶基因克隆,并实现了其在大肠杆菌BL21(DE3)中的表达,进行了重组酶的酶学性质研究。同时,探究了其在油炸土豆中的丙烯酰胺降解能力,为I型酶在食品中的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
L-天冬酰胺酶产生菌株B. licheniformis Z-1、克隆宿主Escherichia coli DH5α和表达L21(DE3)均由南京农业大学酶工程实验室保藏。
LB培养基:胰蛋白胨10 g/L、酵母提取物5 g/L、NaCl 10 g/L。
限制性内切酶Nde I与Xho I、Taq DNA聚合酶、T4 DNA连接酶、pMD19-T连接试剂盒 大连宝生物(TaKaRa)公司;pET-30a(+)表达载体 德国Novagen公司;柱式质粒提取试剂盒、DNA凝胶回收试剂盒、DNA Marker 南京诺唯赞生物科技有限公司;氨苄青霉素、卡那霉素、异丙基-β-D-硫代半乳糖苷(isopropylβ-D-thiogalactopyranoside,IPTG)、琼脂糖、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)(分子级)、Tris生工生物工程(上海)股份有限公司;基因组Bacterial DNA kit试剂盒 美国Omega Bio-Tek公司;其他试剂均为国产分析纯。
1.2 仪器与设备
PTC-100TM聚合酶链式反应(polymerase chain reaction,PCR)仪 美国MJ Research公司;JS-380C全自动数码凝胶成像仪 上海培清科技有限公司;58410R冷冻高速离心机 德国Eppendorf公司;JY92-2D超声波破碎仪、SB5200DT超声波清洗机 宁波新芝科学仪器研究所;UV-2450紫外分光光度计 日本岛津公司;Pow PacTM高电流电泳仪 美国Bio-Rad有限公司;Heidolph旋转蒸发仪、6410Triple Quad LC/MS质谱仪美国Agilent公司。
1.3 方法
1.3.1 基因克隆和序列分析
参照GenBank中公布的B. licheniformis的全基因组序列(CP005965.1),利用primer premier 5.0软件设计编码天冬酰胺酶ansA基因的引物序列,即含有Nde I酶切位点(下划线)上游引物BlAase I-F:5’-CCGCATATGATGA AAAAGAAAGTAGCTCTTATTACAACA-3’,含有Xho I酶切位点(下划线)下游引物BlAase I-R:5’-CCGCTCG AGGTAGCAGAATTTGTCTTTTATGCCTT-3’。用Omega Bio-Tek公司基因组DNA提取试剂盒抽提B. licheniformis Z-1的基因组DNA,以其为模板扩增ansA片段。将PCR产物胶回收后与pMD19-T载体连接,连接产物转入克隆宿主E. coli DH5α。对菌液PCR验证正确的转化子进行摇瓶增菌和抽提质粒,随后送往生工生物工程(上海)股份有限公司测序。
1.3.2 重组菌株E. coli BL21(DE3)/pET-30a(+)-BlAase I的构建和表达
用Nde I和Xho I限制性内切酶对上述重组质粒PMD19-T-BlAase I和表达载体pET-30a(+)分别进行双酶切。酶切产物经1%琼脂糖凝胶电泳验证后,使用胶回收试剂盒进行回收。通过T4 DNA连接酶将目的基因ansA片段与pET-30a(+)载体片段进行连接,转化克隆宿主E. coli DH5α。将PCR验证结果正确的阳性转化子进行质粒提取,得到重组表达质粒pET-30a(+)-BlAase I。重组质粒pET-30a(+)-BlAase I和空载质粒pET-30a(+)分别转入表达宿主E. coli BL21(DE3)。挑取单克隆接种至30 mL LB(50 μg/mL卡那霉素)液体培养基中,并在37 ℃、180 r/min培养12 h,以此为种子液。以1%的接种量转接到新鲜的100 mL LB(50 μg/mL卡那霉素)液体培养基中,于37 ℃、180 r/min培养约至OD600nm为0.6~0.8时,立即加入IPTG至终质量浓度100 μg/mL,180 r/min、16 ℃条件下诱导16 h。以重组菌E. coli BL21(DE3)/pET-30a(+)作为对照。
1.3.3 重组酶的分离纯化
4 ℃、8 000×g离心5 min收集菌体,将菌体充分重悬于50 mmol/L磷酸盐缓冲液(pH 8.0)中,之后采用超声波破碎仪处理重悬液(破碎参数40 W,工作1 s、停2 s,共超声15 min)。破碎液于4 ℃、12 000×g离心30 min,所得上清液即为L-天冬酰胺酶粗酶液。因目标蛋白N端融合了His组氨酸标签,故可通过镍柱亲和层析对重组L-天冬酰胺酶进行纯化。对粗酶和纯化后的重组L-天冬酰胺酶进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分析,采用Bradford法[20]测定蛋白浓度。
1.3.4 酶活性测定
通过参考N e s s l e r试剂法[21]测定酶活性。将189 mmol/L L-天冬酰胺底物溶液100 μL和粗酶液100 μL加入700 μL Tris-HCl缓冲液(pH 8.0)中,混匀后于37 ℃水浴反应20 min,加100 μL 25%三氯乙酸(trichloroacetic acid,TCA)溶液终止反应。混合物12 000 r/min离心1 min。取40 μL上清液和100 μL Nessler加入860 μL超纯水中,显色10 min,测定436 nm波长处吸光度。空白对照组则先加入TCA终止反应,然后进行水浴处理。酶活性单位定义:在pH 8.0和37 ℃的反应条件下,每分钟水解L-天冬酰胺生成1 μmol氨所需要的酶量被定义为1 个酶活力单位。
1.3.5 重组酶酶学性质研究
1.3.5.1 重组酶的最适反应pH值和pH值稳定性
将酶溶液分别置于pH 6.0~11.0缓冲液中,于37 ℃测定酶活性以确定最佳反应pH值。将酶溶液在4 ℃的pH 6.0~11.0的缓冲液中储存12 h,以处理0 h酶活性为100%,测定相对酶活力,研究重组酶的pH值稳定性。
1.3.5.2 重组酶的最适反应温度和温度稳定性
将酶液置于25~60 ℃范围内进行酶促反应,测定酶活性确定最适反应温度。将酶液分别置于4、40、45、50、60 ℃孵育12 h,间隔1 h取样,以处理0 min酶活性作为100%,于最适pH值和最适温度条件下测定相对酶活力,研究重组酶的温度稳定性。
1.3.5.3 金属离子对重组酶活性的影响
在酶活性测定体系中添加终浓度为1 mmol/L的不同金属离子(K+、Na+、Zn2+、Ca2+、Mg2+、Mn2+、Fe2+、Cu2+、Fe3+),以无添加金属离子所测酶活性为100%,测定相对酶活力。
1.3.5.4 重组酶的酶促动力学性质
以200 mmol/L的L-天冬酰胺、D-天冬酰胺、L-谷氨酰胺、L-天冬氨酸、D-天冬氨酸、L-谷氨酸分别作为底物进行酶促反应,研究纯化的重组L-天冬酰胺酶的底物专一性。以6~18 mmol/L L-天冬酰胺为底物,在最适反应条件下测量酶活性。酶活性测定方法与L-天冬酰胺酶活性测定方法一致。采用Lineweaver-Burk法作图,得到米氏常数Km和最大反应速率Vmax。
1.3.6 重组酶在薯条中的应用
1.3.6.1 薯条制作工艺流程
参考Franco等[22]方法。将土豆洗净并去皮,切成长条形(5 mm×5 mm×70 mm),在自来水下漂洗1 min去除表面的淀粉。将样品分离成4 份,预处理如下:1)浸泡在超纯水中,40 ℃放置30 min;2)浸泡于5 IU/mL重组L-天冬酰胺酶溶液中,40 ℃放置30 min;3)浸泡于20 IU/mL重组L-天冬酰胺酶溶液中,40 ℃放置30 min;4)浸泡于30 IU/mL重组L-天冬酰胺酶溶液中,40 ℃放置30 min。将浸泡后的土豆条沥干后置于鼓风干燥箱内,60 ℃干燥10 min。将每个处理组的土豆条分别于175 ℃预炸1 min后置于-20 ℃冷冻48 h,175 ℃油炸5 min后沥油冷却干燥。
1.3.6.2 土豆中游离L-天冬酰胺和L-天冬氨酸的提取及检测
参考赵岩等[23]方法,略作修改。将油炸前干燥后的土豆条粉碎,称取5 g,加入质量分数50%的乙醇溶液50 mL,超声30 min,抽滤,将滤液于50 ℃旋转蒸干有机溶剂,用0.1 mol/L HCl溶液定容至5 mL,过0.45 µm滤膜,上样检测。
对土豆中游离的L-天冬酰胺和L-天冬氨酸进行高效液相色谱-质谱联用法检测,色谱柱C18(100 mm×2.1 mm,1.8 μm)。检测参数:流动相甲醇-0.05 mol/L乙酸铵(2∶98,V/V),等度洗脱;流速0.3 mL/min;柱温35 ℃;波长210 nm;进样量10 µL;电喷雾电离源正离子模式;L-天冬酰胺检测离子m/z 74.2、87.1;L-天冬氨酸检测离子m/z 88.1、116.1。
1.3.6.3 薯条中丙烯酰胺的提取及检测
参考程江华等[24]提供的方法,略作修改。10 g均质后的薯条(粉碎、烘干),加入40 mL正己烷脱脂,重复3 次。加入50 mL去离子水、50 mL乙腈、20 g MgSO4和5 g NaCl,振荡2 min,超声水浴30 min,10 000×g离心10 min,取乙腈层(上层)于旋转蒸发仪中将乙腈旋干,加1 mL超纯水复溶,过0.45 µm滤膜,高效液相色谱(high performance liquid chromatography,HPLC)法检测。
H P L C参数:A g i l e n t H C-C18色谱柱(4.6 mm×250 mm,5 µm);流动相甲醇-水(10∶90,V/V),等度洗脱;流速0.5 mL/min;柱温31 ℃;波长210 nm;进样量20 µL。
2 结果与分析
2.1 酶基因扩增和序列分析
以B. licheniformisZ-1基因组DNA为模板,扩增ansA基因如图1所示,目的条带长度在1 000 bp左右,测序结果显示该基因序列为972 bp,编码324 个氨基酸,证明B. licheniformisZ-1L-天冬酰胺酶ansA基因已克隆成功,命名为BlAase I型。为了分析不同微生物来源的L-天冬酰胺酶的亲缘关系,将BlAase I型和目前已发表的5 种L-天冬酰胺酶I型绘制系统进化树(图2)。进化树显示BlAase I型与古菌Pyrococcus furiosus和Pyrococcus horikoshii来源的L-天冬酰胺酶I型在进化关系上更为相近。

图1 B. licheniformis Z-1中ansA基因PCR扩增产物的琼脂糖凝胶电泳图Fig. 1 Agarose gel electrophoresis of PCR-ampli fied ansA gene from B. licheniformisZ-1

图2 不同来源L-天冬酰胺酶I型的系统进化树Fig. 2 Neighbor-Joining phylogenic tree of L-asparaginases type I from various bacterial sources
2.2 重组L-天冬酰胺酶的表达与纯化
重组酶粗酶活为(63.64±3.18) IU/mL,通过Ni柱纯化后,重组酶比活力为945.79 IU/mg,纯化倍数为21.70 倍,回收率为71.4%(表1)。对重组酶进行SDSPAGE电泳验证,结果表明,目的蛋白在35 kDa左右有单一条带(图3),与理论值36.6 kDa相符合。

表1 酶的分离纯化步骤Table 1 Summary of enzyme purification steps

图3 SDS-PAGE检测Fig. 3 SDS-PAGE of crude and purified enzyme
2.3 酶学性质研究
2.3.1 重组酶的最适反应pH值和pH值稳定性
将重组酶置于37 ℃、pH 6.0~11.0的条件下进行酶活力测定。结果如图4A所示,重组酶的最适反应pH 10.0。将重组酶在pH 6.0~11.0的缓冲液中4 ℃条件下储存12 h后,测定重组酶相对酶活力。其pH值稳定性结果如图4B所示,重组酶pH值稳定性较好,在pH 6.0~11.0范围内储存12 h仍保留60%以上的活性。此重组酶具有一个相对较宽的pH值活性范围,在碱性的环境中都表现出良好的催化活性。

图4 pH值对重组酶活力的影响Fig. 4 Effect of pH on the recombinant enzyme activity
2.3.2 重组酶的最适反应温度和温度稳定性
将重组酶置于pH 8.0,温度范围为25~60 ℃条件下进行酶活力测定。结果如图5A所示,重组酶最适反应温度为45 ℃。将重组酶置于不同温度下,每隔一段时间取样,在最适反应pH值及最适反应温度下测定酶活力。结果如图5B所示,该重组酶在低温(4 ℃)条件下保存稳定,12 h后相对酶活力仅下降3.79%。当在较高温度(40 ℃和45 ℃)处理12 h后,相对酶活力仍高于90%。当温度高于45 ℃时,酶的热稳定性显著降低,在50 ℃存放10 h后相对酶活下降至30.62%,在60 ℃存放8 h后相对酶活力仅为3.87%。

图5 温度对重组酶活力的影响Fig. 5 Effect of temperature on the recombinant enzyme activity
2.3.3 金属离子对重组酶活力的影响
研究终浓度为1 mmol/L的不同金属离子对重组酶活力的影响,结果见表2。其中,Mn2+、Mg2+和K+对重组酶具有显著激活作用,Mn2+的作用效果最强;而Zn2+对重组L-天冬酰胺酶有抑制作用,使其相对酶活力降低至(82.95±1.23)%;其余各金属离子对酶活力无显著影响。

表2 金属离子对重组酶活力的影响Table 2 Effect of metal ions on the recombinant enzyme activity
2.3.4 重组酶底物特异性与动力学研究
测定重组酶对不同底物的作用效果,结果如图6所示。该重组酶能水解L-天冬酰胺和D-天冬酰胺,但对D-天冬酰胺的活性仅为L-天冬酰胺的23.38%,对L-谷氨酰胺等其他4 种底物均无活性。
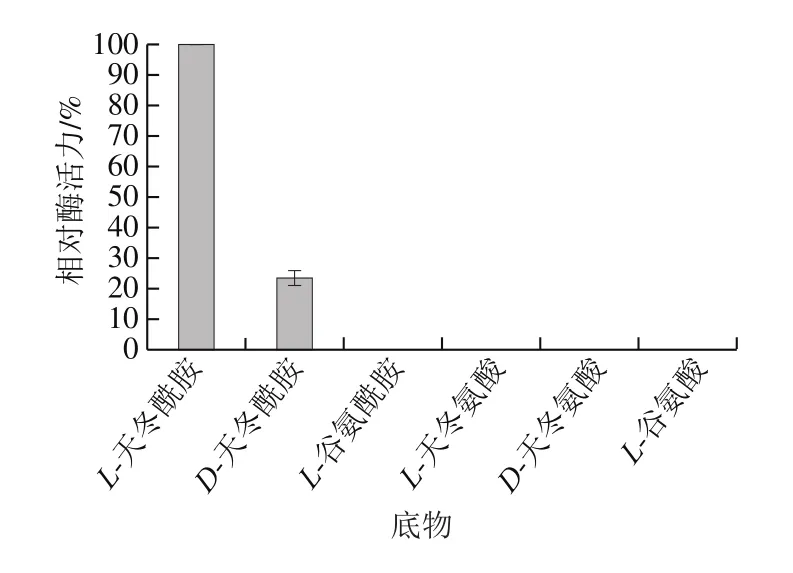
图6 重组酶的底物特异性Fig. 6 Substrate specificity of the recombinant enzyme
使用Lineweaver-Burk双倒数作图,计算重组酶对底物L-天冬酰胺的Km和Vmax,结果见图7,米氏常数Km为12.19 mmol/L,最大反应速率Vmax为2.69 IU/mL。
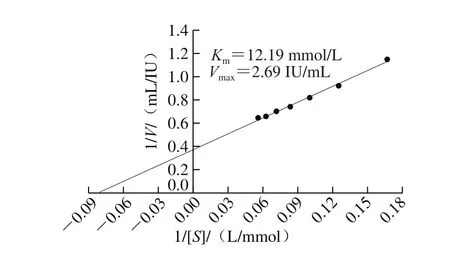
图7 重组酶动力学常数Lineweaver-Burk图Fig. 7 Lineweaver-Burk plot for determining the kinetic parameters of the recombinant enzyme
2.4 重组酶处理对薯条中丙烯酰胺含量的影响
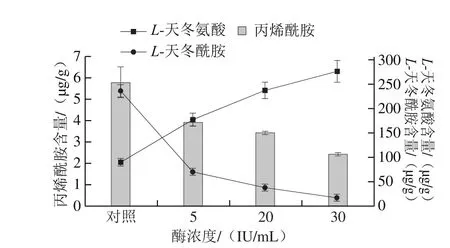
图8 酶浓度对L-天冬酰胺、L-天冬氨酸及丙烯酰胺含量的影响Fig. 8 Effect of L-asparaginase concentration on the contents of L-asparagine, L-aspartic acid and acrylamide of French fries
比较不同酶的浓度对油炸前土豆条中的L-天冬酰胺、L-天冬氨酸含量以及油炸后薯条中丙烯酰胺质量浓度的影响,结果如图8所示。L-天冬酰胺作为丙烯酰胺的重要前体物质,随着酶浓度的增加,土豆条中的L-天冬酰胺转化为L-天冬氨酸的转化率逐渐增加,从而导致最终薯条中丙烯酰胺含量逐步降低。未经酶处理的土豆条中(对照组)丙烯酰胺含量为5.780 μg/g,将土豆条置于5 IU/mL和20 IU/mL的酶液中浸泡30 min后,丙烯酰胺含量分别降低31.96%和40.87%,置于30 IU/mL的酶液中浸泡30 min后,丙烯酰胺含量进一步降低,降幅达58.39%。随着重组酶添加浓度的升高,薯条中丙烯酰胺含量逐渐降低。
3 讨 论
本研究中将地衣芽孢杆菌L-天冬酰胺酶I型酶基因在大肠杆菌中表达,测定了重组酶酶学性质以及对油炸土豆中丙烯酰胺的抑制效果。将BlAase I型氨基酸序列与不同来源L-天冬酰胺酶I型进行同源性比对发现,BlAase I型与已知结构的其他I型酶差异较大,与之同源性最高的是激烈火球菌I型酶[25](P. furiosus,PDB ID:4NJE),同源性仅为30%;其次是大肠杆菌I型酶[26](PDB ID:2HIM),同源性为27%。
作为一种新型的L-天冬酰胺酶I型,BlAase I型具有出色的催化能力,重组酶活力可达(63.64±3.18)IU/mL,高于多种其他来源的L-天冬酰胺酶,如阿尔巴诺卡氏菌(Nocardiopsis alba,18.47 IU/mL)[27]和栖稻假单胞菌(Pseudomonas oryzihabitans,4.3 U/mL)[28]等。酶学性质研究结果表明,BlAase I型的最适反应pH值为10.0,相较于大多数L-天冬酰胺酶偏碱性[28]。在pH 6.0~9.0范围内储存12 h后,BlAase I型仍保留80%以上的活性。此外,大部分的L-天冬酰胺酶来源于嗜温微生物,其最适反应温度在30~45 ℃之间[21,29],BlAase I型的最适反应温度为45 ℃,同样符合这一特点。BlAase I型热稳定性较好,在45 ℃处理12 h后相对酶活力仍大于90%。这些特性使其可耐受食品加工过程中各种苛刻的pH值及稳定环境,在食品加工领域中具有广阔应用前景。另外,Mn2+对重组酶具有较强的激活作用,这与来源于米黑根毛霉的L-天冬酰胺酶情况相似[30]。在底物特异性方面,多数L-天冬酰胺酶通常无法催化D-天冬酰胺,对谷氨酰胺有部分活性,如荧光假单胞菌[31]和酿酒酵母[13]等来源的L-天冬酰胺酶。而BlAase I型对L-天冬酰胺的特异性强,无谷氨酰胺酶活性,具有较弱的D-天冬酰胺催化活性。
BlAase I型可有效抑制薯条中丙烯酰胺的产生,在30 IU/mL的酶液中处理0.5 h后,丙烯酰胺降解率最高可达58.39%。然而,经枯草芽孢杆菌L-天冬酰胺酶处理后,土豆中的丙烯酰胺质量浓度降解了90%~95%[32],经巨大芽孢杆菌L-天冬酰胺酶处理后,土豆中的丙烯酰胺降解率为92.4%[18],即与其他文献报道中的L-天冬酰胺酶II型相比,BlAase I型对油炸土豆中丙烯酰胺的降解效果仍有差距。究其原因,BlAase I型的Km值较高,底物的亲和力较差,在30 min内结合及水解土豆中L-天冬酰胺的效率较低。针对BlAase I型底物亲和力不强的问题,基于该酶现有的生物学特性,分析可能影响底物结合的关键氨基酸位点,利用定点突变和迭代饱和突变技术对其进行分子改造,获得底物亲和力显著提高的突变酶,从而提高该酶的工业应用潜力。
