2型糖尿病合并肥胖患者血清TLR4、IL-6水平变化及其意义
2019-11-28袁姿杨婷陈玲樊华英范庆涛鲁燕成兴波
袁姿,杨婷,陈玲,樊华英,范庆涛,鲁燕,成兴波
(苏州大学附属第一医院,江苏苏州215006)
随着生活水平的提高及生活方式的改变,肥胖的发生率不断增加[1]。肥胖者脂肪组织中免疫细胞浸润,产生炎症因子,促进局部或全身炎症反应,可干扰外周组织胰岛素信号转导,影响葡萄糖代谢[2]。近年来研究证实,T2DM、肥胖均是在先天遗传因素的基础上后天环境诱导而发生的慢性、低度的炎症性疾病[3]。Toll样受体4(TLR4)是在人体发现的第一个TLRs相关蛋白,在胰岛素靶组织如肝脏、脂肪组织、肌肉组织中都有表达[4],可识别外源性配体如革兰阴性菌细胞壁的脂多糖(LPS)[5],也可与内源性配体结合[6],调节IL-1β、IL-6等的分泌,激活炎症通路并干扰胰岛素信号的正常转导,从而参与T2DM的炎症、免疫反应过程[7]。IL-6由巨噬细胞、T细胞等分泌[8],目前对于IL-6在肥胖、胰岛素抵抗中的作用仍未达成共识[9~13]。本研究观察了T2DM合并肥胖患者血清TLR4、IL-6水平变化,并探讨其临床意义。
1 资料与方法
1.1 临床资料 选取苏州大学附属第一医院内分泌科收治的初诊T2DM患者90例,按BMI分为3组,每组30例。18.5≤BMI≤23.9为T2DM正常体质量组,男20例、女10例,年龄(45.20±9.45)岁,BMI 22.17±1.47;24.0≤BMI<28.0为T2DM超重组,男19例、女11例,年龄(41.80±10.40)岁,BMI 25.94±1.07;BMI≥28.0为T2DM肥胖组,男18例、女12例,年龄(42.60±11.43)岁,BMI 30.37±3.23。另选同期BMI正常的健康体检者30例为对照组,男12例、女18例,年龄(41.19±11.86)岁,BMI 21.66±1.18。排除1型糖尿病、高血压病、T2DM伴急慢性感染、严重心脑血管病变、肝肾功能不全和其他系统性疾病患者;排除妊娠、哺乳期或长期服用避孕药者;排除既往重大外伤、手术史及合并恶性肿瘤、风湿性疾病的患者。本研究符合人体试验委员会所制订的伦理学标准,受试者均签署知情同意书。各组性别、年龄资料具有可比性。
1.2 血清TLR4、IL-6检测方法 所有受试者留取血样,2 h内于3 000 r/min离心10 min,分离血清,储存于-20 ℃冰箱保存待检测。采用ELISA法检测血清TLR4、IL-6,按说明书操作。
1.3 糖尿病、肥胖相关指标检测方法 检测各组腰围(WC)。所有受试者隔夜空腹12 h,次晨静脉抽血测定生化指标。Olympus2700全自动生化仪测定空腹血糖(FPG)、LDL-C、TG、HDL-C,高压液相色谱法检测糖化血红蛋白(HbA1c),ELISA法检测FINS。按照公式计算胰岛素抵抗指数(HOMA-IR):FPG×FINS/22.5。
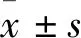
2 结果
2.1 各组血清TLR4、IL-6及糖尿病、肥胖相关指标比较 T2DM肥胖组血清TLR4、IL-6水平高于T2DM正常体质量组和T2DM超重组,均高于对照组(P均<0.05)。T2DM肥胖组血清TG、LDL-C、FINS、HOMA-IR高于T2DM正常体质量组和T2DM超重组,各T2DM组LDL-C、HOMA-IR、FINS高于对照组,HDL-C低于对照组(P均<0.05)。见表1。

表1 各组血清TLR4、IL-6及糖尿病、肥胖相关指标比较
注:与对照组相比,P<0.05;与T2DM肥胖组相比,#P<0.05。
2.2 血清TLR4、IL-6与糖尿病、肥胖相关指标的相关性 TLR4与BMI、WC、TG、LDL-C、FPG、FINS、HOMA-IR、HbA1c呈正相关(r分别为0.338、0.329、0.213、0.309、0.161、0.296、0.249、0.253,P均<0.05),与HDL-C呈负相关(r=-0.199,P<0.05);IL-6与BMI、WC、TG、LDL-C、FPG、FINS、HOMA-IR、HbA1c呈正相关(r分别为0.508、0.513、0.296、0.334、0.417、0.266、0.329、0.487,P均<0.05),与HDL-C呈负相关(r=-0.371,P<0.05)。血清TLR4、IL-6水平呈正相关(r=0.246,P<0.05)。分别以血清TLR4、IL-6为因变量,以BMI、WC、TG、LDL-C、HbA1c、FINS、FPG为因变量进行多元回归分析,结果显示FINS(β=0.104、S.E.=0.051、标准化B值=0.210、t=2.059、P=0.042)是TLR4升高的独立影响因素,BMI(β=4.956、S.E.=2.299、标准化B值=0.337、t=2.156、P=0.033)、HbA1c(β=7.211、S.E.=2.445、标准化B值=0.350、t=2.950、P=0.004)是IL-6升高的独立影响因素。
3 讨论
TLRs在炎症因子相关基因的转录调控过程中发挥重要作用[14]。Nyati等[15]研究发现,肥胖小鼠的脂肪组织中TLR4 mRNA表达显著上调,并且发现TLR4被FFA、LPS激活后可刺激NF-κB信号转导和炎症因子IL-6等在脂肪细胞中的表达。Dasu等[16]发现,新诊断的T2DM患者单核细胞中TLR4 mRNA表达高于对照组,TLR4的内源性配体HSP-60、HSP-70、高迁移率族蛋白B1(HMGB1)、内毒素、透明质酸水平均升高,并且与TLR4水平呈正相关。以上研究提示TLR4参与了机体的慢性炎症过程,参与了T2DM的发生发展。
本研究发现,T2DM肥胖组血清TLR4、TG、LDL-C、HOMA-IR水平均高于T2DM正常体质量组和T2DM超重组。Jia等[17]研究发现,小鼠肝细胞中TLR4激活导致肥胖相关炎症和胰岛素抵抗;TLR4敲除的小鼠,尽管在高脂肪饮食后出现肥胖,但表现出糖耐量改善、胰岛素敏感性增强和肝脂肪变性减轻。本研究相关性分析结果显示,血清TLR4与BMI、WC、TG、LDL-C、HOMA-IR、FPG、FINS、HbA1c呈正相关,与HDL-C呈负相关。这提示血清TLR4水平与肥胖及脂代谢异常有关,并且可能具有促进作用。多元回归分析结果显示,FINS是血清TLR4升高的独立影响因素。这提示T2DM状态下代偿性胰岛素升高可能会进一步激活TLR4的表达,加重胰岛素抵抗,其具体作用机制仍需进一步研究。我们前期肝细胞模型实验结果证明,在FFA及高浓度胰岛素刺激下,肝细胞中TLR4表达水平上调。考虑到脂肪组织的内分泌功能,推测FFA不仅仅是TLR4的内源性配体,同时对TLR4的表达有诱导作用。结合本研究结果,我们推测,随着BMI增高,脂肪组织的内分泌功能逐步强化,FFA、FINS水平也升高,在多重因素作用下,TLR4表达水平逐步增高,促进胰岛素抵抗的发生,从而导致T2DM的发生、发展。
TLR4主要通过激活MyD88依赖性通路诱发随后的炎症反应,然后顺序激活IκB激酶(Iκκ)和丝裂原活化蛋白激酶(MAPKs)、NF-κB等一系列信号,进而诱发下游炎症因子IL-6、TNF-α、IL-1等的释放。IL-6是肥胖相关代谢紊乱的关键介质,是引起T2DM及肥胖患者发生胰岛素抵抗的关键因素之一[9]。目前,关于IL-6在肥胖、胰岛素抵抗中的作用仍然存在异议。
本研究发现,T2DM肥胖组血清IL-6水平高于T2DM超重组和T2DM正常体质量组。相关性分析结果显示,IL-6水平与BMI、WC、TG、LDL-C、FPG、FINS、HOMA-IR、HbA1c均呈正相关,与HDL-C呈负相关;血清TLR4与IL-6水平呈正相关。多元回归分析显示,BMI是IL-6升高的独立影响因素。既往研究发现,炎症因子通过抑制胰岛素信号转导及影响胰岛素转导中的关键元件等多种机制促进胰岛素抵抗的发生[18]。这提示TLR4信号通路的激活促进了IL-6在内的一系列炎症因子的释放,通过促进胰岛素抵抗进一步导致T2DM发生、发展。本研究还发现HbA1c是IL-6的独立影响因素。研究发现,炎症因子可通过提高升血糖激素如糖皮质激素、生长激素、胰高血糖素的水平,导致体内血糖升高[19]。此外,炎症因子还通过降低葡萄糖转运蛋白4 mRNA的表达水平,使胰岛素刺激的葡萄糖转运功能降低,影响葡萄糖代谢[20]。上述研究结果均提示,高血糖和慢性炎症之间相互影响、相互促进。
结合本研究结果,我们认为,T2DM合并肥胖患者血清TLR4、IL-6水平升高,TLR4、IL-6水平变化与肥胖、高血糖、胰岛素抵抗存在相关性。同时,本研究存在一定的缺陷,如按BMI分组存在一定的局限性。BMI并不能反映体脂含量,尤其是内脏脂肪的含量。本研究中T2DM正常体质量组与T2DM超重组TLR4、TG、LDL-C水平差异无统计学意义考虑与此有关。此外,TLR4、IL-6与肥胖、T2DM之间关系的影响因素太多,单纯观察性研究只能了解其相关性,而这种相关性是否为因果关系,仍需进一步证实。
