EPB41L5 mRNA在食管癌组织、细胞中的表达及对食管癌细胞侵袭和转移的影响
2019-11-28陈霞石益海郭小燕胡丽娟朱婵艳
陈霞,石益海,郭小燕,胡丽娟,朱婵艳
(海军军医大学附属公利医院,上海200135)
食管癌早期症状隐匿,90%的患者确诊时已是晚期,晚期患者普遍预后差,生存率较低[1,2]。近年来靶向分子药物如曲妥珠单抗和ramucirumab等为食管癌的治疗带来了新的希望,但这些药物仅适用于少部分患者[3]。因此,寻找新的药物靶点、开发新的靶向药物意义重大。红细胞膜蛋白带4.1类似物5(EPB41L5)参与果蝇、斑马鱼和小鼠胚胎的发育[4]。新近研究报道,EPB41L5参与舌鳞状细胞癌、结直肠癌和胃癌等肿瘤的发生发展[5~7]。EPB41L5在食管癌中的表达变化及其生物学功能尚不清楚。2016年1月~2018年1月,本研究观察了EPB41L5 mRNA在食管癌组织和细胞中的表达变化,及沉默EPB41L5 mRNA表达对食管癌细胞侵袭、转移能力的影响,并探讨相关作用机制。
1 材料与方法
1.1 食管癌组织、细胞及主要实验材料 收集2016年1月~2018年1月手术切除的食管癌组织及其相应癌旁组织50例,组织来源患者术前未接受化疗、放疗和靶向治疗等任何形式的治疗。所有操作均符合医院伦理委员会制定的相关规定,且本研究获得医院伦理委员会批准,患者均知情同意。食管癌细胞Eca109、EC9706、TE1和正常人食管鳞状上皮细胞Het-1A均购自美国ATCC细胞库。RPMI-1640、DMEM-F12培养基及FBS均购自美国Gibco公司。TRIzol、PrimeScriptTMRT reagent Kit反转录试剂盒、SYBR Premix Ex TaqTMqRT-PCR试剂盒均购自日本TaKaRa公司。EPB41L5、GAPDH引物均由上海捷瑞生物有限公司设计合成。EPB41L5 siRNA购自广州市锐博生物科技有限公司。6孔板和Transwell小室购自美国Corning公司。Boyden基质胶购自美国BD公司。RIPA裂解液购自美国Solarbio公司。BCA检测蛋白浓度试剂盒购自美国Thermo公司。兔多克隆抗体E-cadherin、N-cadherin、Vimentin均购自英国Abcam公司。
1.2 食管癌组织和细胞系中EPB41L5 mRNA检测 采用qRT-PCR检测食管癌组织和细胞系中的EPB41L5 mRNA。采用TRIzol试剂盒提取组织和细胞中的总RNA。按照反转录试剂盒说明书将总RNA反转录为cDNA,将其作为模板,按qRT-PCR试剂盒说明进行PCR反应。反应条件为95 ℃预变性5 s,95 ℃变性5 s,60 ℃退火30 s,共40个循环。以GAPDH为内参。EPB41L5上游引物序列为5′-GTTTCTTCCGTAGAACACTAGGG-3′,下游引物序列为5′-CAGAAGGGACACCCGACAC-3′。GAPDH基因上游引物序列为5′-ACAACTTTGGTATCGTGGAAGG-3′,下游引物序列为5′-GCCATCACGCCACAGTTTC-3′。以2- ΔΔCt表示EPB41L5 mRNA的相对表达量。
1.3 食管癌细胞分组及EPB41L5基因沉默 将Eca109、TE1、Het-1细胞接种于含10% FBS的RPMI-1640培养基中,EC9706细胞接种于含10% FBS的DMEM-F12培养基中,于37 ℃、5% CO2培养箱中培养。根据qRT-PCR结果选取EPB41L5 mRNA表达水平最高的食管癌细胞进行转染操作。取生长期的细胞胰酶消化后以2×105/孔接种于6孔板中,分为si-NC组和si-EPB41L5组。细胞贴壁后按照说明书将si-NC(序列为5′-UUCUCCGAACGUGUCACGUTT-3′)和si-EPB41L5(序列为5′-GAGAUGGAACUGGCUAUUUUU-3′)转染至细胞中。转染48 h后采用qRT-PCR法验证si-EPB41L5沉默效果,si-EPB41L5组的EPB41L5 mRNA表达水平低于si-NC组(P<0.05)则可进行后续实验。
1.4 细胞侵袭能力检测 采用Boyden实验检测细胞侵袭能力。收集转染48 h后的si-NC组和si-EPB41L5组细胞,无血清培养基洗3次后,将细胞浓度调整为1×106/mL。在小室内铺BD基质胶,将100 μL细胞悬液接种于小室基质胶上,细胞通过基质胶穿过聚碳酸酯膜小孔。将500 μL完全培养基加入下室作为趋化因子,放置细胞培养箱中培养12 h,PBS将膜的上室细胞洗掉,甲醇固定15 min,结晶紫染色20 min。倒置显微镜下观察拍照,并随机计数5个视野的穿膜细胞数,表示细胞侵袭能力。
1.5 细胞迁移能力检测 采用Transwell小室实验检测细胞侵袭能力。收集转染48 h后的si-NC组和si-EPB41L5组细胞,无血清培养基洗3次后,将细胞浓度调整为1×106/mL。将100 μL细胞悬液接种于小室聚碳酸酯膜上,细胞直接穿过聚碳酸酯膜小孔。将500 μL完全培养基加入下室作为趋化因子,放置细胞培养箱中培养12 h,PBS将膜的上室细胞洗掉,甲醇固定15 min,结晶紫染色20 min。倒置显微镜下观察拍照,并随机计数5个视野的穿膜细胞数,表示细胞迁移能力。
1.6 细胞上皮-间质转化(EMT)相关蛋白检测 采用Western blotting法检测E-cadherin、N-cadherin和Vimentin。收集转染48 h后的si-NC组和si-EPB41L5组细胞,加入含有蛋白酶和磷酸酶抑制剂的RIPA裂解液,匀浆机冰上裂解10 min。4 ℃、13 000 r/min离心30 min弃掉细胞碎片。BCA试剂盒检测蛋白浓度。煮沸后SDS-PAGE电泳分离蛋白,湿性转膜,8%牛奶室温封闭3 h。分别加入E-cadherin、N-cadherin、Vimentin一抗稀释液4 ℃孵育过夜,TBST洗3次、每次5 min,加入二抗室温孵育2 h,ECL化学发光法显示条带。Image J软件分析蛋白灰度值,以目的蛋白灰度值与GAPDH蛋白灰度值的比值表示目的蛋白相对表达量。

2 结果
2.1 食管癌组织和细胞中EPB41L5 mRNA表达变化 食管癌组织、癌旁组织中EPB41L5 mRNA的相对表达量分别为1.67±0.85、1.03±0.53,食管癌组织中EPB41L5 mRNA的相对表达量高于癌旁组织(P<0.05)。食管癌细胞Eca109、EC9706、TE4及正常人食管鳞状上皮细胞Het-1A中EPB41L5 mRNA的相对表达量分别为8.68±0.80、5.95±0.23、3.70±0.49、1.00±0.02。Eca109、EC9706、TE4细胞中EPB41L5 mRNA的相对表达量高于Het-1A细胞(P均<0.05)。选取EPB41L5 mRNA表达水平最高的Eca109细胞用于后续实验。
2.2 si-NC组、si-EPB41L5组细胞侵袭能力比较 Boyden实验结果显示,si-NC组、si-EPB41L5组穿膜细胞数分别为(63.02±14.36)、(18.37±5.08)个,si-EPB41L5组细胞侵袭能力低于si-NC组(P<0.05)。见图1。

图1 si-NC组、si-EPB41L5组Boyden实验细胞穿膜情况
2.3 si-NC组、si-EPB41L5组细胞迁移能力比较 Transwell小室实验结果显示,si-NC组、si-EPB41L5组细胞穿膜数分别为(75.54±10.28)、(33.21±7.68)个,si-EPB41L5组细胞迁移能力低于si-NC组(P<0.05)。见图2。
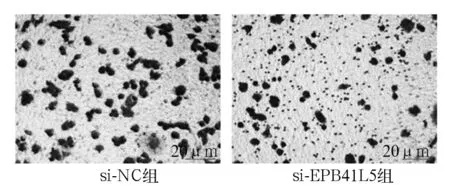
图2 si-NC组、si-EPB41L5组Transwell小室实验细胞穿膜情况
2.4 si-NC组、si-EPB41L5组细胞中EMT相关蛋白表达比较 si-EPB41L5组细胞中上皮细胞标志物E-cadherin蛋白相对表达量高于si-NC组,间质细胞标志物N-cadherin、Vimentin蛋白相对表达量低于si-NC组(P均<0.05)。见表1。

表1 si-NC组、si-EPB41L5组细胞中EMT相关蛋白相对表达量比较
注:与si-NC组相比,*P<0.05。
3 讨论
食管癌发病原因尚不完全清楚,据报道饮食习惯、环境因素、压力和基因突变等均可能导致食管癌的发生[8]。虽然目前食管癌的治疗取得了一定进展,但是由于食管癌具有高转移风险,尤其是区域淋巴结转移,患者术后容易复发和化疗耐药,导致患者长期生存率较低[1,2]。研究食管癌转移的分子机制可能为发掘治疗靶点提供新的方向。
EPB41L家族的N末端有保守的FERM结构域蛋白,其C末端有肌动蛋白结合结构域[9],与细胞运动相关,家族中的NB41L具有独特的非同源C末端并且缺乏肌动蛋白结合结构域。EPB41L5属于NB41L家族,是足细胞特异性组分,EPB41L5的遗传缺失可导致严重的蛋白尿、足细胞分离和局灶性节段性肾小球硬化[10,11]。此外,EPB41L5参与机体的发育,与Crumbs复合物相互作用,参与调节上皮细胞的极性[12]。同时,EPB41L5直接控制肌动蛋白的收缩性和黏着斑,调控细胞的扩散和迁移[13]。EPB41L5的异常表达在恶性肿瘤中的作用也逐渐被证实。Otsuka等[5]报道EPB41L5表达水平与舌鳞状细胞癌(TSCC)患者的无病生存率和总体存活率相关,过表达EPB41L5的细胞侵袭能力增强。EPB41L5在结直肠癌组织中高表达,并与肿瘤类型、Dukes分期、转移及预后等临床病理参数有关,可促进结直肠癌细胞的增殖、侵袭和迁移[6]。Jeong等[7]报道EPB41L5在胃癌中高表达,且与患者预后不良有关。在体外,EPB41L5通过Smad依赖性转化生长因子β信号转导通路促进胃癌细胞迁移和侵袭;在体内,EPB41L5过表达可促进裸鼠胃癌细胞肺转移,抗EPB41L5单克隆抗体治疗可阻断EPB41L5与转移相关蛋白p120-catenin(p120)结合,并可完全逆转体内肺转移,提示EPB41L5是胃癌潜在的治疗靶点。
本研究首先观察了EPB41L5 mRNA在食管癌组织和细胞中的表达变化,发现与癌旁组织相比,食管癌组织中EPB41L5 mRNA表达上调,与舌癌、结直肠癌、胃癌相关研究结果一致[5~7];qRT-PCR检测结果显示,食管癌细胞Eca109、EC9706、TE4中EPB41L5 mRNA的表达显著高于正常人食管鳞状上皮细胞Het-1A,与食管癌组织中EPB41L5的表达变化趋势一致,这提示EPB41L5可能是一种癌基因,与食管癌的发病有关。沉默EPB41L5 mRNA表达后,食管癌细胞的侵袭能力、迁移能力减弱,提示EPB41L5对食管癌细胞的侵袭和迁移有一定影响。
EPB41L5是一种间充质特异性蛋白,通常在EMT过程中被诱导。EPB41L5与p120结合,以隔离p120与E-cadherin的结合,从而导致E-cadherin内化;同时EPB41L5与黏着斑蛋白结合,促进黏着斑动力学,增强细胞的运动能力[14]。研究显示,在乳腺癌细胞中,ZEB1诱导EPB41L5的表达,驱动ARF6基因,促进细胞侵袭转移,ZEB1-EPB41L5轴是肿瘤EMT的核心[15]。EMT是细胞上皮表型转化为间质表型的过程,细胞极性和细胞间紧密连接遭到破坏,细胞运动增强,细胞迁移、侵袭能力增强,E-cadherin表达下调,N-cadherin和Vimentin等蛋白表达上调[16,17]。本研究观察了抑制EPB41L5表达后食管癌细胞EMT相关蛋白表达变化,结果显示,si-EPB41L5组E-cadherin蛋白相对表达量高于si-NC组,N-cadherin、Vimentin蛋白相对表达量低于si-NC组,提示EPB41L5对食管癌细胞侵袭、迁移能力的影响机制与调控EMT过程有关。
综上所述,EPB41L5 mRNA在食管癌组织和细胞系中均高表达。沉默EPB41L5 mRNA表达可抑制食管癌细胞的侵袭、迁移能力,作用机制可能与抑制EMT有关。在后续的研究中,我们将对EPB41L5的表达与患者临床病理参数的关系进行分层分析,同时分析EPB41L5表达与患者预后的关系。
