ox-LDL诱导后SHP-2缺陷骨髓巨噬细胞脂肪沉积、吞噬功能及脂肪代谢基因表达观察
2019-11-28梁雪雷马倩李新新谭鹤张雪帖彦清
梁雪雷,马倩,李新新,谭鹤,张雪,帖彦清
(1河北北方学院,河北张家口075000;2河北省人民医院)
动脉粥样硬化(AS)相关的冠心病和脑卒中发病率较高,绝大部分患者是由高脂血症诱发的AS。氧化型低密度脂蛋白(ox-LDL)是高脂状态下衍生的导致AS的主要和特异性诱导物[1]。巨噬细胞是参与AS的关键细胞,可被动员、激活和趋化到AS部位,以清除动脉上异常沉积的脂质。然而,斑块内巨噬细胞可通过吞噬ox-LDL形成泡沫细胞,进而引起一系列的炎症、氧化应激反应,加速AS进展[2]。巨噬细胞源性泡沫细胞是AS特有的、最多的细胞类型[3]。蛋白酪氨酸磷酸酶SHP-2是维持众多类型细胞功能的关键基因[4]。关于SHP-2是否参与泡沫细胞形成,目前相关研究很少。2016年11月~2019年3月,本课题组繁育了骨髓巨噬细胞(BMDM)特异性SHP-2基因缺陷背景基因稳定型小鼠(SHP-2 MφCKO小鼠),观察了ox-LDL诱导后SHP-2 MφCKO小鼠BMDM脂肪沉积、吞噬功能及脂肪代谢相关基因表达的变化,探讨SHP-2影响巨噬细胞脂代谢的机制。
1 材料与方法
1.1 动物及主要实验材料 动物:SHP-2flox/flox小鼠购自美国Jackson实验室,雌雄各8只,鼠龄4~6周;Lyz-2-Cre小鼠(利用Lyz-2启动子构建的转基因小鼠,能使83%~98%的成熟巨噬细胞发生基因重组)由路永刚博士赠与,雌雄各20只,鼠龄4~6周。主要实验材料:胎牛血清(FBS,以色列BI公司)、Dil-ox-LDL(广州奕源生物科技有限公司)、RPMI-1640培养基(美国Gibco公司)、单分散荧光微球(聚苯乙烯微球,Polysciences公司)、Gluta固定液(电镜专用,4%,北京索莱宝科技有限公司)、快速DNA提取检测试剂盒(KG203,北京天根生化科技有限公司)。
1.2 SHP-2 MφCKO小鼠的繁育与鉴定
1.2.1 SHP-2 MφCKO小鼠的繁育 将SHP-2flox/flox雌鼠与雄鼠一起合笼,顺利繁育出F1代子鼠。用Lyz-2-Cre小鼠与F1代SHP-2flox/flox小鼠合笼,对得到的F2代小鼠进行基因型鉴定,筛选基因型为Cre×SHP-2flox/+的杂合子小鼠。将基因型为Cre×SHP-2flox/+的杂合子雌雄鼠合笼继续繁殖,得到F3代小鼠,经鉴定筛选得到基因型为Cre×SHP-2flox/flox的小鼠即为实验需要的纯合子小鼠(SHP-2 MφCKO小鼠)[5,6]。
1.2.2 SHP-2 MφCKO小鼠的鉴定 取4~6周龄SHP-2 MφCKO小鼠,剪3 mm左右尾巴尖部,提取DNA,进行PCR扩增。SHP-2的loxp位点上游引物序列为5′-ATGACTCCTGAAGCCCATTG-3′,下游引物序列为5′-CTTCCCATCACCTCAGACTCC-3′;Lyz-2-Cre基因突变型引物序列为5′-CCCAGAAATGCCAGATTACG-3′,野生型为5′-TTACAGTCGGCCAGGCTGAC-3′,共有引物为5′-CTTGGGCTGCCAGAATTTCTC-3′。PCR反应体系包括DreamTaq Green PCR Master Mix(2×) 12.5 μL、上游引物和下游引物各1 μL、DNA模板0.5 μL、去核酶水10 μL。反应条件:初始变性95 ℃ 5 min,变性95 ℃ 30 s,退火65 ℃ 30 s,延伸72 ℃ 18 s(SHP-2flox/flox)或42 s(Lys-2-Cre-/+),重复30个循环;延伸72 ℃ 60 s。PCR产物于4 ℃保存,后进行琼脂糖凝胶电泳。电泳图700 bp处有条带为Cre+小鼠,350 bp处有条带为Cre-小鼠;仅320 bp处有条带为SHP-2flox纯合子小鼠(SHP-2flox/flox)即SHP-2 MφCKO小鼠,只有221 bp处有条带为野生型小鼠(SHP-2+/+),320 bp、221 bp处均有条带为杂合子小鼠(SHP-2flox/+)。
1.3 动物分组、BMDM获取及ox-LDL刺激方法 选取8~10周龄的雄性SHP-2 MφCKO小鼠(实验组)和野生型小鼠(基因型SHP-2+/+,对照组)进行实验。将小鼠引颈处死,浸泡在75%乙醇中消毒5 min,在超净台中暴露并分离小鼠股骨及胫骨,置于冰的PBS培养皿中。剥离肌肉组织,切除关节面,暴露骨髓腔,用注射器吸取RPMI-1640培养基冲洗骨髓腔,收集冲洗出来的细胞培养基悬液,1 000 r/min离心5 min。丢弃上清液,换含10% FBS、1%双抗、50 ng/mL M-CSF的RPMI-1640培养基重悬,计数后铺至T25培养瓶中,5% CO2、37 ℃条件下培养。将贴壁5 d后的BMDM用0.25%胰酶消化,加入含2% FBS的完全培养基制成细胞悬液备用。在新的6孔板各孔中央滴加300 μL的含2% FBS的完全培养基,用镊子夹取无菌爬片,轻放于培养基上并按压爬片使其不易浮起,在爬片上滴加500 μL的细胞悬液,置于5% CO2细胞培养箱孵育2 h,使细胞贴壁。每孔补加1 200 μL的含2% FBS完全培养基继续孵育。8 h后每孔加0.25 μL的ox-LDL(终浓度为50 ng/mL)[7]。
1.4 BMDM脂滴沉积观察 两组BMDM用50 ng/mL的ox-LDL刺激48 h后,使用电镜灌流固定液固定细胞,透射电镜下观察BMDM脂滴沉积情况。将BMDM与100 mg/L的Dil-ox-LDL(红色荧光)共同孵育48 h后,用荧光显微镜照相,观察泡沫细胞形成情况。
1.5 BMDM吞噬功能检测 以ox-LDL刺激两组BMDM的同时加入单分散绿色荧光聚苯乙烯微球1 μL(终浓度为0.5 μL/mL),继续孵育24 h后将爬片封片。使用激光共聚焦显微镜在488 nm处观察BMDM对单分散荧光微球的吞噬情况,使用活细胞工作站检测荧光强度,表示BMDM的吞噬功能。
1.6 BMDM中脂肪代谢相关基因检测 ox-LDL刺激24 h后提取两组细胞总RNA,按照逆转录试剂盒说明书将RNA逆转录为cDNA,进行实时荧光定量PCR反应。PCR反应体系20 μL,包括TB GreenPremix Ex TaqⅡ (Tli RNaseH Plus,2×)10 μL,上游引物和下游引物各0.8 μL,DNA模板2 μL,去核酶水6.4 μL。CD36上游引物序列为5′-TCATGCCAGTCGGAGACATGCTTA-3′,下游引物序列为5′-ACCTGTCTGTACACAGTGGTGCCT-3′。Toll样受体(TLR)4上游引物序列为5′-TGAACGAGAGGATGCTGACTG-3′,下游引物序列为5′-GGAGGGGCCATTTTTAGTGC-3′。甾醇调节因子结合蛋白(SREBP)-1c上游引物序列为5′-GGAGCCATGGATTGCACATT-3′,下游引物序列为5′-ACGGACGGGTACATCTTTAC-3′。SREBP-2上游引物序列为5′-CACAATATCATTGAAAAGCGCTACC-3′,下游引物序列为5′-TTTTTCTGATTGGCCAGCTTCAGCA-3′。三磷酸腺苷结合盒转运体A1(ABCA1)上游引物序列为5′-GGTTTGGAGATGGTTATACAATAGTTGT-3′,下游引物序列为5′-TTCCCGGAAACGCAAGTC-3′。三磷酸腺苷结合盒转运体G1(ABCG1)上游引物序列为5′-AGGTCTCAGCCTTCTAAAGTTCCTC-3′,下游引物序列为5′-TCTCTCGAAGTGAATGAAATTTATCG-3′。内参β-actin上游引物序列为5′-GCAGGAGTACGATGAGTCCG-3′,下游引物序列为5′-ACGCAGCTCAGTAACAGTCC-3′。以2-ΔΔCt表示目的基因相对表达量。

2 结果
2.1 SHP-2 MφCKO小鼠的繁育及鉴定结果 繁育出Cre-小鼠36只,SHP-2 MφCKO小鼠53只,SHP-2+/+小鼠61只,SHP-2flox/+小鼠69只。不同小鼠基因型PCR鉴定情况见图1。
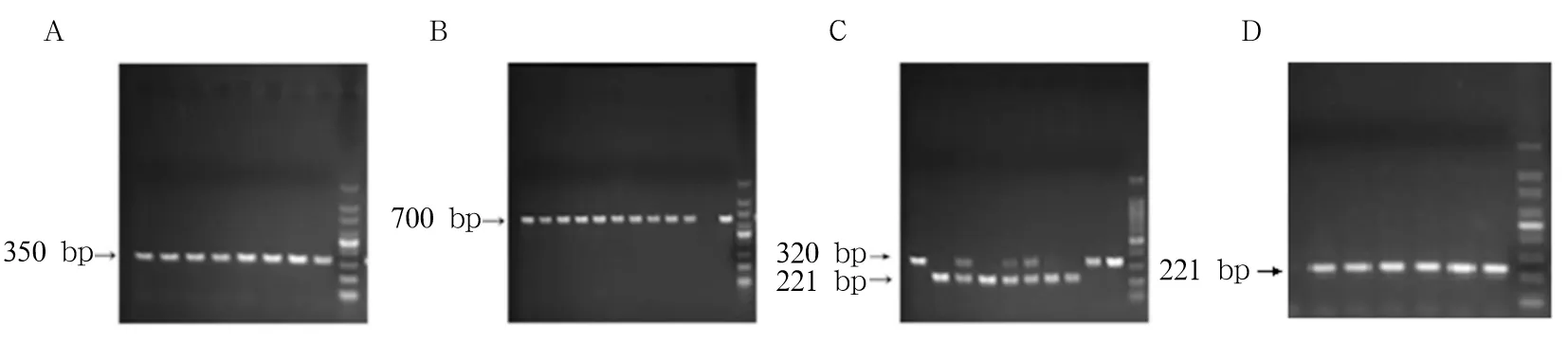
注:A为Cre-小鼠;B为SHP-2 Cre+小鼠;C为SHP-2flox/+小鼠;D为SHP-2+/+小鼠。
图1 小鼠基因型PCR鉴定情况
2.2 两组小鼠BMDM中脂肪沉积情况比较 实验组小鼠BMDM中脂滴成分量多、体积大,基本充满细胞质,对照组BMDM中脂滴量少,体积小而且零散分散于细胞质中,见图2。荧光显微镜观察发现,实验组细胞质内出现大量的红色荧光颗粒(脂滴),提示已经形成泡沫细胞,见图3。实验组、对照组BMDM中红色荧光含量分别为1.93±0.27、0.83±0.03,两组相比,P<0.05。
2.3 两组BMDM吞噬功能比较 激光共聚焦显微镜下观察发现,实验组BMDM细胞内荧光微球的数量显著增加(图4)。实验组、对照组BMDM内绿色荧光强度分别为1 297±17.14、454.5±24.75,两组相比,P<0.05。
2.4 两组BMDM中脂肪代谢相关基因表达比较

注:a为1 000×;b为3 000×。
图2透射电镜下两组BMDM中脂滴沉积情况

注:a为明场视野;b为荧光视野。
图3 荧光显微镜下两组细胞质内红色荧光颗粒情况
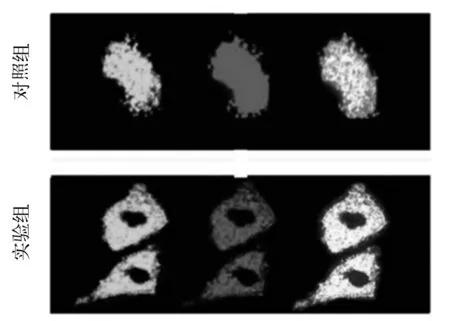
图4 激光共聚焦显微镜下两组BMDM内荧光微球数量
实验组BMDM中CD36、TLR-4、SREBP-1c和SREBP-2 mRNA相对表达量高于对照组(P均<0.05)。详见表1。

表1 实验组、对照组BMDM中脂肪代谢相关基因表达比较
注:与对照组相比,*P<0.05,**P<0.01。
3 讨论
ox-LDL是高脂状态下衍生的诱发AS的主要物质[1]。在AS进程中,循环中的单核-巨噬细胞首先被动员、激活和趋化到病变部位以清除动脉上异常沉积的脂质。巨噬细胞表达多种清道夫受体(SR),主要负责吞噬修饰后的脂质如ox-LDL和乙酰化低密度脂蛋白,这是识别、吞噬脂蛋白及其携带的胆固醇成分的第一步,也是促进泡沫细胞形成的关键环节。进入巨噬细胞的多余脂质和胆固醇成分激活SREBP[8]后,使巨噬细胞内脂质堆积在胞质内形成巨噬细胞性泡沫细胞。多余的脂质聚集后激活胆固醇外排蛋白ABCA1、ABCG1,促进细胞内游离胆固醇酯和磷脂排出,结合细胞表面的载脂蛋白(Apo)A-I,最后通过HDL-C转运至肝脏进行代谢[9]。
酪氨酸磷酸酶和激酶之间的平衡是维持细胞正常功能的支柱系统[10],该系统失衡会导致炎症反应过度、代谢失衡、免疫异常直至肿瘤等疾病[11]。最近研究显示,巨噬细胞内酪氨酸激酶(SYK)升高可明显促进膜表面CD36内化和CD36/TLR-4/TLR-6异源三聚体形成。SHP-2与SYK、布鲁顿酪氨酸激酶(BTK)等的作用相互制约、拮抗且互为底物。围绕SHP-2是否参与泡沫细胞形成这一课题,我们经过4年努力成功构建了SHP-2 MφCKO小鼠,而且由于SHP-2flox/flox和Lyz-M Cre小鼠背景不同,我们通过纯化9代使所有子代小鼠基因型稳定,而后用ox-LDL刺激小鼠BMDM以便于研究SHP-2在巨噬细胞源性泡沫细胞中的作用。ox-LDL是促进AS的关键因子,由于受体识别位点构型改变,所以只能被巨噬细胞表面的SR和TLR家族识别,不能被肝脏细胞的LDL受体识别。ox-LDL携带大量胆固醇,在细胞内经过一系列代谢后形成大量胆固醇酯以脂滴形式储存在胞内,进而形成泡沫细胞[12]。我们将BMDM饥饿处理8 h后给予50 ng/mL的ox-LDL和荧光微球共刺激24 h,分别检测了BMDM吞噬荧光微球的荧光强度和数量,结果显示,实验组细胞质内脂滴和吞噬荧光微球的数量多于对照组,提示SHP-2基因缺陷明显促进巨噬细胞源性泡沫细胞形成,巨噬细胞的吞噬功能进一步提高[13]。
CD36是巨噬细胞表面的重要SR-A家族受体,也是单核-巨噬细胞吞噬ox-LDL的主要受体[14]。CD36可以无限制地吞噬或摄取修饰后的LDL,而且不受负反馈抑制,造成细胞内胆固醇酯聚集最终形成泡沫细胞[15]。TLR-4也是ox-LDL受体,而且它与CD36关系密切,参与了CD36-TLR-4/TLR-6异源三聚体形成和内化ox-LDL[16]。因此,我们同时检测了两组BMDM中的CD36、TLR-4 mRNA,结果显示,经50 ng/mL的ox-LDL刺激后,实验组CD36、TLR-4 mRNA相对表达量高于对照组,提示BMDM吞噬能力明显增强。SREBP家族是核转录因子,它能与脂质合酶基因的启动子或增强子的固醇调节元件结合,激活靶基因转录,特异性调控胆固醇摄入及合成代谢[17]。目前,已知SREBP-1主要调节脂肪酸合成酶或硬脂酰辅酶A脱氢酶等下游基因转录合成,调控脂肪酸合成。SREBP-2通过调节β-羟基-β-甲戊二酸单酰辅酶A脱氢酶合酶及还原酶和低密度脂蛋白受体等的合成,从而调控胆固醇代谢。SREBP-1c和SREBP-2基因表达异常可导致二者调节平衡失调,可导致胞内脂质、胆固醇大量沉积,促进泡沫细胞的形成。本研究结果显示,SHP-2基因缺陷后SREBP过表达,提示胆固醇在胞内“消化”和“储存”增强。巨噬细胞主要通过ABCA1和ABCG1将细胞内胆固醇排出至HDL后到达肝脏代谢[18,19],但本研究发现两组ABCA1、ABCG1 mRNA相对表达量差异无统计学意义,SHP-2基因缺陷并未影响ABCA1、ABCG1 mRNA的表达,提示SHP-2基因缺陷加速泡沫细胞形成可能与增强ox-LDL内化进入巨噬细胞、增强胆固醇或脂质的转运有关[20]。
总之,本研究证实,SHP-2基因缺陷小鼠BMDM脂肪沉积加剧,细胞吞噬功能增强,脂肪代谢相关基因表达上调。SHP-2基因缺陷的BMDM可能通过促进吞噬ox-LDL并使其转化为胆固醇酯等储存于细胞内,从而促进泡沫细胞形成。检测AS患者单核-巨噬细胞内的SHP-2蛋白可能有助于评估AS的进展。
