KLF15基因在乳腺癌组织中表达变化及对乳腺癌细胞MCF-7增殖能力的影响
2019-11-28高温杰王振国刘显胜任贵兵
高温杰,王振国,刘显胜,任贵兵
(1武警后勤学院,天津300300;2武警特色医学中心)
乳腺癌发病率居女性恶性肿瘤首位[1]。乳腺癌增殖的相关分子机制是相关研究热点之一。Kruppel样因子(KLF)是一个转录因子家族,其羧基末端区域包含三个不同的C2H2型锌指结构域,在DNA结合和核定位中发挥关键作用[2,3]。KLF15是KLF家族的一员,从人肾脏cDNA文库中获得[4]。KLF15在人体多个组织中表达,包括肾脏、肝脏、心脏、脂肪和骨骼肌等[5]。KLF15的N端富含丝氨酸和脯氨酸,可起到转录激活功能[6]。目前研究表明,一些KLF家族成员在人类恶性肿瘤如乳腺癌、结肠癌、胃癌、胰腺癌和肝癌中起着关键作用[7]。体外研究表明,KLF15可能对胰腺癌细胞、子宫内膜癌细胞产生抗增殖作用[8];KLF15过表达后可抑制人宫颈癌细胞HeLa和人肝癌细胞Smmc7721的细胞活力和增殖能力,阻滞细胞周期于G0/G1期,且细胞周期调控因子p21的表达与KLF15的表达呈正相关[9]。2018年10月~2019年6月,本研究观察了KLF15在乳腺癌组织中的表达变化及对乳腺癌细胞MCF-7增殖能力的影响,并探讨相关机制。现报告如下。
1 材料与方法
1.1 实验细胞与材料 人乳腺癌细胞MCF-7由天津市肿瘤医院赠送。pcDNA3.1-KLF15质粒和pcDNA-3.1空载质粒均购自上海生工生物工程公司。胎牛血清和RPMI-1640培养基购于Gibco公司。Lipofectamine3000购于北京赛默飞公司。Giemsa染色液购于北京索莱宝公司。PCR引物购自上海生工生物工程公司。逆转录试剂盒及实时荧光定量PCR试剂盒购自江苏康为世纪生物科技有限公司。羊抗人KLF15抗体购自Abcam公司。兔抗人p21和兔抗人p27抗体及羊抗兔二抗购自沈阳万类生物科技有限公司。MTT购自Promega公司。细胞周期、细胞凋亡检测试剂盒购自杭州碧云天公司。
1.2 乳腺癌组织中KLF15 mRNA表达分析 分别利用生物信息学工具Cancer RNA-seq Nexus(CRN,http://syslab4.nchu.edu.tw/)和UALCAN(http://ualcan.path.uab.edu/index.html)分析TCGA数据库中乳腺癌样本的RNA序列数据(1 065例乳腺癌组织、114例正常乳腺组织),对比分析乳腺癌组织与正常乳腺组织中KLF15 mRNA的表达水平。
1.3 细胞分组及KLF15过表达质粒转染 用含10%胎牛血清的RPMI-1640培养基培养MCF-7细胞株,在5% CO2、37 ℃孵箱中培养2 d至对数期,接种至6孔板,每孔4.5×105个细胞。细胞再次贴壁至75%左右时,将细胞分为过表达组、空载组、空白组。过表达组转染pcDNA3.1-KLF15过表达质粒,空载组转染pcDNA3.1空载质粒,空白组不转染质粒。操作方法:将P3000TMReagent 5 μL与待转质粒2.5 μg及无血清不含双抗培养基125 μL混匀(A液),Lipofectamine3000 3.75 μL与无血清不含双抗培养基125 μL混匀(B液),A液与B液混匀后在超净台中孵育15 min。再次混匀脂质体复合物后取250 μL加入细胞培养板,37 ℃培养8 h后,更换完全培养基后继续培养36 h。采用Western blotting法检测各组细胞中的KLF15蛋白,过表达组、空载组、空白组KLF15蛋白相对表达量分别为2.37±0.36、1.30±0.32、1.29±0.24,过表达组KLF15蛋白相对表达量高于空载组和空白组(P均<0.05),表明pcDNA3.1-KLF15过表达质粒转染成功。
1.4 细胞增殖能力观察 采用MTT比色法。取过表达组和空载组细胞,制成单个细胞悬液后细胞计数,将细胞接种于96孔板,1×104/孔。分别培养6、12、24、48 h后加入MTT试剂20 μL/孔,继续培养4 h后弃掉培养基并加入DMSO 200 μL,低速振荡10 min,酶标仪检测490 nm波长的吸光度值代表细胞增殖能力,重复3次。
1.5 克隆形成率测算 取过表达组和空载组细胞,接种于6孔板,2×102/孔,培养箱中培养至肉眼可见细胞集落后,PBS洗涤3次,4%多聚甲醛固定0.5 h后,加入配制好的Giemsa染色液500 μL染色30 min,流水洗去染色液。显微镜下计数细胞克隆数(大于50个细胞计为1个克隆),计算克隆形成率。克隆形成率=(克隆数/接种细胞数)×100%。
1.6 细胞周期检测 胰酶分别消化过表达组和空载组细胞,收集至离心管后离心,用4 ℃预冷的PBS洗涤1次后加入4 ℃预冷的70%乙醇1 mL固定,4 ℃过夜,再次离心后用4 ℃预冷的PBS洗1遍。配制PI染色液,取0.5 mL染色液加入细胞,缓慢重悬,37 ℃水浴锅中避光温水浴45 min后上机检测。
1.7 p21、p27基因及蛋白检测 采用qRT-PCR法检测p21、p27基因。p21基因上游引物序列为5′-AAGACCATGTGGACCTGTCA-3′、下游引物序列为5′-CGTTTGGAGTGGTAGAAATCTG-3′,p27基因上游引物序列为5′-AAGGAAGCGACCTGCAAC-3′、下游引物序列为5′-CTCCACAGAACCGGCAT-3′,内参β-actin上游引物序列为5′-CTGGGACGACATGGAGAAAA-3′、下游引物序列为5′-AAGGAAGGCTGGAAGAGTGC-3′。提取过表达组和空载组细胞总RNA,逆转录获得cDNA进行PCR反应。反应条件为95 ℃预变性10 min后继续变性10 s,61 ℃退火30 s,62 ℃延伸32 s,循环40次。以2-ΔΔCt表示目的基因相对表达量。采用Western blotting法检测p21、p27蛋白。RIPA裂解过表达组和空载组细胞后提取总蛋白,G250法测定浓度并定量。以80 V恒压电泳60 min后再以120 V恒压电泳至结束。于4 ℃层析冷柜中90 V恒压下转膜60 min,PVDF膜于3%脱脂奶粉中封闭3 h。TBST漂洗3次,10 min/次。4 ℃条件下加一抗(β-actin 1∶1 000、KLF15 1∶1 000、p21 1∶1 000、p27 1∶500)孵育过夜。TBST漂洗3次,10 min/次。室温下加二抗(羊抗兔1∶10 000)孵育2.5 h,TBST漂洗后显影。用Image Lab软件分析条带灰度值,以目的蛋白与内参β-actin蛋白灰度值的比值表示目的蛋白相对表达量。

2 结果
2.1 乳腺癌组织中KLF15 mRNA表达变化 CRN分析结果显示,不同分期乳腺癌组织中KLF15 mRNA表达均低于正常乳腺组织(P均<0.05)。UALCAN分析结果显示,乳腺癌组织中KLF15 mRNA表达下调(P<0.05)。见图1。
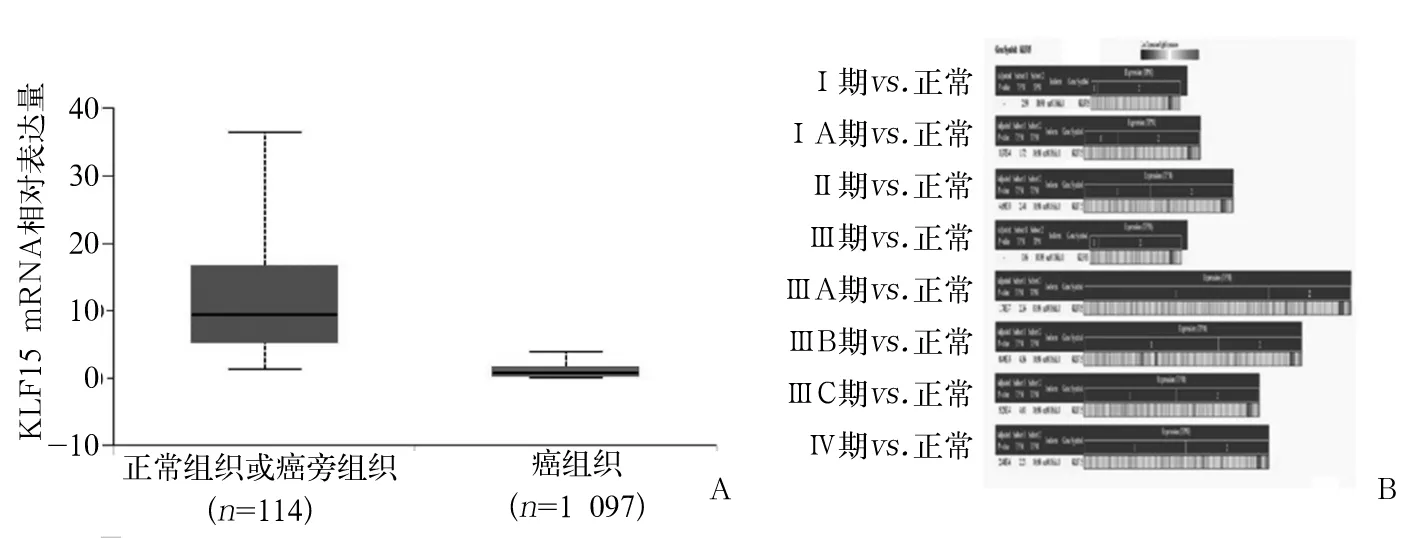
注:A为UALCAN分析结果;B为CRN分析结果。
2.2 过表达组与空载组培养不同时间细胞增殖能力比较 过表达组培养24、48 h细胞增殖能力均低于空载组(P均<0.05)。见表1。

表1 过表达组与空载组培养不同时间细胞增殖能力比较
注:与同时点空载组相比,*P<0.05。
2.3 过表达组与空载组克隆形成能力比较 过表达组和空载组克隆数分别为(40.89±1.56)、(79.11±5.31)个,克隆形成率分别为20.5%±0.7%、39.6%±2.6%,过表达组克隆形成率低于空载组(P<0.05)。见图2。
2.4 过表达组与空载组细胞周期比较 过表达组G0/G1期细胞比例高于空载组(P<0.05)。见表2。
2.5 过表达组与空载组细胞中p21、p27基因及蛋白表达比较 过表达组p21基因及蛋白表达高于空载组(P均<0.05)。见表3。
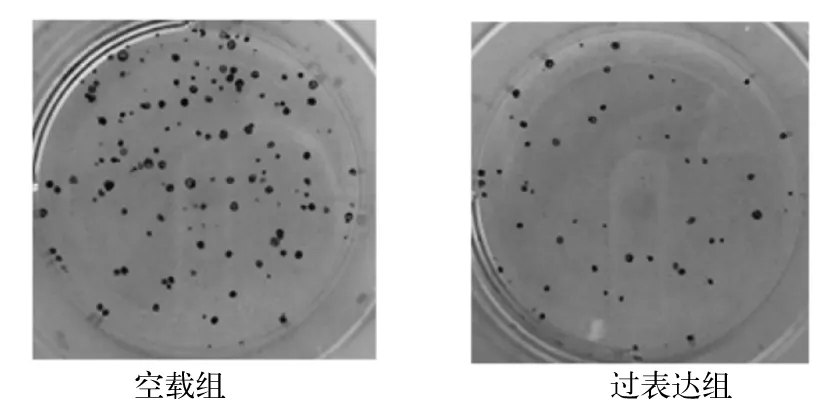
图2 过表达组与空载组克隆形成情况
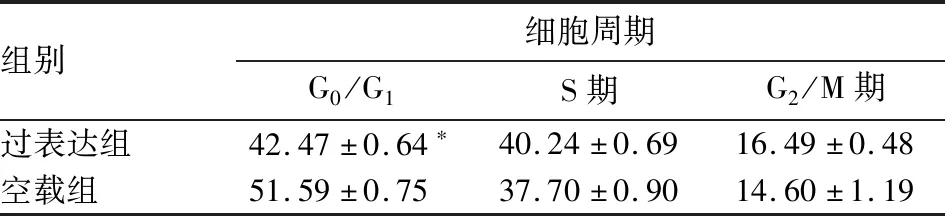
组别细胞周期G0/G1S期G2/M期过表达组42.47±0.64∗40.24±0.6916.49±0.48空载组51.59±0.7537.70±0.9014.60±1.19
注:与空载组相比,*P<0.05。

表3 过表达组与空载组细胞中p21、p27基因及蛋白表达比较
注:与空载组相比,*P<0.05。
3 讨论
KLF家族不仅参与多种细胞的正常生理过程,同时也与恶性肿瘤的发生和发展密切相关[10]。有学者发现孕酮受体能够诱导KLF15的表达,同时也发现KLF15结合于E2F1的启动子区,提示KLF15是作为转录因子来发挥作用的[11]。KLF15是KLF家族的一员,研究证实其在多种恶性肿瘤细胞系中发挥抗增殖活性。KLF15在胃癌组织中表达明显下调,KLF15过表达后通过调节p21和p57的表达从而抑制胃癌细胞增殖[12]。在食管鳞状细胞癌中,KLF15可激活脂质运载蛋白2(LCN2)的转录和翻译,而LCN2在癌组织中高表达,且与肿瘤大小、分期和侵袭性等密切相关[13]。肺癌组织中KLF15呈低表达,与患者预后密切相关[14]。
梁铃等[15]应用生物信息学方法分析了KLF15在乳腺癌中的表达变化,发现KLF15与乳腺癌预后显著相关,但KLF15在乳腺癌组织和正常组织中表达差异无统计学意义。本研究结果显示,乳腺癌组织中KLF15 mRNA呈低表达,且不同分期的乳腺癌患者肿瘤组织中KLF15 mRNA表达均低于正常乳腺组织。进一步体外实验发现,KLF15基因表达上调的乳腺癌细胞增殖能力、克隆能力受到抑制,提示KLF15可能在乳腺癌中起抑瘤作用。
为研究KLF15的抑瘤作用机制,我们应用流式细胞仪分析了过表达组和空载组的细胞周期,结果显示,过表达组G0/G1期细胞比例高于空载组,表明KLF15可使乳腺癌细胞周期阻滞于G0/G1期。Ray等[8]研究也发现了KLF15在细胞周期调节中的作用,他们的研究表明,KLF15可能通过抑制DNA复制从而阻滞人子宫内膜癌细胞系的细胞周期。此外,在正常肾小球系膜细胞中,KLF15也可通过调节细胞周期相关基因的表达来抑制细胞增殖[16]。本研究结果与上述研究一致。
p21是一种众所周知的细胞周期调节因子[17]。在细胞周期调控系统中,p21为负性调控因子,具有抑癌作用。p27也属于CKI家族,为具有抑癌作用的细胞周期负调控因子,是一个重要的抑癌基因。我们研究了KLF15表达与p21、p27表达的关联性,结果显示,过表达组p21基因及蛋白表达高于空载组,两组p27基因及蛋白表达差异无统计学意义。这提示在乳腺癌细胞系MCF-7中,KLF15诱导的细胞周期阻滞可能由p21介导,与p27关系不明显。
总之,本研究发现,KLF15 mRNA在乳腺癌组织中表达明显下调。KLF15基因表达上调的乳腺癌细胞增殖能力、克隆形成能力减弱,细胞周期阻滞于G0/G1期。KLF15对乳腺癌细胞的增殖抑制机制可能与上调p21表达有关。上述研究结果为KLF15作为乳腺癌新的治疗靶点提供了理论依据。
