人脐带间充质干细胞移植对酒精性肝损伤大鼠的保护作用*
2019-11-13王瑞芳冯丹丹
高 磊,曹 蕾,王瑞芳,冯丹丹,薛 娟
人脐带间充质干细胞(umbilical cord mesenchymal stem cells,UCMSCs)数量丰富,在组织工程和细胞治疗领域具有很大的应用价值[1]。近年来,研究发现人UCMSCs具有免疫调节和分化为肝细胞的能力,在治疗肝脏疾病方面有显著的疗效[2-4]。酒精性肝病(alcoholic liver disease,ALD)是临床普遍存在的一种慢性酒精中毒引起的酒精性肝病。甘草酸(glycyrrhizic acid,GL)是中草药甘草的主要有效成分,具有抗炎、加强肝脏的解毒功能和减轻肝细胞的损伤作用,在肝病治疗领域被广泛应用[5]。本文采用人UCMSCs移植和甘草酸处理ALD大鼠,观察了其对酒精性肝损伤的保护作用。
1 材料与方法
1.1 动物、试剂、药物与仪器 40只健康SD大鼠,体质量为(110±20)g,雌雄各半,购自北京维通利华实验技术有限公司【许可证号SCXK(京)2011-0011】。Ⅱ型胶原酶(Sigma,美国);D-Hank’s液、胎牛血清、DMEM/F12培养基、0.25%胰蛋白酶、Mesen PRO RSTMMedium(Gibico,美国);市售 56?红星二锅头;检测血清丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、丙二醛(MDA)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GPx)试剂盒(南京建成生物工程研究所);苏木精-伊红染色液(北京索莱宝);TransScript One-Step cDNA 合成试剂盒和Tap PCR Mix(北京全式金生物技术有限公司);CYP2B1引物设计及合成(金斯瑞生物科技公司)。GL为本实验室自制。光学显微镜(Olympus,日本);低温高速离心机(Thermo,美国);PCR 分析仪(ABI,美国);酶标仪(Bio Tek,美国);恒温震荡仪(其林贝尔仪器设备有限公司);6孔板、培养瓶、培养皿(Coming,美国)。
1.2 UCMSCs培养[6]本研究经医院医学伦理委员会批准。经过产妇知情同意后,采集正常足月剖宫产健康胎儿脐带组织,置入Hank’s液,4℃保存。在超净台内取出脐带,用PBS冲洗血液,用手术刀剔除脐带内血管,将脐带剪成1~2 mm3组织块,放入培养瓶,加入Ⅱ型胶原酶消化,过滤、收集细胞,接种在6孔板内,置于CO2培养箱内培养。96 h后半量更换培养液,以后隔半天半量换液,显微镜下观察,大约10 d后,细胞融合达到80%时,进行传代培养。
1.3 慢性ALD动物模型的建立与细胞移植干预[7]取40只SD大鼠,正常饲养1 w,给予其中30只白酒10 ml·kg-1灌胃,早晚各一次,连续30 d。待大鼠状态变差,活动减少,精神萎靡,毛发无光泽时,即建立慢性ALD模型成功。将ALD动物随机分为模型组(B组)、脐带间充质干细胞移植组(C组)和脐带间充质干细胞联合甘草酸处理组(D组)。给予B组动物生理盐水1 ml,给予C组动物UCMSCs(1×1010/L)1 ml,给予 D 组动物 UCMSCs (1×1010/L)和甘草酸(100 mg·kg-1)1 ml,门静脉注射,另10只为对照组(A组),给予生理盐水1 ml门静脉注射。
1.4 血清检测 在细胞移植2 w后,经尾静脉取血,4℃、4000 r/m离心10 min,分离血清,于 -20℃冰箱保存,备测。
1.5 肝组织病理学检查 取血后,即刻取出肝脏,取部分肝组织用10%甲醛固定,常规石蜡包埋切片,HE染色,光学显微镜下观察。
1.6 肝组织细胞色素P450亚酶(CYP2B1)mRNA水平检测 采用RT-PCR法,在液氮中研磨肝组织,加入Trizol溶液提取总RNA。应用核酸蛋白仪和琼脂糖电泳对提取的RNA进行分析。取总RNA 4μL,82℃水浴5 min,加入反转录反应液,44℃孵育60 min,留取产物待用。引物见表1,扩增参数,95℃ 10 min,60℃ 50 s,72℃延伸 50 s,72℃延伸10 min,10℃保存。基因水平分析采用 2-△Ct法,将GAPDH设为内参,取Ct值。计算公式为:△Ct=Ct(目的基因)-Ct(GAPDH);△△Ct=△Ct(实验组)-△Ct(对照组)。
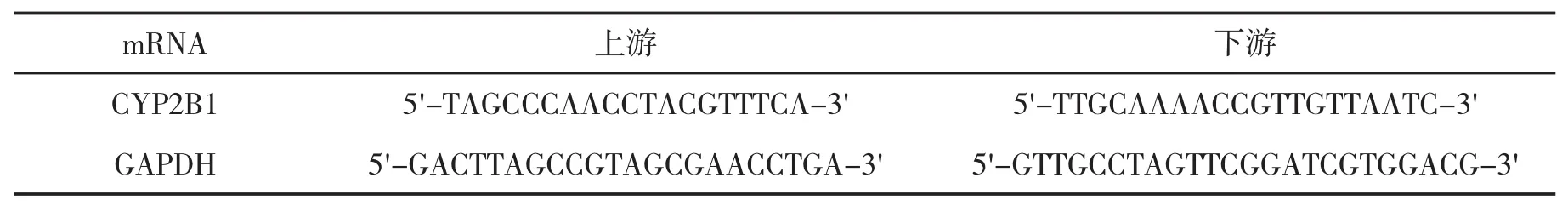
表1 引物序列
1.7 统计学分析 应用SPSS 19.0软件行统计学处理,计量资料以±s表示,组间两两比较采用LSD-t检验,多组间比较采用单因素方差分析,以P<0.05判定为差异具有显著性。
2 结果
2.1 肝组织病理学变化 A组大鼠肝组织结构完整,肝小叶结构清晰,细胞形态规则,细胞核圆形,胞质丰满,无异常改变(图1A);B组大鼠肝小叶界限不清晰,肝细胞索排列紊乱,细胞核模糊不清,肝细胞胞质内有大小不等的圆形脂肪空泡,部分肝细胞肿胀,可见点灶坏死和部分炎性细胞浸润(图1B);C组和D组肝损伤有不同程度的减轻,以D组减轻较明显(图1C、图1D)。
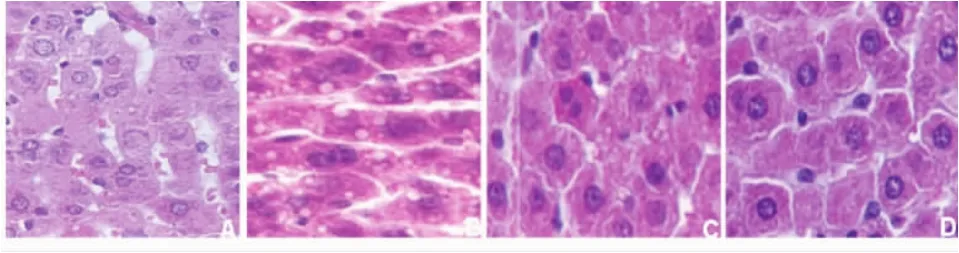
图1 各组大鼠肝组织病理形态学变化(HE,400×)
2.2 UCMSCs形态学观察结果 体外培养细胞3~5 h,细胞开始贴壁,48 h完全贴壁,出现长梭形和少量成纤维样细胞。随着传代次数的增加,成纤维样的UCMSCs增殖速度加快,扩增纯化后的第3代脐带间充质干细胞形态似长梭形,呈辐射状生长(图2)。
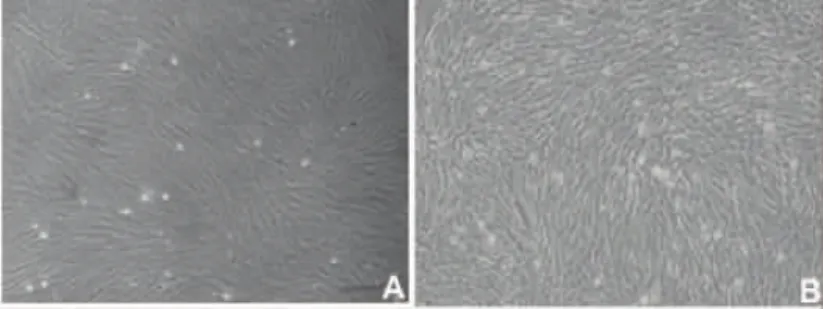
图2 人脐带间充质干细胞(200×)
2.3 各组大鼠血清指标水平比较 与A组比,B组大鼠血清AST、ALT和MDA水平显著升高,而SOD和GPx水平显著降低;与B组比,C组和D组血清AST、ALT和MDA水平显著下降(P<0.05),SOD和GPx水平显著升高(P<0.05,表2)。
表2 各组大鼠血清指标(±s)比较
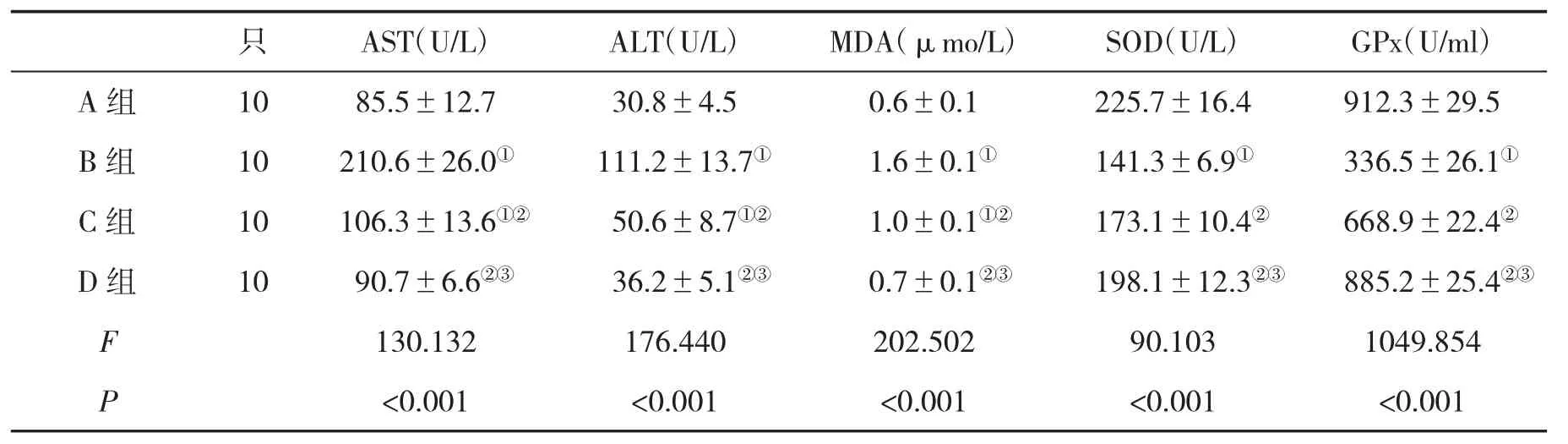
表2 各组大鼠血清指标(±s)比较
与A组比,①P<0.05;与B组比,②P<0.05;与C组比,③P<0.05
只 AST(U/L) ALT(U/L) MDA(μmo/L) SOD(U/L) GPx(U/ml)A 组 10 85.5±12.7 30.8±4.5 0.6±0.1 225.7±16.4 912.3±29.5 B组 10 210.6±26.0① 111.2±13.7① 1.6±0.1① 141.3±6.9① 336.5±26.1①C组 10 106.3±13.6①② 50.6±8.7①② 1.0±0.1①② 173.1±10.4② 668.9±22.4②D 组 10 90.7±6.6②③ 36.2±5.1②③ 0.7±0.1②③ 198.1±12.3②③ 885.2±25.4②③F 130.132 176.440 202.502 90.103 1049.854 P<0.001 <0.001 <0.001 <0.001 <0.001
2.4 各组肝组织CYP2B1 mRNA水平比较 与A组比,B组肝组织CYP2B1 mRNA水平显著降低;与B组和C组比,D组肝组织CYP2B1 mRNA水平显著增强,差异有显著性统计学意义(P<0.05,图3)。
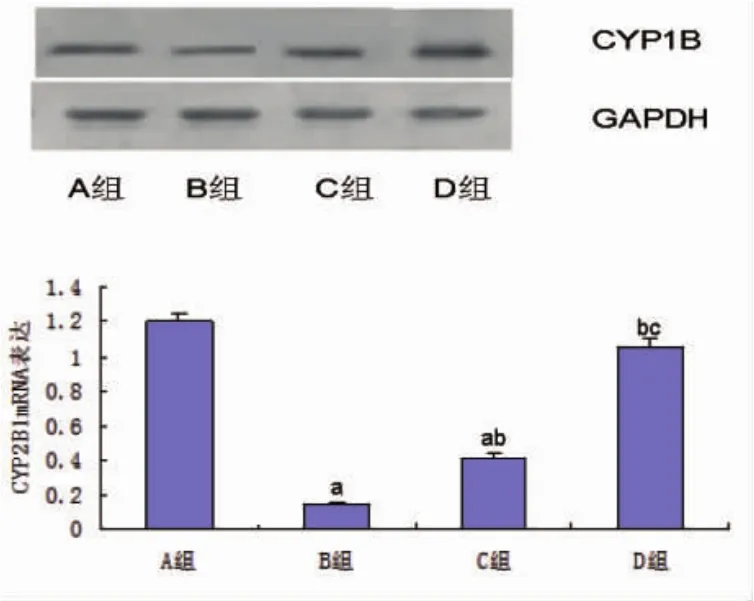
图3 各组肝组织CYP2B1 mRNA水平比较
3 讨论
研究指出,酒精中的乙醇在代谢时产生大量的自由基,致使肝细胞膜发生脂质过氧化,能引起肝脏组织中的肝细胞损伤和死亡,导致转氨酶升高。酒精代谢过程中产生的乙醛会对肝细胞产生毒性作用,抑制谷胱甘肽(glutathione,GSH)的合成,减弱SOD等抗氧化能力,导致大量MDA等氧化物的生成[8,9]。MDA的含量可以反映出机体细胞受自由基攻击的程度,SOD、GSH的活性高低是反映机体抗氧化能力的指标[10]。ATL和AST存在于肝细胞浆中,当肝细胞受损时,可使血清ATL和AST水平升高,是肝损伤的敏感指标。ATL和AST的大量释放,会加速SOD、GPx的消耗,引起细胞肿胀,肝功能异常,增强肝组织损伤程度[11,12]。本实验结果显示,相对于正常的大鼠,模型组大鼠肝组织受损后血清ALT、AST和MDA水平显著升高,而血清SOD和GPx水平显著降低。在脐带间充质干细胞移植组和脐带间充质干细胞移植联合甘草酸处理组大鼠血清ALT、AST和MDA水平均显著下降,SOD和GPx水平显著升高。脐带间充质干细胞移植联合甘草酸处理组血清ALT、AST和MDA水平下降明显,SOD和GPx水平进一步增高。
CYP2B亚家族与肝脏药物代谢的作用有关,CYP2B可以催化底物,具有解毒的作用。CYP2B1蛋白是肝细胞特征性功能蛋白[13]。在本实验中,与模型组或脐带间充质干细胞移植组比,脐带间充质干细胞移植联合甘草酸处理组动物肝组织肝细胞特征性功能蛋白CYP2B1 mRNA水平显著增高,差异有统计学意义。
目前,尚缺乏理想的治疗ALD的药物,而甘氨酸是很早就被用于治疗肝病的药物,实验及临床研究报道,应用甘氨酸能改善肝组织的病理学损伤,减慢肝细胞坏死的进程,血清ALT水平下降,恢复肝细胞内肝糖元和核酸代谢,促进胆红素代谢,具有抗病毒、抗炎和抗肝纤维化的作用[14-17]。干细胞移植又是近年来组织工程研究的新领域,两者的结合将会为肝损伤的治疗提供新的方法。研究表明UCMSCs在特定的条件下可以向肝细胞分化,在体外动物实验发现对肝脏疾病有一定的治疗作用,并且由于其取材方便、来源广、获得方便,将会成为肝病治疗领域里的理想选择[18-20]。在临床上,研究也显示UCMSCs移植能改善肝病患者的肝功能及临床症状,提高患者的生存率。
综上所述,UCMSCs移植能够有效地保护酒精所致的肝损伤,与甘氨酸联合使用后效果更明显,其机制可能与抗自由基及脂质过氧化有关。
