小儿厌食症模型大鼠血清代谢组特征探析
2019-11-13张鸿彬蔺湘宁王鹏飞尚菁王强李玉霞段淑文王小荣
张鸿彬,蔺湘宁,王鹏飞,尚菁,王强,李玉霞,段淑文,王小荣*
(1.甘肃中医药大学,甘肃 兰州 730000;2.石家庄平安医院,河北 石家庄 050000)
小儿厌食症(Infantile anorexia,IA)[1]是指以小儿长期食欲减退或食欲缺乏为主要症状的一种疾病。中医古代文献中并无厌食症病名,但依据证候学可将其归为“伤食”“积滞”“疳积”等范畴。属于学龄前儿童和青少年时期最为常见的疾病之一,由于这个时期的儿童正处于生长发育期,若不能摄取足够的营养物质,则会影响正常发育,出现发育迟缓,免疫力下降和智力障碍等一系列问题。
代谢组学是近年来发展起来的一种新兴学科,是研究生物体被扰动后其代谢产物(一般指相对分子质量<1 000的小分子代谢物质)的种类、数量及变化规律的科学[2]。代谢组学技术已经在实验动物模型评价中展现了其特色和明显的优势[3-4]。但关于IA的代谢组学研究目前还少有报道,本研究利用代谢组学研究方法,以IA模型大鼠血清为研究对象,采用LC-Q/TOF-MS液相色谱-质谱联用技术,通过化学计量学模式识别的方法,发现潜在生物标志物并鉴定,解析代谢通路,初步从代谢组学角度探析IA的生物学本质。
1 材料
1.1 仪器与设备
采用美国安捷伦科技公司LC-Q/TOF-MS仪器分析平台;VELOCITY 18R台式高速离心机(澳大利亚Dynamica公司);DV314C精密电子分析天平(美国奥豪斯公司);ULFT386冰箱(美国Thermo公司)。
1.2 试剂与药物
LC-MS级乙腈(德国Merck公司);HPLC级甲醇(德国Merck公司);甲酸(上海CNW公司);超纯水(德国Merck公司);2-氯苯丙氨酸[吉尔生化(上海)有限公司];高脂饲料(北京科奥协力饲料有限公司)。
1.3 实验动物
断乳后1周龄的SPF级SD大鼠120只,雌雄各半,体质量(60±10)g,由甘肃中医药大学动物实验中心提供,许可证号:SCXK(甘)2015-0005。饲养于甘肃中医药大学科研实验动物中心,环境温度(22±2)℃,相对湿度(50±20)%,明暗周期为12 h。
2 实验方法
2.1 实验分组
适应性喂养1周后,按雌雄及体质量根据随机数表法分为空白组(K组)20只,模型组(M组)100只。
2.2 模型制备
参照汪受传等[5]特制高脂饲料喂养幼龄大鼠建立IA模型的方法,各组大鼠雌雄分开,空白组以常规饲料喂养,模型组以高脂饲料喂养(采用奶粉、玉米粉、鲜鸡蛋、鲜肥肉、鱼肉松、黄豆粉和白糖按比例混匀制成),自由进食饮水,共饲养5周。实验过程中,每日定时称取和记录大鼠食量和体质量。当模型组大鼠食量降低40%~60%,或者当体质量低于正常组的10%~15%,但不出现蜷卧、弓背耸肩以及腹泻等脾虚症状时,即认为造模成功。
2.3 样本采集与预处理
实验最后各组股静脉取血4 mL,备检。血清标本处理:室温静置1 h使血液凝固析出血清,用离心机以4 000 r/min转速离心10 min,用移液器收集上清液,放置到-80 ℃冰箱保存,待检。
2.4 样本前处理与检测
将大鼠血清样本从冰箱取出,放置室温解冻,每个样本取100 μL血清样本至1.5 mL EP管中,然后加入300 μL甲醇,并加入10 μL的内标(2.9 mg/mL,2-氯苯丙氨酸),涡旋30 s,4 ℃条件下12 000 r/min离心15 min。取上清液200 μL,转入进样小瓶中进行检测。
2.5 色谱条件
C18色谱柱(Agilent,100 mm×2.1 mm,1.8 μm),柱温40 ℃,流速0.35 mL/min;流动相组成A:水+0.1%甲酸,B:乙腈+0.1%甲酸;进样量为4 μL,自动进样器温度4 ℃。
2.6 质谱条件
采用ESI离子源,同时进行正负全离子模式扫描。正离子模式条件为:毛细管电压4 kV,锥孔电压35 kV,离子源温度100 ℃;脱溶剂气温度350 ℃,反向锥孔气流50 L/h,脱溶剂气600 L/h,萃取锥孔4 V。
负离子模式检测条件:毛细管电压3.5 kV、锥孔电压50 kV、离子源温度100 ℃;脱溶剂气温度300 ℃、反向锥孔气流50 L/h、脱溶剂气700 L/h、萃取锥孔4 V。离子扫描时间0.03 s、扫描时间间隔0.02 s、数据采集范围:50~1 000 m/z。
2.7 数据处理
2.7.1 统计学处理

2.7.2 代谢组学数据处理
所获得样本数据用Mass Profiler软件(Agilent公司)进行预处理,并在Excel 2010中进行后期编辑,将最终结果组织为二维数据矩阵,包含保留时间、分子量、观察量(样本)和峰强等信息。对数据进行归一化处理后导入SIMCA-P 13.0软件进行主成分分析(PCA)、正交偏最小二乘判别分析(OPLS-DA)。采用OPLS-DA模型的VIP值(阈值>1),并结合t检验的P值(P<0.05)来寻找差异性表达代谢物。搜索在线数据库(Metlin)为差异性代谢物定性。应用MetPA网络构建分析代谢通路,将筛选出的代谢物的HMDB编号输入进行代谢通路分析,然后通过检索代谢途径数据库KEGG,并结合相关文献、生物化学及分子生物学知识,探讨潜在生物标志物相关生物学意义。
3 结果
3.1 摄食量、体质量变化情况
适应性喂养7天后,开始正式实验,并记录相关数据,动态观察两组大鼠的生长状况,M组大鼠在造模后第7天开始食量、体质量低于K组,持续4周,统计学处理均有显著性差异。见表1、表2和图1。M组大鼠从第28天开始日进食量低于K组40%~60%,体质量从第7天开始比K组降低10%~15%,不伴有腹泻、毛枯、少动等其他症状,符合IA的临床表现,提示造模成功[5]。
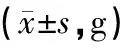
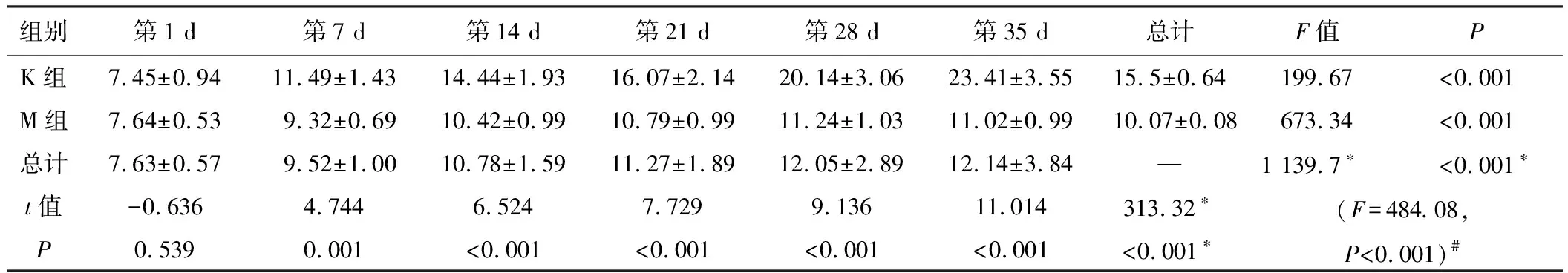
组别第1 d第7 d第14 d第21 d第28 d第35 d总计F值PK组7.45±0.9411.49±1.4314.44±1.9316.07±2.1420.14±3.0623.41±3.5515.5±0.64199.67<0.001M组7.64±0.539.32±0.6910.42±0.9910.79±0.9911.24±1.0311.02±0.9910.07±0.08673.34<0.001总计7.63±0.579.52±1.0010.78±1.5911.27±1.8912.05±2.8912.14±3.84—1 139.7∗<0.001∗t值-0.6364.7446.5247.7299.13611.014313.32∗(F=484.08,P<0.001)#P0.5390.001<0.001<0.001<0.001<0.001<0.001∗
注:*主效应的F值和P值;#交互效应的F值与P值。
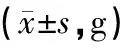
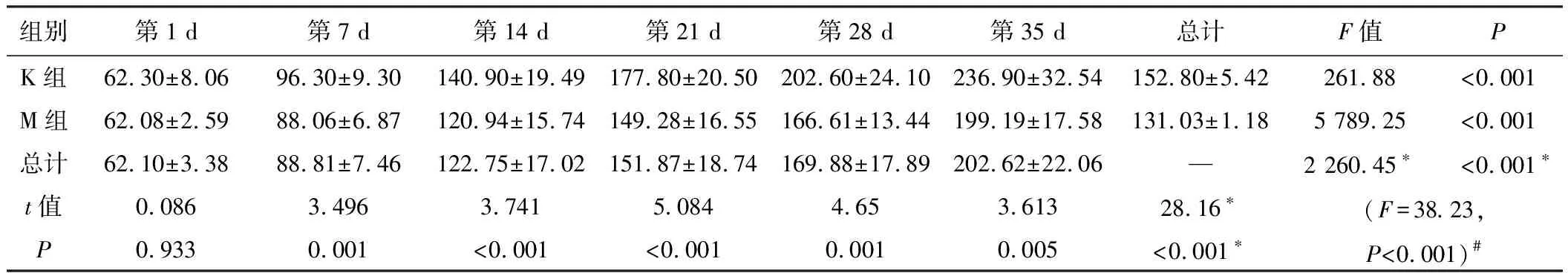
组别第1 d第7 d第14 d第21 d第28 d第35 d总计F值PK组62.30±8.0696.30±9.30140.90±19.49177.80±20.50202.60±24.10236.90±32.54152.80±5.42261.88<0.001M组62.08±2.5988.06±6.87120.94±15.74149.28±16.55166.61±13.44199.19±17.58131.03±1.185 789.25<0.001总计62.10±3.3888.81±7.46122.75±17.02151.87±18.74169.88±17.89202.62±22.06—2 260.45∗<0.001∗t值0.0863.4963.7415.0844.653.61328.16∗(F=38.23,P<0.001)#P0.9330.001<0.001<0.0010.0010.005<0.001∗
注:*主效应的F值和P值;#交互效应的F值与P值。

图1 大鼠食量、体质量方差轮廓图
3.2 原始色谱图的可视化结果
经过色谱柱分离流出的组分不断进入质谱,质谱连续扫描进行数据采集,每次扫描得到一张质谱图,离子强度为纵坐标,时间为横坐标,正模式下单个样本TIC图(图2)所示,M组与K组的图谱在同一时间点的峰度值差异较大,提示该处的化合物信息有较大差异,IA模型大鼠体内代谢被扰动。
3.3 血清代谢组学分析
实验首先使用PCA进行比较,显示两组明显区分(图3)。为了进一步验证分类的可靠性,采用了OPLS-DA对两组样本重新建模分析,得到很好的区分模型(图4)。
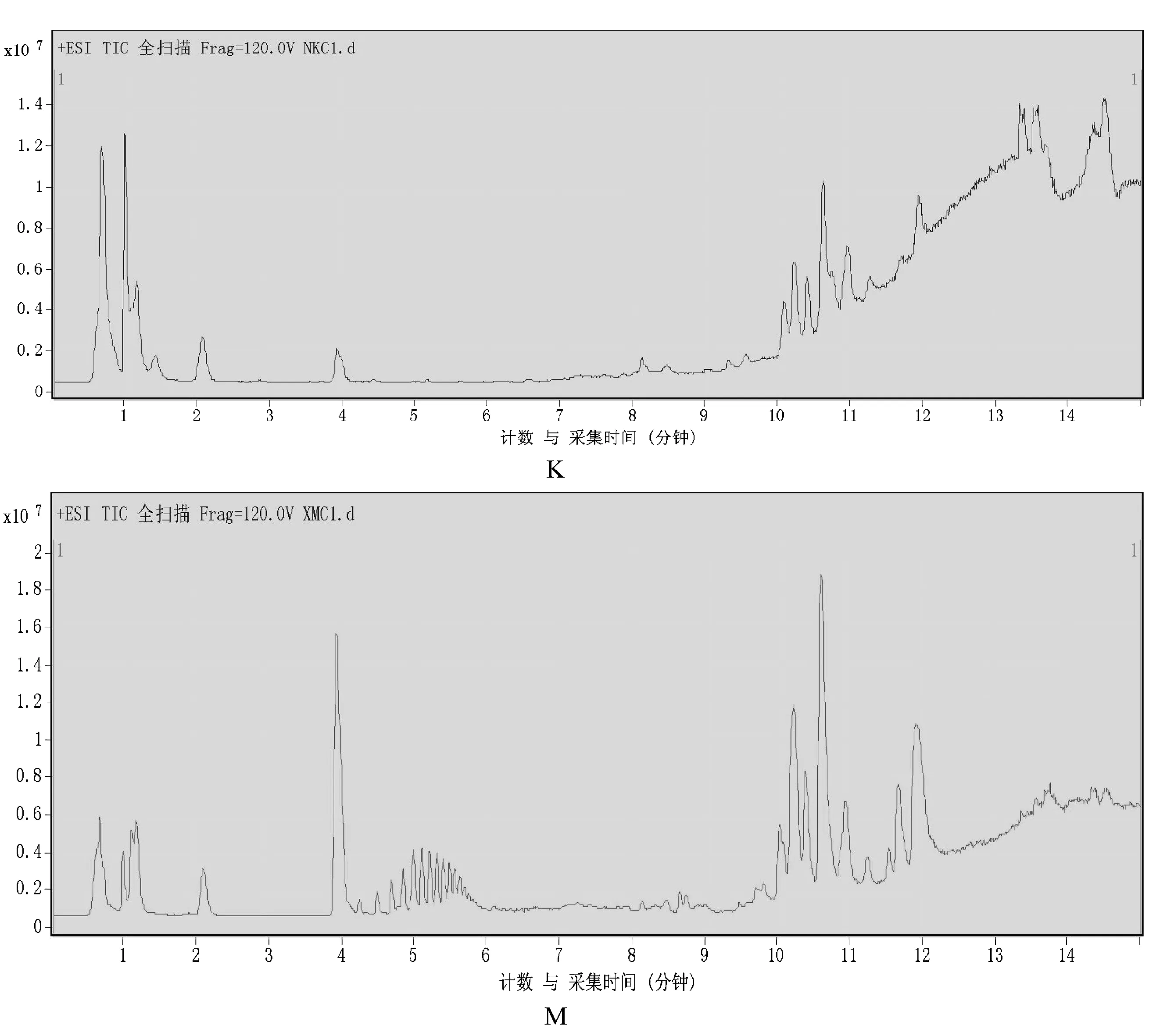
注:K:空白组;M:模型组。图2 单个样本TIC图
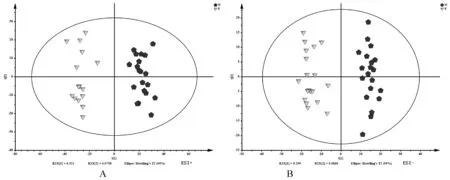
注:A:正模式;B:负模式。图3 M-K两组的PCA得分图
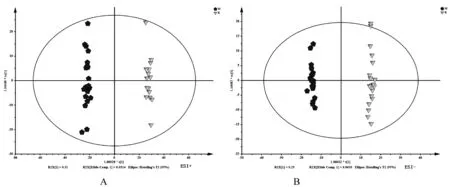
注:A:正模式; B:负模式。图4 M-K两组的OPLS-DA得分图
3.4 IA潜在生物标志物鉴定
根据OPLS-DA模型的VIP值(阈值>1),结合t检验的P值(P<0.05)来寻找差异性代谢物。利用质谱的质核比或者精确分子质量搜索HMDB,METLIN,KEGG等在线数据库,检索到相对应的化合物,得到30个差异性代谢物,见表3。
表3M-K两组的差异性代谢物
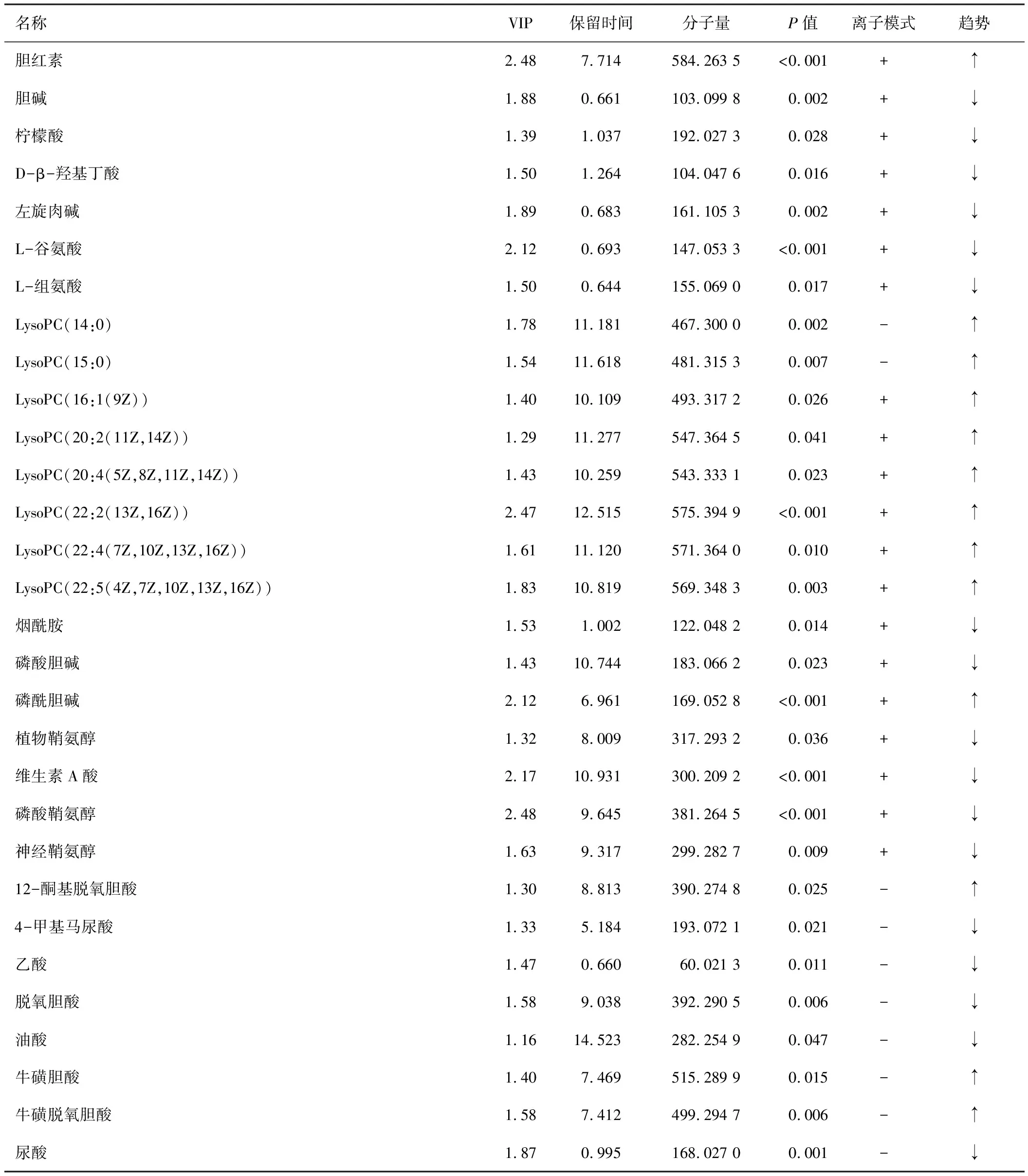
名称VIP保留时间分子量P值离子模式趋势胆红素2.487.714584.263 5<0.001+↑胆碱1.880.661103.099 80.002+↓柠檬酸1.391.037192.027 30.028+↓D-β-羟基丁酸1.501.264104.047 60.016+↓左旋肉碱1.890.683161.105 30.002+↓L-谷氨酸2.120.693147.053 3<0.001+↓L-组氨酸1.500.644155.069 00.017+↓LysoPC(14:0)1.7811.181467.300 00.002-↑LysoPC(15:0)1.5411.618481.315 30.007-↑LysoPC(16:1(9Z))1.4010.109493.317 20.026+↑LysoPC(20:2(11Z,14Z))1.2911.277547.364 50.041+↑LysoPC(20:4(5Z,8Z,11Z,14Z))1.4310.259543.333 10.023+↑LysoPC(22:2(13Z,16Z))2.4712.515575.394 9<0.001+↑LysoPC(22:4(7Z,10Z,13Z,16Z))1.6111.120571.364 00.010+↑LysoPC(22:5(4Z,7Z,10Z,13Z,16Z))1.8310.819569.348 30.003+↑烟酰胺1.531.002122.048 20.014+↓磷酸胆碱1.4310.744183.066 20.023+↓磷酰胆碱2.126.961169.052 8<0.001+↑植物鞘氨醇1.328.009317.293 20.036+↓维生素A酸2.1710.931300.209 2<0.001+↓磷酸鞘氨醇2.489.645381.264 5<0.001+↓神经鞘氨醇1.639.317299.282 70.009+↓12-酮基脱氧胆酸1.308.813390.274 80.025-↑4-甲基马尿酸1.335.184193.072 10.021-↓乙酸1.470.66060.021 30.011-↓脱氧胆酸1.589.038392.290 50.006-↓油酸1.1614.523282.254 90.047-↓牛磺胆酸1.407.469515.289 90.015-↑牛磺脱氧胆酸1.587.412499.294 70.006-↑尿酸1.870.995168.027 00.001-↓
注:名称为差异代谢物名称;VIP为OPLS-DA模型构建时不同物质对模型的贡献率;P值为t检验得到显著性值;趋势是M组相对于K组的趋势。
3.5 代谢通路分析
应用MetaboAnalyst 3.0分析代谢通路。利用拓扑分析,代谢通路影响的临界值设置为0.01,大于该值将选择作为潜在的关键代谢通路(图5,表4)。如图5所示,图中圆点越大、颜色越红,说明富集的差异代谢物越多,差异代谢物对该点代表的通路的影响越大。
表4IA模型大鼠代谢通路
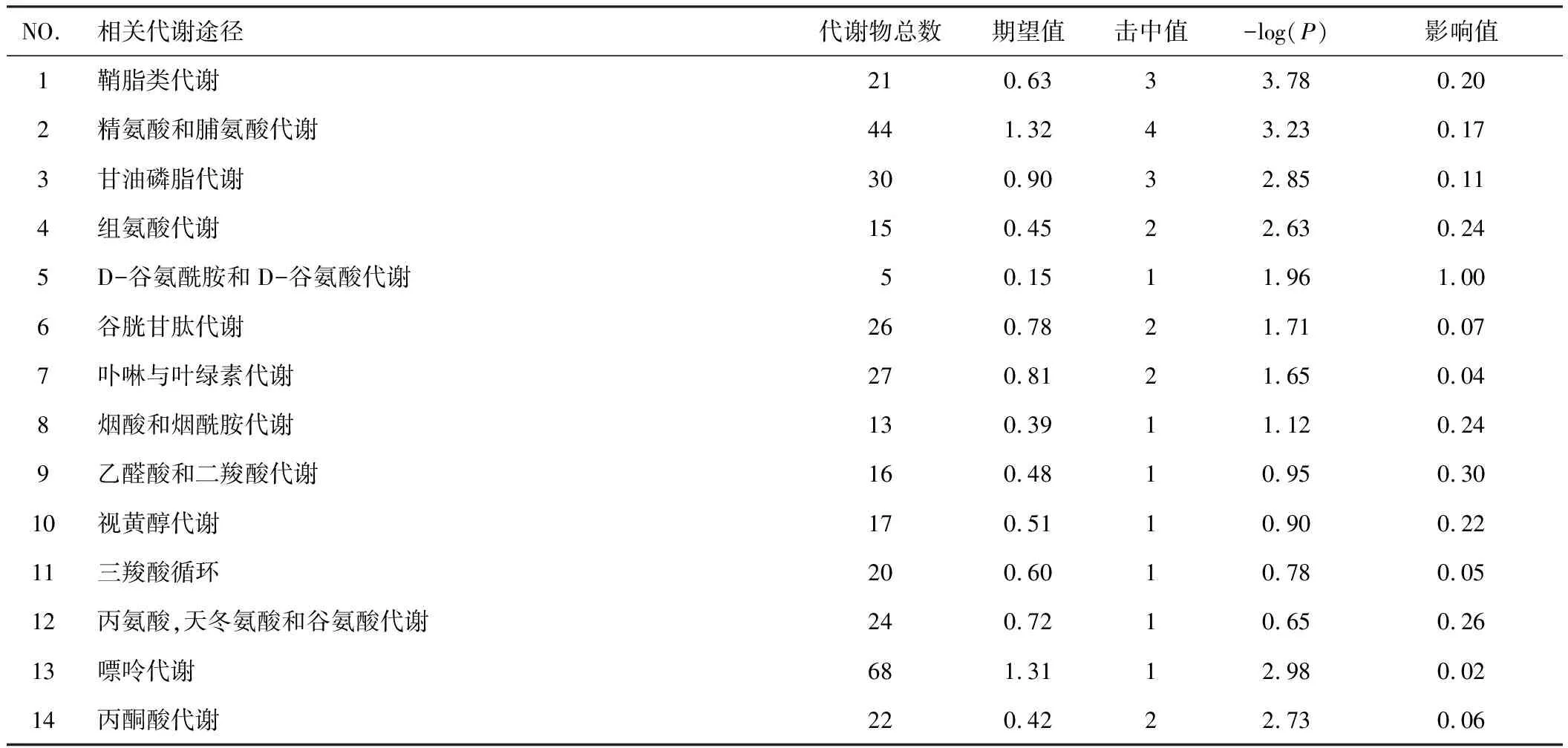
NO.相关代谢途径代谢物总数期望值击中值-log(P)影响值1鞘脂类代谢210.6333.780.202精氨酸和脯氨酸代谢441.3243.230.173甘油磷脂代谢300.9032.850.114组氨酸代谢150.4522.630.245D-谷氨酰胺和D-谷氨酸代谢50.1511.961.006谷胱甘肽代谢260.7821.710.077卟啉与叶绿素代谢270.8121.650.048烟酸和烟酰胺代谢130.3911.120.249乙醛酸和二羧酸代谢160.4810.950.3010视黄醇代谢170.5110.900.2211三羧酸循环200.6010.780.0512丙氨酸,天冬氨酸和谷氨酸代谢240.7210.650.2613嘌呤代谢681.3112.980.0214丙酮酸代谢220.4222.730.06
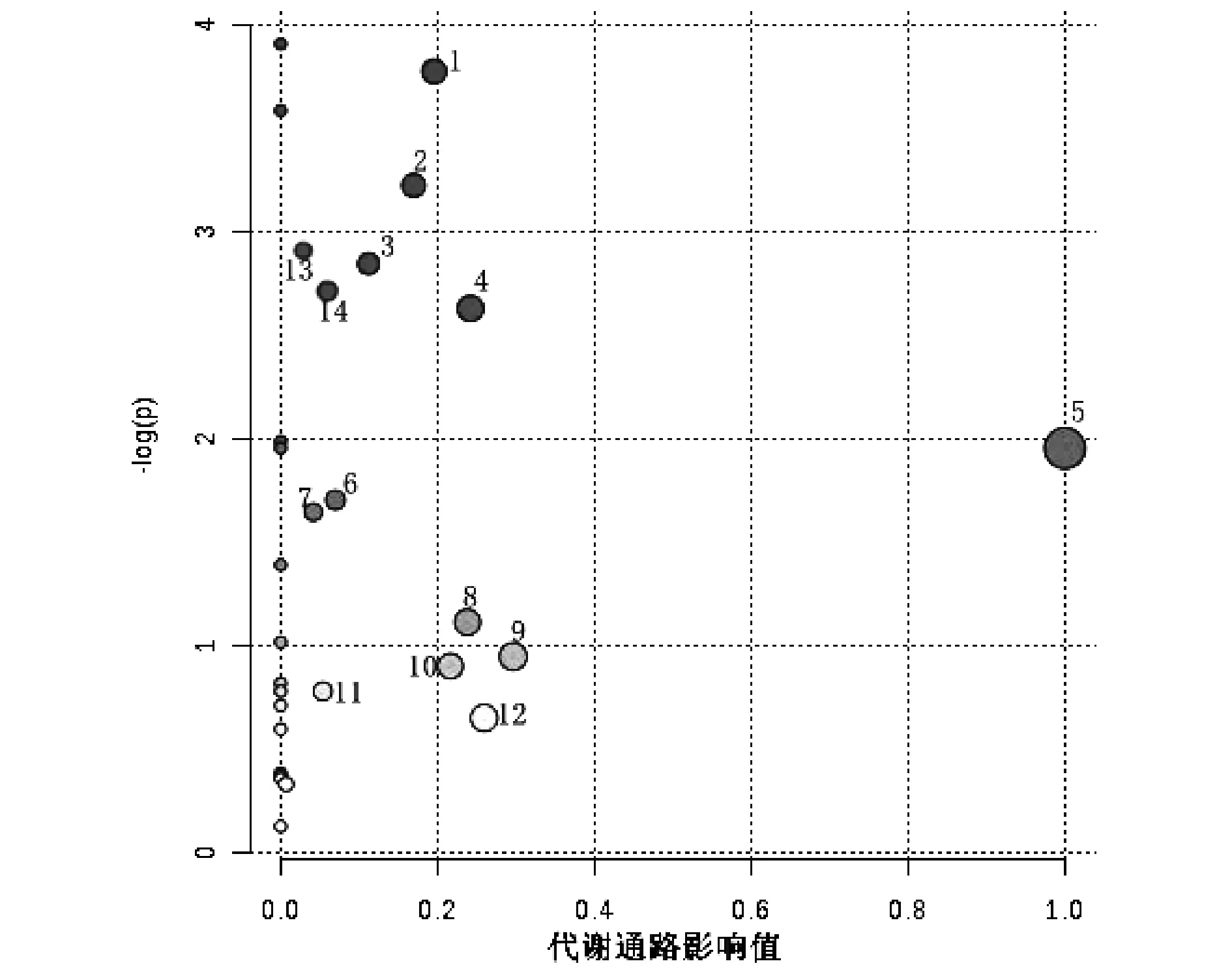
注:横坐标表示通路影响值;纵坐标表示转换后的P值。圆点的大小表示富集的差异代谢物数量,点越大,富集代谢物越多。颜色表示显著性,颜色越深,P值越小。图5 代谢通路影响值
4 讨论
中医学认为,小儿为稚阴稚阳之体,脏腑娇嫩,形气未充,具有“三不足、四有余”的特点,任何影响到脾胃运化的因素都可导致厌食的产生。如钱乙《小儿药证直诀》中言:“脾胃不和,不能乳食,致肌瘦”,《幼幼集成·积食证治》云:“脾虚不运则气不流行,气不流行则停滞而为积,或作泻痢,或成痞,以致饮食减少”。本研究从代谢组学的角度探析IA的生物学特征,以期为IA的进一步研究提供参考。
结果显示,M组与K组之间代谢差异物主要集中在脂类代谢、氨基酸类代谢和三羧酸循环等代谢途径中,提示IA的发病过程与这些代谢的紊乱有密切的关系。
胆碱作为甘油磷脂代谢的产物,是神经递质乙酰胆碱的合成前体物质,并且是磷酰胆碱、溶血卵磷脂(LysoPC)和鞘磷脂的组成成分,在动物大脑发育和维持神经的正常功能方面起着重要作用,研究发现生长期幼鼠缺乏胆碱会造成大脑结构和功能永久性损伤[6-9]。胆碱作为人和动物生长发育必需的营养物质[10],其代谢的紊乱对细胞膜的稳定性,信号基质的传递都会造成一定的干扰,最终扰动细胞的正常生理活动[11]。磷酰胆碱的降解产物磷脂质是构成细胞脂质双分子层的关键成分,并在信号传导和代谢中起着重要作用[12]。溶血卵磷脂通过磷脂酶水解磷脂酰胆碱生成,可以启动卵磷脂受体,进行酯信号传导,完成膜内外蛋白的交换[13]。M组胆碱下降,溶血卵磷脂和磷酰胆碱上升,这种变化扰动了的甘油磷脂代谢通路,其代谢通路的整体变化也会引起甘油磷脂功能的异常,从而可能引起细胞生理平衡的紊乱。
4.1 氨基酸代谢
谷氨酸、组氨酸在IA模型大鼠血清中含量较K组显著降低,表明氨基酸代谢在IA发病过程中受到很大的影响。L-谷氨酸是蛋白质的主要构成成分,虽然不是人体必需氨基酸,但可作为碳氮营养参与机体代谢,有较高的营养价值[10]。在氨基酸合成途径中,谷氨酸又是合成谷氨酰胺、脯氨酸、精氨酸、赖氨酸和谷胱甘肽的重要前体。谷氨酸在上皮细胞和草酰乙酸通过氨基交换产生α-酮戊二酸和天冬氨酸。谷氨酸在丙酮酸存在的情况下能通过转氨产生丙氨酸和α-酮戊二酸。通过氨基交换产生的α-酮戊二酸能够进入线粒体,然后进入三羧循环产生还原性辅酶用于线粒体ATP的合成。谷胱甘肽由谷氨酸、半胱氨酸及甘氨酸组成,在维持细胞正常生理活动中具有重要作用,能帮助保持正常的免疫系统的功能,并具有调控营养代谢和细胞的抗氧化等功能[13]。组氨酸是一种半必需氨基酸,对婴幼儿及动物的成长尤为重要,研究发现幼龄动物和婴儿体内的组氨酸合成量不能满足机体生长需要,这些氨基酸代谢的紊乱,直接影响到机体的正常生理功能,与IA的发病有着密切的关系。
4.2 三羧酸循环
三羧酸循环是糖、脂肪和蛋白质在体内彻底氧化的共同代谢途径,也是机体质量要的能量供应渠道。柠檬酸是三羧酸循环中重要的中间产物,本研究中柠檬酸含量显著降低,提示IA模型大鼠三羧酸循环发生紊乱。三羧酸循环另一重要功能是为其他合成代谢提供小分子前体,例如α-酮戊二酸和草酰乙酸分别是合成谷氨酸和天冬氨酸的前体,三羧酸循环的紊乱直接导致机体供能的紊乱及间接影响氨基酸的合成,影响机体的正常生理功能。D-β-羟丁酸是一种酮体,可在体内转化成乙酰乙酸,经三羧酸循环代谢,当机体代谢发生紊乱,不能正常利用葡萄糖时,心、脑等器官可利用酮体氧化分解供能,使D-β-羟丁酸含量降低,这些都说明IA的发病与三羧酸循环的紊乱有密切的关联。
进食高脂饮食会增高血胆酸水平[14],IA模型大鼠血清中牛磺胆酸和牛磺脱氧胆酸水平升高,分析原因考虑是IA模型大鼠一直以特制高脂饲料喂养,而高脂饮食可能改变了肠道的胆酸代谢。同时肠道菌群与胆酸代谢又互相影响[15-16],研究发现,高脂饮食可影响肠道菌群的构成,使甘氨胆酸向牛磺胆酸转化,以利于疏水性强的高脂饮食消化吸收[17],因此,本研究观察到IA模型组脱氧胆酸水平降低,牛磺胆酸水平升高应该是肠道菌群的一种适应性调节反应。并且结果显示马尿酸在模型组代谢发生了紊乱,这些含苯基的代谢产物主要是肠道菌群对酚类物质代谢产生的[17-19],表明肠道菌群在IA发病过程中的发生了变化,说明IA发病过程中存在肠道菌群的紊乱。研究显示新生儿肠道菌群缺乏或者使用广谱抗菌药引起的肠道菌群紊乱,均会减少肠腔内胆红素的还原和粪便中尿胆素样物质的排泄,导致肠腔内未被还原的胆红素大量进行肠肝循环,从而影响胆红素的动态平衡和其在血中的水平[20],导致血清中胆红素水平升高,这和实验中IA模型组大鼠胆红素升高的结果一致。这些代谢物的变化反映了IA的一些生物学特征,可以进一步筛选作为IA的特异性标志物,为后续研究提供一定的参考。
综上所述,IA的发病涉及多种代谢紊乱,高脂饲料喂养的大鼠代谢产物可能引起脂质代谢、氨基酸代谢和能量代谢的紊乱,最终导致本病的发生。同时发现IA患者可能同时存在肠道菌群失调的问题,还待进一步研究。本研究从整体水平反映了IA发病过程中内源性小分子的代谢变化,有助于其代谢网络的全面构建及疾病发病机制的阐释,为IA的诊断、治疗以及特效药物的开发与评价提供一定的依据。
