银杏叶提取物对慢性阻塞性肺疾病大鼠血清及肺组织中CRP、IL-1及IL-8的影响
2019-11-13王明娟齐永奇
王明娟,齐永奇
(1.河南中医药大学第三附属医院,河南 郑州 450008;2.华北水利水电大学,河南 郑州 450045)
慢性阻塞性肺疾病(Chronic obstructive pulmonary disease,COPD)是以不完全可逆性气流受限为主要特征,累及气道、肺实质及肺血管的一种常见慢性疾病[1],目前其发病机制和致病机理尚不完全明确。普遍认为COPD是由个体疾病易获得因素和外界因素共同造成的,随着吸烟人数的增多和空气污染的加剧,该病症发病率和病死率日趋上升,对社会经济造成巨大压力,已经成为全球性的公共卫生问题[2]。COPD的病情发展比较迅速,可逐渐发展为肺心病、心力衰竭、呼吸衰竭等,救治不及时甚或危及生命。当前研究成果认为,COPD的发生涉及炎性反应、氧化损伤、蛋白酶-抗蛋白酶失调、免疫功能障碍等多个方面[3]。银杏是中医传统药物,具有悠久的使用历史,《本草纲目》中记载其有“定喘止咳”之功效。银杏叶提取物(GinkgobilobaExtract,GBE)是从银杏的干燥叶中提取的有效药用组分,主要包括黄酮类、萜类内酯、有机酸、氨基酸、微量元素等多种化学成分。研究证实,GBE能抑制肺气肿的形成及肺血管重塑,不仅可以增强正常机体的免疫功能,还可调节异常机体的免疫功能[4]。本次研究就GBE对COPD大鼠道炎症的病理学改变及血清及肺组织中CRP、IL-1、IL-8的影响展开观察,探讨其对COPD大鼠气道和全身炎症的干预作用,为临床治疗提供实验依据,现报道如下。
1 材料与方法
1.1 实验材料
MasterScreen PFT System肺功能仪(德国耶格公司);自制有机玻璃熏烟箱(80 cm×40 cm×50 cm);新津事丰一次性无菌注射器(成都市新津事丰医疗器械有限公司);PL2000PLUS血气生化分析仪(北京普朗医疗);BL-420S生物机能实验系统(成都泰盟科技有限公司);HX200呼吸流量换能器(上海益联医学仪器发展有限公司);CUT6062石蜡切片机(德国SLEE公司)。
1.2 药品与试剂
舒血宁注射液(山西太原药业有限公司,国药准字:Z14021962,每支5 mL,折合GBE为175 mg,含总黄酮醇苷42 mg、银杏内酯70 mg);“红双喜”牌香烟(上海烟草集团有限责任公司);脂多糖(Sigma-L2880,美国Sigma公司);注射用乳糖酸红霉素(广西梧州制药(集团)股份有限公司,国药准字:H45021339);CRP、IL-1、IL-8 检测试剂盒(美国R&D公司)。
1.3 实验方法
1.3.1 分组方法
健康清洁级SD大鼠60只,体质量(210±20)g,由省动物实验中心提供。所有大鼠分笼饲养,由专人负责管理。实验室定期消毒,环境温度20 ℃~25 ℃,相对湿度50%~70%。饲养1周后开始实验。所有大鼠称重后随机分为A、B、C、D共4组,每组各15只。A组15只大鼠为正常对照组,B、C、D组共45只大鼠通过香烟熏吸加气道内注入脂多糖(Lipopolysaccharide,LPS)方法建立大鼠COPD模型,B组为COPD对照组,C组为GBE干预组,D组为红霉素干预组。
1.3.2 COPD模型建立方法
所有COPD大鼠模型均由香烟熏吸联合气道内注入脂多糖的方法进行造模[5]。香烟熏吸:上午在自制有机玻璃熏烟箱内给予4根香烟熏吸,每次时间为30 min,结束后将大鼠转移至实验室正常环境内饲养。脂多糖气管注入:于实验第1天和第14天使用10%水合氯醛,按照100 g/0.25 mL的剂量腹腔注射麻醉后,取仰卧位固定于固定板上,暴露声门,静脉套管针插入气道,快速注入100 μL LPS(1 mg/mL),直立固定板并旋转,尽可能的使LPS充分均匀的分布于大鼠两肺。造模共28 d,A 组于第 1 天和第 14 天气管内注入2 mL/kg生理盐水,B、C、D组除第1天和第14天LPS气管注入外,其余时间均进行香烟熏吸。28 d后对大鼠肺功能进行检测:分别将三通管和呼吸流量换能器连接在Y型气管插管的两端,首先记录一段平静呼吸曲线,然后在呼吸末使用注射器在三通管段内快速注入6 mL空气,立即脱开后自然呼出,使用BL-420S生物机能实验系统记录呼吸曲线并计算0.3 s用力呼气容积(FEV0.3)及大鼠FEV0.3占用力肺活量百分比(FEV0.3/FVC)。B、C、D组各取两只大鼠处死,迅速取出完成肺组织,生理盐水冲洗干净后将肺部组织放入10%的福尔马林液中固定24 h后,乙醇及正丁醇脱水,石蜡包埋,切片,HE染色。使用光学显微镜下观察肺组织改变,若出现肺泡壁变薄、断裂,肺组织结构破坏,支气管黏膜变性、坏死,伴有炎性细胞浸润,或肺气肿病理改变等符合COPD表现,结合肺功能下降即可说明COPD造模成功。
1.3.3 给药方法
所有大鼠均为腹腔注射给药,A、B组给予生理盐水0.4mL/(kg·d),C组给予GBE 0.4 mL/(kg·d),D组根据体表面积换算方法为100 mg/kg2给予红霉素。所有疗程均为2周。
1.3.4 肺泡灌洗方法
使用10%水合氯醛将大鼠麻醉,器官插管,四肢固定于固定板,打开胸腔,充分暴露肺部,结扎左侧肺门。分离大鼠颈部气管,并在气管下端横切一小切口,缓慢插入气管插管。若有轻微阻滞的感觉则表明气管插管达到隆突部位,需要略微旋转退回一部分插管,结扎完成插管。将事先备好的5 mL注射器吸取2 mL生理盐水缓慢注入大鼠右肺进行灌洗,在适宜的时机缓慢抽回灌洗液,再将抽回的灌洗液缓慢注入,重复3次直到带有泡沫的微混液体流出表示1次灌洗成功。
1.4 观察指标
1)血清CRP、IL-1、IL-8:治疗完成后抽取动脉血1 mL,静置30 min后离心分离血清,采用酶联免疫吸附试验法(ELISA)检测CRP、IL-1、IL-8含量,所有步骤均严格按照试剂盒操作流程。2)肺组织CRP、IL-1、IL-8:治疗完成后按照上述肺泡灌洗方法灌洗大鼠肺部,重复灌洗3次,每次回收灌洗液1.5 mL,共回收所需的4.5 mL肺支气管肺泡灌洗液(BALF)置于离心管,震荡5 min,静置12 h后离心分离取上相液后待检,采用ELISA检测CRP、IL-1、IL-8含量。
1.5 统计学方法

2 结果
2.1 血清和肺组织CRP水平比较
B、C、D组血清和肺组织CRP水平均明显高于A组(P<0.05);C、D组血清和肺组织CRP水平相较B组有明显降低(P<0.05),其中C、D组两组相较差异无统计学意义(P>0.05),见表1。
2.2 血清和肺组织IL-1水平比较
B、C、D组血清和肺组织IL-1水平均明显高于A组(P<0.05);C、D组血清和肺组织IL-1水平相较B组有明显降低(P<0.05),其中C、D组两组相较差异无统计学意义(P>0.05),见表2。


组别例数血清BALFA组131.10±0.32b1.98±0.21bB组132.97±0.48a2.99±0.27aC组131.47±0.35abc2.27±0.24abcD组131.56±0.46ab2.31±0.21abF52.57743.502P<0.001<0.001
注:与A组比较,aP<0.05;与B组比较,bP<0.05;与D组比较,cP>0.05。


组别例数血清BALFA组1364.52±25.31b38.91±15.28bB组13118.73±50.62a74.65±30.31aC组1368.53±28.75abc39.51±16.37abcD组1371.62±27.46abc41.25±18.20abcF7.0248.998P0.001<0.001
注:与A组比较,aP<0.05;与B组比较,bP<0.05;与D组比较,cP>0.05。
2.3 血清和肺组织IL-8水平比较
B、C、D组血清和肺组织IL-8水平均明显高于A组(P<0.05);C、D组血清和肺组织IL-8水平相较B组有明显降低(P<0.05),其中C、D组两组相较差异无统计学意义(P>0.05),见表3。
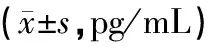
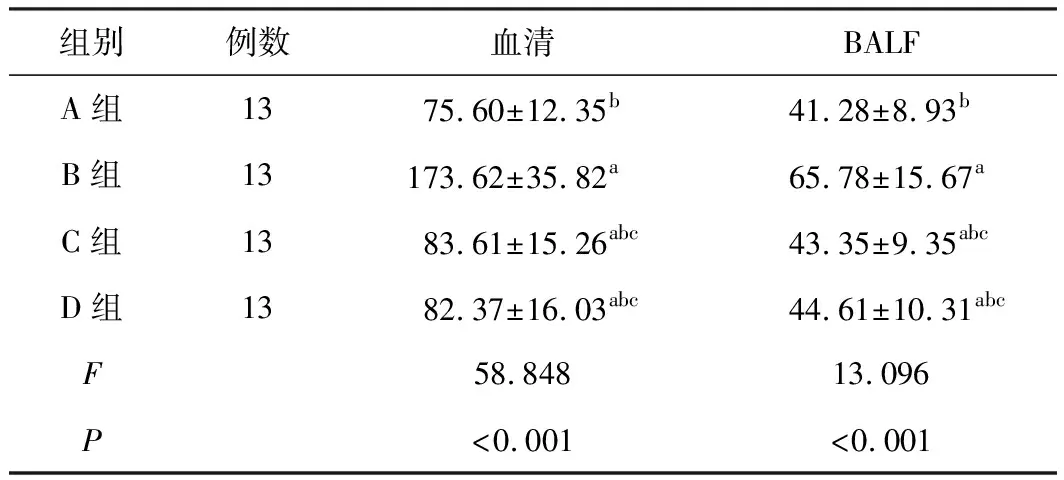
组别例数血清BALFA组1375.60±12.35b41.28±8.93bB组13173.62±35.82a65.78±15.67aC组1383.61±15.26abc43.35±9.35abcD组1382.37±16.03abc44.61±10.31abcF58.84813.096P<0.001<0.001
注:与A组比较,aP<0.05;与B组比较,bP<0.05;与D组比较,cP>0.05。
3 讨论
COPD是临床常见疾病,具有发病率高、复发率高、死亡率高“三高”的特点,其主要表现为气流受限、肺功能下降,对患者的生活质量造成严重影响,同时也带来巨大的经济和精神负担。随着环境的不断恶化和吸烟人群的不断上升,COPD的发病率呈现明显的上升趋势。积极探索COPD病理和发病机制,研究有效的辅助治疗药物提高该病的临床治疗效果和预后十分必要。COPD是一种可预防和治疗的疾病,但目前未证实有药物能够显著改善患者肺功能长期下降的趋势,对于COPD急性发作的患者,其治疗目标是尽可能的降低急性发作对患者造成的影响并预防再次急性发作。研究证实,COPD的发病机制主要包括炎症反应、氧化应激、蛋白酶-抗蛋白酶失衡及细胞凋亡等多个方面[6]。炎症介质和细胞因子在COPD的发生和发展中起到重要作用,故而抑制炎症反应是COPD治疗中的重要环节。COPD患者体内血液处于高凝状态,长期血液高凝状态极易形成微血栓,加速COPD的进展。因此在常规治疗的基础上配合抗凝、抗感染等综合治疗措施具有非常明显的作用。近年来研究发现,GBE对改善血液高凝状态、降低肺动脉压及肺血管阻力具有明显的作用[7],但其在呼吸系统疾病中的研究不多见,故而本次实验通过观察GBE对COPD大鼠血清和肺组织炎性介质的影响,探讨其可能的作用机制,为COPD的治疗和预防提供实验依据。
吸烟、环境暴露和有机粉尘是COPD的主要致病因素[8]。鉴于此,本次研究采用香烟熏吸联合气道内注入脂多糖的方法造模。结果显示该方法可导致与COPD 相同的病理生理学改变。COPD患者气道管腔及管壁内存在大量的炎症细胞,有研究发现其水平与COPD症状严重程度呈一定的正相关性[9]。CRP是临床上最常用的炎症反应标志物之一,其具有激活补体,促进炎症吸收等功能[10],对COPD慢性炎症的敏感度很高。当机体发生炎症反应、组织损伤、恶性肿瘤时,CRP水平显著升高,其血清浓度上升速度与炎症反应的范围及程度具有正相关性。血清CRP水平可以反应COPD患者气道炎症程度,持续高水平的CRP会及你不造成气道上皮功能的损伤,影响患者肺功能。IL-1一般存在于血液和组织中,主要有单核巨噬细胞产生,分为IL-1α和IL-1β两型。IL-8也由单核巨噬细胞产生,能够促使中性细胞粒活化、迁移、释放炎性介质,直接对组织产生损害。因IL-11β能够激发靶细胞内NF-кB信号通路,诱导IL-8的释放[11],可将IL-1β和IL-8纳入同一反应链中。IL-1和IL-8在COPD病情的发展中发挥着重要的作用。本次研究显示,B组(COPD对照组)大鼠血清和肺组织中CRP、IL-1、IL-8均明显高于A组(正常对照组),与其他学者研究结果基本一致[12]。红霉素能够减轻COPD患者气道炎症反应已成为普遍认识,因此本次研究以红霉素作为干预对照组与GBE组的干预效果形成对照。本次研究结果显示,C组(GBE干预组)和D组(红霉素干预组)大鼠血清和肺组织中CRP、IL-1、IL-8均比B组有明显的降低(P<0.05),且C组和D组差异无统计学意义(P>0.05),表明GBE与红霉素干预效果相当,能够有效抑制COPD气道及全身炎症反应,进一步证明了GBE对COPD的辅助治疗作用。
GBE主要由黄酮类、萜类内酯化合物等组成,其中银杏内脂是其中最重要的成分。血小板活化因子会导致炎症细胞向气道迁移、活化并释放炎性介质和细胞因子,同时释放的炎性介质和细胞因子又能够增加血小板活化因子的合成[12]。因此抑制血小板活化因子的合成是治疗的重要部分。银杏内脂具有选择性抗拮抗血小板活化因子的功能,作为血小板活化因子受体抗结剂,GBE可以直接对气道炎症细胞的聚集、活化进行抑制[13],从而降低炎症介质和细胞因子的释放,降低气道炎症反应[14-15]。与此同时,炎性介质和细胞因子释放的有效抑制也降低血小板活化因子的合成,进一步提高GBE的抗炎效果。
随着国内外对GBE的化学成分及作用机制的研究不断深入,对其药用价值有了更深的了解和重视。GBE的成分决定具有多靶点综合治疗作用,副作用小,应用前景广泛[16]。但是GBE主要成分的药动力学特征受到物质本身理化性质及机体胃肠道环境的限制,口服GBE生理不用率不高[17]。在人体内GBE药动力学研究,尤其是对吸收、分布、代谢等环节更加细致的研究尚显薄弱。加上这方面的研究对GBE药理作用的实质能够有更加深入的了解,以便于指导临床合理用药、试剂改革、新药研究。
综上所述,GBE能够抑制COPD大鼠气道和全身炎症反应,可能是通过降低血清及肺组织中CRP、IL-1、IL-8水平来实现。GBE具有抗变态反应、减轻气道炎症、提高机体免疫力等综合治疗作用,能够广泛应用于治疗和预防呼吸系统疾病。
