miR-592靶向Cep135调控小鼠胚胎干细胞自我更新及分化
2019-11-12白振东李培昕张宁彦
白振东, 李培昕, 张宁彦, 程 健, 张 敬, 张 军
(1. 同济大学医学院,上海 200092; 2. 同济大学生命科学与技术学院, 上海 200092)
胚胎干细胞(embryonic stem cells, ESCs)是最为原始的干细胞,来源于哺乳动物囊胚的内细胞团。目前,理论上认为ESCs具有自我更新和分化成所有主要细胞系的能力[1],因此,ESCs具有广泛的应用前景。ESCs的自我更新能力是受到严格调控的,Oct4、Sox2和Nanog被认为是多能性调控网络的关键因子[2]。Sympk能够与Oct4相互作用,进而促进ESCs的自我更新和多能性[3],而Sox2在ESCs自我更新过程中也发挥了重要的作用,并且它是产生可诱导多能干细胞的必要因素[4]。此外,Nanog能够与Oct4和Sox2协同作用,以调控ESCs的全能性[5]。
microRNA(miRNA)是一种大小为20~25个碱基的非编码小分子RNA。越来越多的研究表明,miRNA参与了干细胞特性的调控[6-7]。miRNA在干细胞自我更新、分化、信号转导和代谢凋亡等一系列的生理活动中发挥了关键的调控作用[8-10]。已有研究表明,miR-294/miR-302能够促进ESCs的增殖,抑制其分化[11]。而miR-592通过抑制胶质细胞的形成,从而促进神经干细胞向神经元的分化[12],其在ESCs自我更新及分化过程中可能也发挥了一定的调控作用。本研究以KO-miR-592 mESCs及正常mESCs为工具细胞,利用qRT-PCR及Western印迹法分析miR-592调控相关基因,从而在mESCs自我更新和分化过程中的作用。
1 材料与方法
1.1 细胞培养及细胞转染
小鼠胚胎干细胞(mESCs)细胞株由同济大学医学院薛志刚教授赠予;敲除miR-592的mESCs细胞株(KO-miR-592 mESCs)购于美国加州大学戴维斯分校;mESCs培养基成分为DMEM、15% FBS、GlutaMAX、NEAA、LIF及β-Mercaptoetanol。在37℃、5% CO2的培养箱中进行培养。将5×105个mESCs接种在含有滋养层细胞的6孔培养板中,当细胞融合度达到30%~50%时,采用XfectTMRNA转染试剂(Clontech)将表达质粒转染至mESCs中。
1.2 免疫细胞化学
吸除培养液,使用PBS溶液进行清洗。加入4%的多聚甲醛,以固定细胞。去除多聚甲醛后,使用PBS进行清洗。将封闭液加入细胞中,以进行封闭。随后加入一抗,在4℃下孵育过夜。回收一抗后,用PBS缓慢清洗。随后封闭液清洗2次,封闭30min。加入二抗,在黑暗条件下孵育2h。回收二抗,使用DAPI进行染色,在37℃黑暗下孵育15min。在荧光显微镜下进行观察,并拍照。
1.3 qRT-PCR检测
使用TRIzol试剂裂解细胞,进而从细胞中提取总RNA,随后测定RNA的浓度。借助RNA反转录试剂盒(TaKaRa公司),将RNA反转录成cDNA,随后进行qRT-PCR检测。采用两步法进行PCR扩增,95℃ 5s变性,60℃ 34s退火延伸,循环40次。
1.4 Western印迹法分析
在细胞中加入蛋白裂解液,以裂解细胞,提取细胞蛋白,利用BCA法测定细胞蛋白浓度。制备蛋白样品,配制电泳分离胶和浓缩胶,上样并进行电泳,转膜完成后进行封闭,在4℃冰箱里孵育一抗过夜。使用TBST溶液清洗3次,加入二抗,在室温黑暗条件下放置50min。回收二抗,再用TBST溶液清洗3次。最后,使用Odyssey红外成像仪显色,并进行蛋白条带的灰度值分析。
1.5 pSuper-miR-592及pSuper-miR-592 mut质粒构建
根据miR-592前体序列和pSuper-EGFP1质粒酶切位点设计PCR引物,具体如下。上游引物: 5′-GCGGATCCAGTTTCCAGAACACCCAGAT-3′;下游引物: 5′-GCAAGCTTAAAAAACGCACAAGC-ACGTCATAGA-3′。扩增完成后,将PCR产物插入pSuper-EGFP1质粒的BamHⅠ/HindⅢ酶切位点,进而构建pSuper-miR-592质粒。利用QuikChange Ⅱ Site-Directed Mutagenesis Kit(Stratagene)构建miR-592种子区突变的表达质粒pSuper-miR-592 mut。将pSuper-EGFP1质粒用作转染实验的内部对照。
1.6 双荧光素酶报告基因实验
扩增miR-592与靶基因结合位点的序列片段,进而插入萤火虫荧光素酶报告基因载体pGL3-Control中,以构建重组质粒。随后,将海肾荧光素酶报告基因载体pRL-TK,与上述重组质粒及pSuper-EGFP1或pSuper-miR-592或pSuper-miR-592 mut质粒共转染进293T细胞中。转染48h后,进行双荧光素酶检测,分别检测各组中萤火虫荧光素酶和海肾荧光素酶活性,以分析荧光素酶活性。
1.7 统计学处理
2 结 果
2.1 小鼠胚胎干细胞全能性的鉴定
将mESCs和KO-miR-592 mESCs进行免疫细胞化学染色,以鉴定其全能性,结果显示两组细胞中全能性相关基因Nanog、Sox-2及Oct-4均高表达(图1),表明实验使用的mESCs及KO-miR592 mESCs均处于未分化状态,具有全能性。

图1 小鼠胚胎干细胞免疫细胞化学染色(×100)Fig.1 Immunocytochemical staining of mouse embryonic stem cells(×100)
2.2 qRT-PCR分析miR-592对mESCs分化的影响
设立正常mESCs组、过表达miR-592 mESCs组及KO-miR-592 mESCs组,qRT-PCR检测结果显示,与正常mESCs相比,过表达miR-592组中miR-592表达量显著增加(P<0.05),而KO-miR-592 mESCs组中miR-592的表达水平显著下调(图2A,P<0.01)。与此同时,通过qRT-PCR技术分析了3组细胞中内胚层标志性基因AFP和GATA6,中胚层标志性基因α-SMA和Brachyury及外胚层标志性基因Nestin和Neurofilament在mRNA水平的表达变化。实验结果显示,与正常mESCs组相比,过表达miR-592组外胚层标志物Neurofilament表达量显著上调(P<0.05),Nestin的表达水平有上调的趋势,而AFP、GATA6及α-SMA的表达则显著下调(图2B,P<0.05)。而在KO-miR-592 mESCs组中结果则相反,与对照组相比,KO-miR-592 mESCs组中Neurofilament和Nestin的表达均显著下降(P<0.05),而AFP和GATA6的表达则显著增加(图2B,P<0.05),说明过表达miR-592能够促进mESCs向外胚层的分化,特别是神经方向。
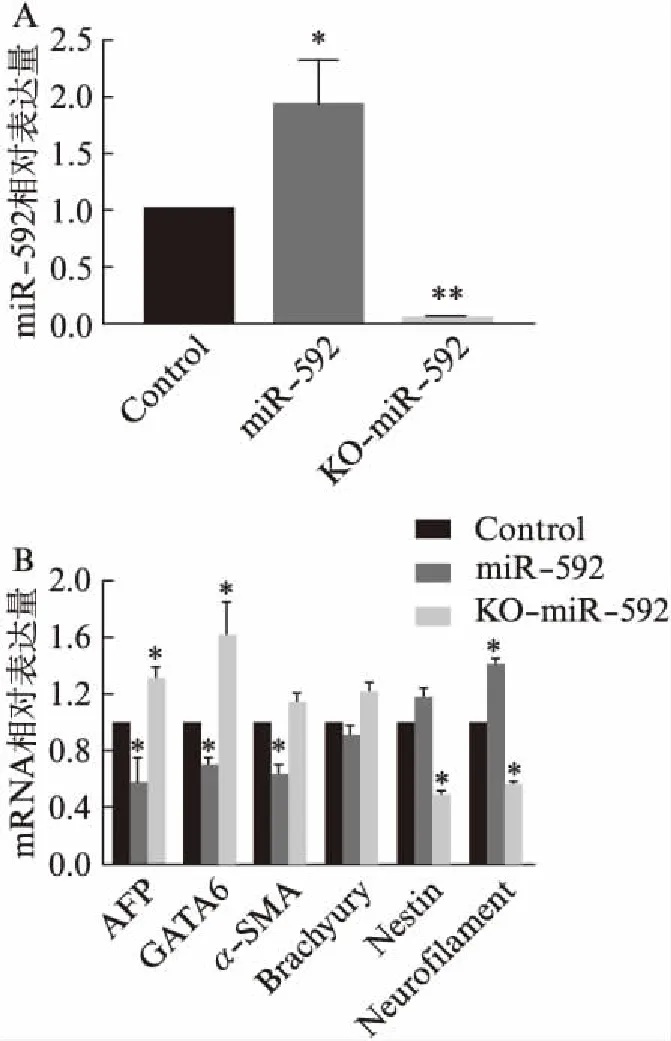
图2 qRT-PCR检测不同实验组中miR-592及三胚层 分化标志性基因的表达情况Fig.2 Detection of miR-592 and three germ layer differentiation marker genes in different experimental groups by qRT-PCRA: miR-592表达水平;B: 三胚层分化标志性基因表达水平;与对照组相比,*P<0.05,**P<0.01
2.3 Western印迹法验证miR-592对mESCs分化的影响
通过Western印迹法,在蛋白水平上验证miR-592对mESCs分化的影响。与对照组相比,过表达miR-592组外胚层标志蛋白Nestin的表达量显著增加(P<0.05),而内/中胚层标志蛋白AFP及α-SMA的表达均显著降低(图3,P<0.05)。而与正常对照组相比,KO-miR-592 mESCs组中Nestin的表达水平显著降低(P<0.05),AFP和α-SMA的表达则显著升高(图3,P<0.05)。蛋白水平上的检测结果与mRNA水平上的实验结果相一致,说明过表达miR-592能够促进mESCs向外胚层方向的分化,而敲除miR-592的mESCs则更倾向于向内/中胚层方向分化。
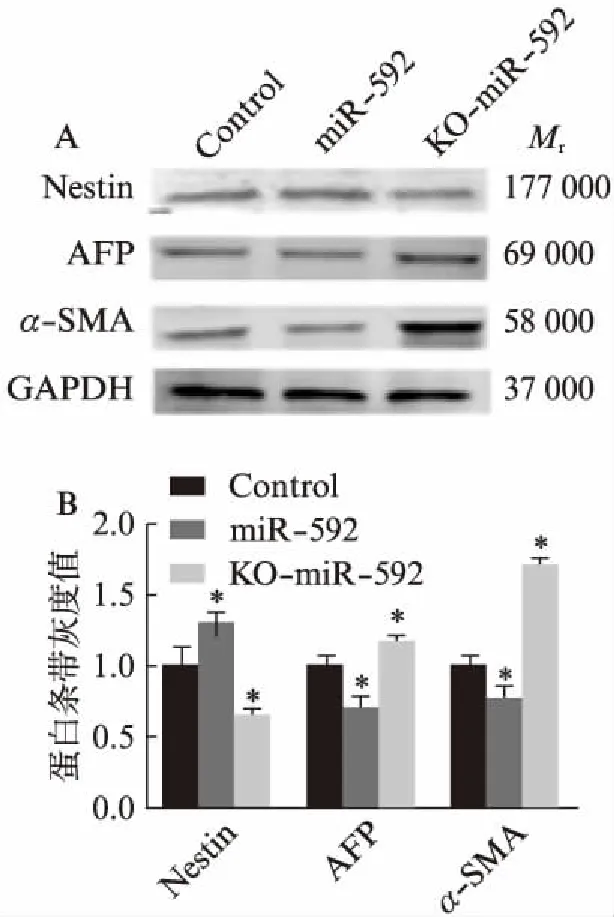
图3 Western印迹法检测不同实验组中 三胚层标志蛋白的表达情况Fig.3 Detection of the expression of the three germ layer marker proteins in different experimental groups by Western blottingA: Western印迹法;B: 蛋白表达的灰度分析;与对照组相比,*P<0.05
2.4 生物信息学预测miR-592作用的靶基因
利用TargetScan生物信息数据库(http:∥www.targetscan.org/vert_71/)预测miR-592作用的靶基因,结果显示Cep135为miR-592作用的潜在靶基因(图4),而且已有研究发现Cep135与胚胎干细胞的自我更新紧密相关[13]。

图4 利用TargetScan数据库分析miR-592作用的靶基因Fig.4 Analysis of miR-592 target gene with TargetScan database
2.5 双荧光素酶报告实验验证miR-592作用的靶基因
为了进一步验证Cep135是否为miR-592作用的靶基因,运用双荧光素酶报告基因系统进行分析。根据预测的Cep135与miR-592结合位点设计引物,并将包含miR-592结合位点的PCR扩增产物插入pGL3-Control载体,以构建pGL3-Control-3′UTR Cep135重组质粒。将该重组质粒和pRL-TK质粒,分别与pSuper-EGFP1或pSuper-miR-592或pSuper-miR-592 mut质粒共转染至293T细胞中,以设立对照组、miR-592组和miR-592 mut组,转染48h后,进行双荧光素酶活性检测。结果显示,与对照组相比,miR-592组中荧光素酶活性显著降低(图5,P<0.05),进而证实Cep135是miR-592作用的靶基因。此外,利用Western印迹法检测不同实验组中Cep135蛋白的表达变化。结果显示,与对照组相比,miR-592组中Cep135蛋白表达显著下调(图6,P<0.05),进一步说明miR-592能够靶向抑制Cep135的表达。
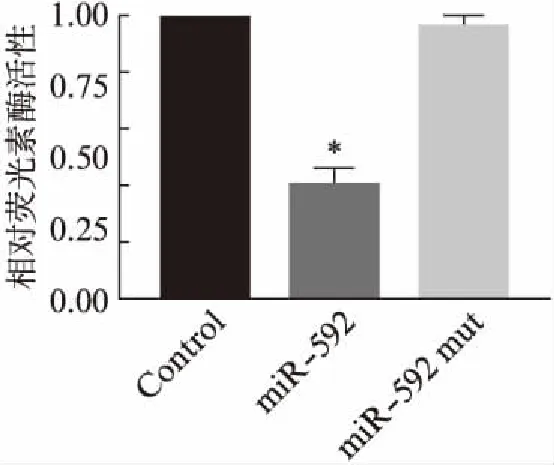
图5 miR-592与Cep135 3′UTR相互作用Fig.5 The interaction between miR-592 and 3′ UTR of Cep135 与对照组相比,*P<0.05
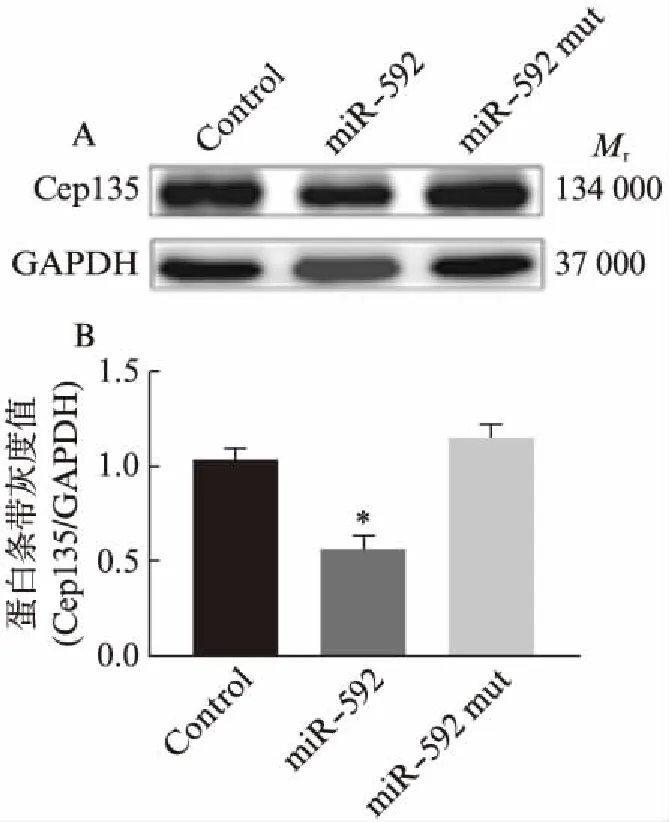
图6 Western印迹法检测miR-592转染后 细胞中Cep135的表达变化Fig.6 Detection of the expression of Cep135 after miR-592 transfection by Western blottingA: Western印迹法;B: 蛋白表达的灰度分析;与对照组相比,*P<0.05
2.6 Cep135对mESCs自我更新的影响
Cep135基因能够编码中心体蛋白,且与干细胞的自我更新密切相关。在mESCs中干扰Cep135或过表达Cep135,以探究Cep135对mESCs自我更新能力的影响。Western印迹法实验结果显示,干扰Cep135的表达后,mESCs中Oct-4、Sox-2和Naong 3种干性标志物的表达均显著降低(P<0.05),而过表达Cep135后,3种蛋白的表达水平则显著增加(图7,P<0.05),表明过表达Cep135能够促进mESCs的自我更新。

图7 Western印迹法检测Cep135转染后细胞中 自我更新关键因子的表达情况Fig.7 Detection of the expression of key factors of self- renewal after Cep135 transfection by Western blottingA: Western印迹法;B: 蛋白表达的灰度分析;与对照组相比,*P<0.05
2.7 miR-592靶向Cep135以抑制mESCs的自我更新
利用Western印迹法分析miR-592在mESCs自我更新过程中所发挥的作用。结果显示,与对照组相比,在mESCs中过表达miR-592促使Oct-4、Sox-2和Naong的表达量显著降低(图8,P<0.05)。而当同时上调miR-592和Cep135的表达时,与过表达miR-592组相比,Oct-4、Sox-2和Naong的表达水平有所恢复(图8)。此外,本研究已经证明Cep135是miR-592作用的靶基因,且Cep135能够促进mESCs的自我更新,说明miR-592可能通过靶向下调Cep135的表达,以抑制mESCs的自我更新,进而促使mESCs向外胚层方向分化。
3 讨 论
胚胎干细胞自我更新及分化过程中具体调控机制的研究已然成为干细胞研究的热点,这也是ESCs被广泛应用于临床治疗的前提条件。目前已发现一些信号转导途径,转录因子等能够参与调节ESCs的自我更新和分化过程[14-15]。ESCs干性维持的相关信号通路包括Erk/Mapk、PI3K/Akt、Wnt/β-catenin及LIF/JAK/STAT3等[5,16],这些信号通路主要通过调节ESCs中关键转录因子(Oct4、Nanog、Sox2和c-Myc)的表达,从而发挥作用。此外,这些信号通路、转录因子能够与miRNA相互作用,进而形成一个调控ESCs自我更新与分化的分子调控网络。已报道miR-145抑制Sox2的表达,进而抑制人胚胎干细胞的自我更新[17]。而miR-221-3p和miR-221-5p均能够靶向Oct4、Nanog和Sox2,以抑制mESCs的多能性[18]。本研究发现在mESCs中miR-592通过调控Oct4、Sox2及Nanog的表达变化,进而抑制mESCs的自我更新。
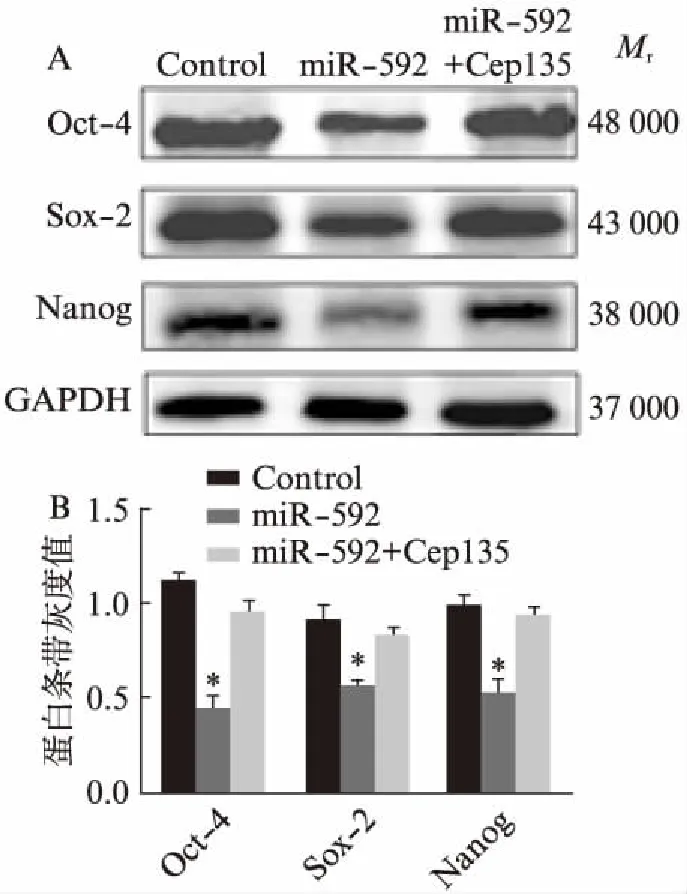
图8 Western印迹法检测miR-592转染后细胞中 自我更新关键因子的表达情况Fig.8 Detection of the expression of key factors of self- renewal after miR-592 transfection by Western blottingA: Western印迹法;B: 蛋白表达的灰度分析;与对照组相比,*P<0.05
关于miR-592具体通过作用下游哪些关键分子发挥调控作用一直是研究的热点。借助生物信息学技术和双荧光素酶报告实验,本研究证实Cep135为miR-592作用的靶基因。Cep135能够编码中心体蛋白,而中心体不对称性与干细胞的自我更新紧密有关[13]。此外,Cep135对于微管的形成也是必需的[19],进而在细胞分裂、细胞形态的维持及细胞的运动过程中发挥重要作用。本研究发现上调Cep135的表达能够促进mESCs的多能性,而miR-592能够靶向下调Cep135,从而抑制mESCs的自我更新,并促使mESCs向外胚层方向分化,特别是神经方向。与此同时,已有研究报道miR-592在大鼠脑组织中特异表达,而且其表达量在胚胎期逐渐增加,在胚胎期E18时达到最高峰[12,19]。这提示在胚胎期表达升高的miR-592可能通过调控胚胎干细胞的自我更新与分化,从而促进外胚层特别是神经系统的正常发育,进一步表明miR-592可能在神经发育过程中扮演了关键的角色,但关于miR-592在神经发育过程中发挥的具体调控作用和分子机制还有待进一步的研究。
另一方面,已有研究报道移植ESCs可用于神经退行性疾病的治疗研究[20],而部分miRNA在ESCs神经分化过程中发挥重要的调控作用[21],将此类miRNA与ESCs联合作用,进而能够改善中枢神经系统的治疗效果。通过进一步探索miR-592在ESCs自我更新和分化过程中的作用及分子机制,以调控miR-592的表达水平,促使ESCs向神经方向分化,进而改善移植ESCs的神经修复效果,为神经系统疾病的治疗提供新的策略。
综上所述,miR-592能够靶向下调Cep135的表达,以抑制mESCs的自我更新,进而促使其向外胚层方向分化,表明miR-592在mESCs自我更新和分化过程中发挥了关键的调控作用,而且提示miR-592与胚胎期神经系统的发育之间存在着一定的联系。
猜你喜欢
——一道江苏高考题的奥秘解读和拓展
