炎性相关因子诱导卵巢癌细胞增殖信号和蛋白酶表达的实验研究
2019-11-12艾贵海秦锦龙丁金晔程忠平
李 莉, 刘 洁, 艾贵海, 秦锦龙, 丁金晔, 程忠平
(同济大学附属第十人民医院妇产科,上海 200072)
卵巢癌是女性生殖系统常见的恶性肿瘤之一,也是导致妇女癌症相关性死亡的第5大原因[1]。尽管经过基础研究和临床研究多年来的共同努力,卵巢癌的5年生存率仍然徘徊在25%~30%,是致死率最高且预后最差的妇科恶性肿瘤,严重威胁着女性生命的健康[2]。然而,对于卵巢癌的病理发生机制至今尚未明确。
炎症是癌症的重要特征,越来越多的研究表明炎性微环境参与多种肿瘤的发生发展[3-4]。肿瘤微环境中存在大量免疫细胞浸润,特别是肿瘤相关中性粒细胞(tumor-associated neutrophils, TANs)和肿瘤相关巨噬细胞(tumor-associated macrophages, TAMs)。它们通过自分泌和旁分泌产生的炎性因子及趋化因子等激活炎性信号形成动态网络,同时激活多种细胞因子(TNF-α、IL-6、IL-8等)、趋化因子、蛋白水解酶(基质金属蛋白酶9、中性粒细胞蛋白酶、组织蛋白酶等)以及细胞表面受体(Toll样受体等),使细胞外基质的降解,刺激新生血管形成,调节细胞黏附,最终导致肿瘤细胞快速增殖、侵袭和转移[5-6]。
卵巢癌的起源及发生机制目前尚未明了。在转化医学和精准医学的医学背景下,探索炎性微环境与卵巢癌病理发生机制之间的联系,为卵巢癌的靶向治疗提供新的研究思路[7-8]。近年来,越来越多的研究表明卵巢癌的发生发展与炎性病理机制密切相关,并且几乎涉及卵巢肿瘤发展的各个阶段[9-10]。传统学说认为,卵巢排卵期间卵巢滤泡附近的上皮细胞广泛增殖、破坏和凋亡,导致卵泡壁的破裂损伤和随后重塑修复,最终导致潜在的炎症反应和细胞基因突变;据推测,卵巢排卵过程会引起氧化应激、增加炎性相关因子的浓度[11];还有研究表明卵巢癌的发生与输卵管起源和盆腔炎性疾病相关[12]。炎症及炎性介质与卵巢癌的发生、进展、转移、化学耐药及不良预后密切相关[13-15]。然而,炎性微环境中的炎性相关因子在卵巢癌发生发展的确切机制仍然不是很明确。
本实验旨在研究炎性相关因子(TLR4外源性配体LPS和经典炎性细胞因子TNF-α)对卵巢癌细胞炎性增殖增生信号的表达,以及与卵巢癌细胞侵袭转移相关的蛋白酶包括基质金属蛋白酶9(matrix meta-lloproteinase-9, MMP9)、中性粒细胞弹性蛋白酶(neutrophil elastase, NE)和组织蛋白酶G(cathepsin-G,Cath-G)的表达。探讨肿瘤微环境中的炎性相关因子对卵巢癌胞内信号及细胞生物学行为的影响。
1 材料与方法
1.1 材料及试剂
卵巢癌浆液性细胞系HEY购自美国标准培养收集所;TRIzol试剂购自美国Invitrogen公司;反转录试剂盒、SYBR Green PCR试剂盒及BCA蛋白定量试剂盒购自美国Thermo Fisher Scientific公司;异丙醇、无水乙醇及氯仿购自中国国药集团;脂多糖(LPS)购买于美国Sigma公司(L2630);Toll样受体4(Toll-like receptors 4, TLR4)拮抗剂VIPER(NBP2-26244)购自美国Novus公司;TNF-α购自美国Pepro Tech公司(300-01A),TNF-α拮抗剂GSK2982772购自美国Selleck公司(S8484);一抗: Anti-TLR4(ab13556)、Anti-TNF-α受体1(TNFR1,ab19139)、Anti-TNFR2(ab109322)、Anti-NF-κB/p65(ab16502)、Anti-MMP9(ab38898)、Anti-NE抗体(ab68672)和Anti-Cath-G抗体(ab231149)均购自美国Abcam公司;Anti-JNK(#9252)、Anti-p-JNK(#9251S)、Anti-p38(#8690)、Anti-p-p38(#9211)、Anti-ERK(#4695)、Anti-p-ERK(#4370)和Anti-GAPDH(#5174)均购自美国Cell Signaling Technology公司。辣根过氧化物酶(horseradish peroxidase, HRP)标记二抗购自上海碧云天公司;MMP9(XY-E11105)和NE(XY-E11079)ELISA试剂盒购自上海信裕生物科技公司;Cath-G的ELISA试剂盒(IC-CTSG-Hu)购自美国ImmunoClone公司。
1.2 细胞培养和处理
浆液性卵巢癌细胞系HEY采用RPMI-1640培养液培养。完全培养液中含10%的胎牛血清(FBS),100U/mL青霉素和100μg/mL链霉素。细胞系置于37℃、5% CO2的孵箱中培养。观察细胞的生长状态和密度,待卵巢癌细胞融合度达到70%~80%,按照1∶3的比例进行细胞传代。参考以往文献选择10ng/mL的LPS刺激卵巢癌细胞48h,2.5ng/mL的TNF-α处理细胞24h,设置该组为刺激组;采用10ng/mL的LPS加200nmol/L TLR4拮抗剂VIPER、2.5ng/mL的TNF-α加1nmol/L TNF-α拮抗剂处理细胞,该组为拮抗剂组;采用的培养液加入细胞中培养相同时间该组为对照组。于100倍光学显微镜下分别记录刺激组、拮抗剂组和对照组的细胞生长情况。
1.3 方法
1.3.1 RNA的提取和real-time PCR 采用TRIzol提取细胞总RNA,测定RNA的浓度和纯度,随后采用反转录试剂盒合成cDNA,使用SYBR Green PCR试剂盒进行PCR扩增。Real-time PCR反应根据以下条件扩增: 95℃ 10min,95℃ 15s,60℃ 45s,共40个循环。Real-time PCR引物见表1。采用ABI Prism 7300 SDS Software进行数据分析。以GAPDH为内参比较目的基因的表达高低。

表1 Real-time PCR的引物
1.3.2 Western印迹法 分别收集3组细胞,加入RIPA裂解液,4℃,12000r/min,离心半径8cm,离心15min,抽提蛋白并用BCA试剂进行蛋白定量后储存于-80℃的冰箱中。将样品中的蛋白煮沸变性5min后,按15μL/孔蛋白量上样,随后将10% SDS-PAGE电泳后转至硝酸纤维素膜(NC膜)上。5%脱脂奶粉(检测磷酸化蛋白用BSA)室温封闭1h后加入相应的一抗Anti-TLR4(1∶500)、Anti-TNFR1(1∶1000)、Anti-TNFR2(1∶1000)、Anti-NF-κB/p65(1∶1000)、Anti-JNK(1∶1000)、Anti-p-JNK(1∶1000)、Anti-p38(1∶1000)、Anti-p-p38(1∶1000)、Anti-ERK(1∶1000)、p-ERK(1∶1000)、Anti-MMP9(1∶500)、Anti-NE(1∶500)、Anti-Cath-G(1∶500)和Anti-GAPDH(1∶2000),置于4℃冰箱过夜。洗涤后加入二抗(1∶1000),室温封闭1h后,采用化学发光法(enhanced chemiluminescence, ECL)显影,并使用Tanon-5200成像系统测定条带灰度值。
1.3.3 ELISA 分别收集3组细胞培养上清液,按照MMP9、NE和Cath-G的ELISA试剂盒的说明书操作,用酶标仪检测上清液中MMP9、NE和Cath-G在450nm波长处各孔的去密度值(D450)。根据MMP9、NE和Cath-G的标准曲线及各孔去密度值计算每孔相应的浓度。
1.4 统计学方法

2 结 果
2.1 炎性相关因子LPS和TNF-α刺激卵巢癌细胞增殖信号mRNA的表达及蛋白的激活
采用real-time PCR检测LPS和TNF-α刺激细胞增殖信号mRNA的表达,结果显示: 与对照组比较,在经10ng/mL的LPS处理48h的卵巢癌细胞和2.5ng/mL的TNF-α处理24h的卵巢癌细胞中,炎性因子在促进自身受体(TLR4、TNFR1、TNFR2)mRNA表达的同时还诱导炎性增殖信号(JNK、ERK、p38、NF-κB/p65)的表达(P<0.01),并且该增殖信号应答可分别被LPS受体拮抗剂和TNF-α受体拮抗剂所抑制(P<0.01),见图1A、图1B。Western印迹法结果显示: 与对照组相比,在LPS和TNF-α处理卵巢癌细胞中,LPS和TNF-α的相应受体以及增殖信号蛋白p-JNK1/2、p-p38、p-ERK1/2、NF-κB/p65的表达增加,而JNK1/2、p-38、ERK1/2的蛋白表达无明显变化,见图1C、图1D。此外,于100倍光镜下分别记录3组细胞生长情况,结果显示,炎性相关因子LPS和TNF-α明显刺激卵巢癌细胞增殖,见图2。
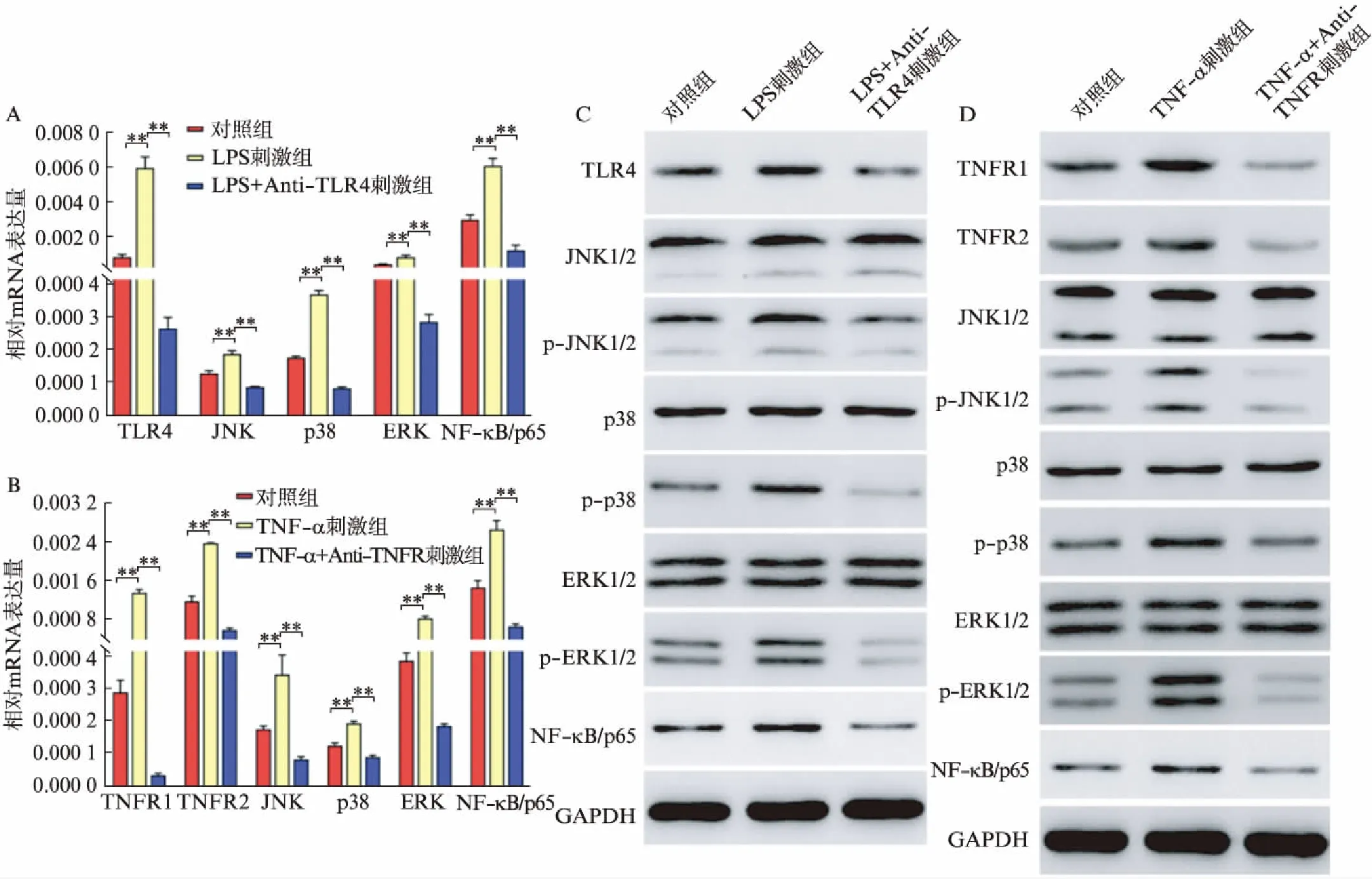
图1 LPS和TNF-α对卵巢癌细胞中增殖信号mRNA及蛋白的影响Fig.1 The effect of LPS and TNF-α on the expression of cell proliferation signal mRNA and protein in ovarian cancer cells 与对照组及添加拮抗剂组比较,**P<0.01

图2 LPS和TNF-α对卵巢癌细胞增殖的影响Fig.2 The effect of LPS and TNF-α on cell proliferation in ovarian cancer cells
2.2 炎性相关因子LPS和TNF-α刺激卵巢癌细胞蛋白酶mRNA及蛋白的表达
分别采用real-time PCR、Western印迹法及ELISA检测炎性相关因子LPS和TNF-α刺激卵巢癌细胞蛋白酶MMP9、NE和Cath-G的mRNA及蛋白的表达。结果显示: 与对照组比较,LPS和TNF-α刺激卵巢癌细胞蛋白酶(MMP9、NE和Cath-G)的mRNA及蛋白(包括细胞和上清液中的蛋白酶蛋白)的表达,该侵袭转移信号可分别被LPS和TNF-α受体拮抗剂所抑制,见图3。
3 讨 论
炎症是肿瘤公认的标志性特征,越来越多的研究表明慢性炎症形成的肿瘤炎性微环境参与肿瘤的起始和进展。在肿瘤微环境中,慢性迁延的炎症状态被形象的描述为“smouldering”,即“闷燃”或“闷烧”状态[16]。局部免疫反应和全身性炎症反应通过复杂的相互作用与肿瘤的进展及患者的生存预后密切相关[17]。慢性炎症通过诱导基因不稳定性和基因突变、组织异常修复、细胞增殖、侵袭、转移等生物学效应与肿瘤的发生发展密切相关;并且全世界癌症患者中高达20%的病例与微生物感染相关[18-19]。此外,肿瘤细胞外基质中涉及肿瘤细胞侵袭转移的蛋白水解包括尿激酶纤维蛋白溶酶原激活剂复合物、基质金属蛋白酶以及组织蛋白酶等在肿瘤中作为预后标志物具有一定的临床价值[20]。新近,越来越多的研究表明炎症参与卵巢癌潜在的生物学机制[21]。然而关于炎性相关疾病与卵巢癌发生风险的关联仍然不确定。

图3 LPS和TNF-α对卵巢癌细胞中蛋白酶mRNA及蛋白的影响Fig.3 The effect of LPS and TNF-α on the expression of proteases mRNA and protein in ovarian cancer cellsLPS、TNF-α刺激后,卵巢癌细胞中蛋白酶(MMP9、NE、Cath-G)mRNA(A、B),蛋白(C、D)的表达及细胞上清液中的蛋白酶的表达(E、F);与对照组及添加拮抗剂组比较,P>0.05(ns),**P<0.01
尚未有报道采用LPS刺激卵巢癌细胞观察LPS对卵巢癌细胞的影响,因此,本研究选择TLR4外源性配体LPS和经典细胞因子TNF-α刺激卵巢癌细胞,并通过real-time PCR、Western印迹法和ELISA检测结果进行分析,证明了炎性相关因子LPS诱导卵巢癌细胞炎性增殖信号(JNK、ERK、p38、NF-κB/p65)的激活,并促进及肿瘤细胞侵袭相关的蛋白酶(MMP9、NE、Cat-G)表达。本课题组前期研究发现,用TLR4外源性配体LPS刺激子宫肌瘤基质成纤维细胞和子宫腺肌病间质细胞能够活化TLR4/NF-κB/p65信号途径,促进实验细胞的炎性增殖并获得侵袭表型[22-23]。本研究结果初步从细胞信号层面佐证了炎性相关因子LPS刺激能够导致卵巢癌细胞表面受体TLR4表达增多,同时激活炎性增殖信号(JNK、ERK、p38、NF-κB/p65)及与侵袭转移相关的蛋白酶(MMP9、NE、Cat-G)的表达,且此效应可被TLR4受体拮抗剂所抑制。
本研究结果与之前的研究报道相类似。LPS作为TLR4信号的激活因子,通过激活NF-κB/p65信号通路在TLR4信号适应蛋白MyD88的介导下,参与上皮性卵巢癌的炎性微环境和上皮性卵巢癌的化学耐药[24]。Li等[25]采用组织化学染色研究500多名上皮性卵巢癌患者肿瘤中TLR4和MyD88相关标志物的表达,证明在上皮性卵巢癌的TLR4和MyD88高表达以及激活NF-κB/p65信号途径,提示TLR4/MyD88/NF-κB/p65信号转导可能导致炎性微环境的驱动上皮性卵巢癌患者侵袭性表型和不良的临床结果。同时,有研究发现TLR4外源性配体LPS刺激免疫细胞激活细胞内MAPKs信号(包括ERK、p38、JNK等),进一步诱导TLR4、细胞因子(TNF-α、IL-6、IL-10、IL-8)和金属蛋白酶增加(MMP1)[26]。在卵巢癌细胞和组织中ERK、p38、JNK高表达,且呈持续激活状态,参与卵巢癌的进展[27]。综上,TLR4外源性配体LPS刺激卵巢癌细胞ERK、p38、JNK以及NF-κB/p65的激活,共同参与卵巢癌细胞的炎性微环境。总之,此次实验研究发现TLR4外源性配体LPS作用于卵巢癌细胞,刺激NF-κB/p65和MAPKs信号的激活,佐证了TLR4激动剂LPS刺激卵巢癌细胞炎性细胞增殖信号表达的生物学效应。
TNF-α作为急性和慢性炎症的经典炎性细胞因子在卵巢癌微环境中过表达,并通过刺激细胞因子、促血管生成因子及基质金属蛋白酶的表达促进卵巢癌的进展[28-29]。Choi等[30]发现,TNF-α通过NF-κB信号的激活刺激炎性细胞因子的释放,并且与卵巢癌的进展密切相关;TNF-α在卵巢癌血清和组织的高表达,并参与调节卵巢癌肿瘤微环境形成。本实验运用经典炎性细胞因子TNF-α刺激卵巢癌细胞,结果显示TNF-α刺激受体TNFR1、TNFR2以及炎性增殖信号(JNK、ERK、p38、NF-κB/p65)和侵袭相关蛋白酶(MMP9、NE、Cat-G)的表达增加,卵巢癌细胞的炎性增殖以及侵袭转移效应可以被TNF-α受体抑制。与之前发现TNF-α通过NF-κB/p65信号参与卵巢癌肿瘤发生发展相似。
本研究发现,炎性相关因子影响卵巢癌细胞的炎性增殖增生信号及肿瘤侵袭转移相关蛋白表达,进而影响卵巢癌细胞内信号的改变。本次实验研究存在许多局限性。此次研究仅仅探索了炎性相关因子作用于卵巢癌细胞与细胞增殖信号及蛋白酶的关系,还需要进行更深入的实验研究: 采用CCK-8或MTT实验,检测炎性细胞因子对卵巢癌细胞活性及细胞增殖的变化;采用细胞划痕实验和Transwell细胞体外侵袭实验检测卵巢癌细胞在炎性因子刺激下的细胞迁移和侵袭能力;电镜下观察炎性因子刺激卵巢癌细胞发生的形态变化、细胞程序性坏死及细胞凋亡等情况,从多方面验证炎性相关因子对卵巢癌细胞生物学行为的影响。此外,还需要进一步探索肿瘤微环境中的多种炎性相关因子协同作用与卵巢癌细胞信号及生物学行为的确切关系和调控机制;进一步利用生物信息学分析及组织学分析(包括多重标记染色)建立卵巢癌组织(包括卵巢癌组织学亚型)样本中的炎性相关因子的表达与细胞增殖侵袭相关分子表达的相关性。雷月等[31]的研究显示,联合检测血清中肿瘤标志物CA125、CA199和HE4可提高非良性卵巢癌早期检测率,后续研究应进一步关联卵巢癌血清炎性因子表达水平、临床病理分期、细胞分化、转移复发及生存时间等主要临床参数,最终解释炎性因子参与的肿瘤微环境与卵巢癌发生进展以及生存预后的相关性,为卵巢癌的治疗提供切实有力的科学依据。
