大鼠局灶性脑缺血再灌注损伤后MBP、MAGLingo-1的表达及丁苯酞对其的影响
2019-11-09白小梅李正仪
白小梅,李正仪
缺血再灌注损伤在脑梗死发展过程中占有重要的地位[1],其病理生理过程较复杂,是一个多因素多环节相互作用的过程[2]。如何减轻这一损伤一直是国内外学者研究的重要方面,而髓鞘的受损、修复、再生情况成为近年来的研究热点。髓鞘碱性蛋白(myelin basic protein,MBP)、髓鞘相关糖蛋白(myelin associated glycoprotein,MAG)及含有亮氨酸重复序列及免疫球蛋白结构域的Nogo受体作用蛋白-1(leucine-rich repeat sequence and Ig domain-containing,Nogo recepter-interacting protein-1,Lingo-1)是与中枢神经系统髓鞘相关的3种蛋白。
丁苯酞(dl-3n-butylphthalide,NBP)是一种广泛应用于缺血性卒中患者的神经保护药物,可在脑梗死的多个环节起作用[3],但目前的相关研究大部分集中于NBP对神经元的保护,对髓鞘的研究相对较少。本实验采用线栓法阻塞S-D大鼠大脑中动脉建立局灶性脑缺血再灌注模型,通过免疫组化染色的方法测定脑组织皮质区MBP、MAG、Lingo-1的动态表达,探讨脑缺血再灌注损伤后神经纤维髓鞘的受损情况及NBP对受损髓鞘的影响。
1 材料和方法
1.1 动物和分组 健康、清洁级S-D雄性大鼠72只,体重范围在250 g~280 g之间(由西安交通大学医学院实验动物中心提供)。将大鼠随机分为3组:对照组、模型组和药物组,每组24只。每组按大鼠脑缺血再灌注时间点不同分为1 d、3 d、5 d、7 d 4个不同亚组,每个亚组6只大鼠。
1.2 试剂及药物 兔抗大鼠MBP、MAG、Lingo-1多克隆抗体及SP-0023免疫组化染色试剂盒(北京博奥森生物技术有限公司);DAB显色剂试剂盒(武汉博士德生物工程有限公司);丁苯酞原液(石药集团恩必普药业有限公司)溶于0.5%的吐温80溶液中配成浓度为20 mg/ml的丁苯酞溶液。
1.3 模型制备 本实验采用线栓法建立大脑中动脉阻塞(MCAO)模型。术前大鼠禁食12 h,10%水合氯醛溶液(0.35 ml/100 g)腹腔麻醉大鼠,消毒后将大鼠颈部正中皮肤切开,分别结扎颈外动脉及颈总动脉,在距离颈总动脉分叉处约4 mm的近心端剪一V型切口,将栓线插至颈内动脉约18~20 mm处,成功建立MCAO模型。常规消毒缝合切口。2 h后拔除栓线实现脑缺血再灌注。对照组只将栓线插至左颈总动脉分叉处,其余步骤均与模型组相同。药物组大鼠建立模型后腹腔注射丁苯酞溶液[20 mg/(kg·次)、2次/d]。对照组和模型组大鼠腹腔注射生理盐水[1 ml/(kg·次)、2 次/d]。术后大鼠单笼饲养,自由进食及饮水。
1.4 神经功能评分 使用Zea-Longa的5级4分法对MCAO模型大鼠进行神经功能缺损程度评分:无神经功能缺损症状0分;提尾时病灶对侧前肢不能完全伸展1分;向病灶对侧转圈2分;向病灶对侧倾倒3分;无自发活动,意识水平下降4分。选取评分为2分和3分的大鼠为模型组、药物组。
1.5 取材及切片制备 缺血再灌注1 d、3 d、5 d、7 d时麻醉各组大鼠,分别用0.9%氯化钠溶液、4%多聚甲醛溶液进行心脏灌注、固定并迅速断头,将脑组织完整取出后固定48 h至沉底。将左侧大脑以视交叉为中心切取其前后2 mm冠状切片组织,常规进行梯度酒精脱水、二甲苯透明、浸蜡、包埋并制备厚度为5 μm的切片用于免疫组化染色。
1.6 免疫组化染色 使用SP法,依次对脑组织切片脱蜡、水化,pH 6.0、0.01 mol/L柠檬酸缓冲液抗原修复,3% H2O2阻断内源性过氧化物酶活性,滴加封闭用正常山羊血清工作液,放37 ℃恒温箱20 min后取出,在各组切片上分别滴加一抗(MBP稀释比例1∶200、MAG稀释比例1∶100、Lingo-1稀释比例1∶100),4 ℃冰箱过夜,室温30 min,PBS缓冲液冲洗3次,滴加二抗、PBS缓冲液冲洗后进行DAB显色、苏木精复染、脱水、透明及封片,光镜下观察。使用LEICAQ550CW图像采集及分析系统在×200倍光镜下对MBP、MAG及Lingo-1的免疫组化染色结果进行图像采集,并对其阳性染色程度进行灰度值测定。测定灰度值时,分别取每组每只大鼠的脑组织切片2张,每张切片均在皮质区既定部位随机选取3个视野测定的灰度值,然后求平均数。
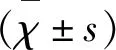
2 结 果
2.1 MBP 对照组大鼠皮质区MBP阳性表达,髓鞘呈棕褐色、鱼骨刺样紧密排列,随再灌注时间点推移表达强度无明显变化(P>0.05)。模型组、药物组MBP均在再灌注1 d时开始减少,3 d时最少,随后逐渐增多,差异具有统计学意义(P<0.05)。模型组、药物组MBP比同时间点对照组减少(P<0.05)。药物组MBP比模型组5 d、7 d时增多,差异具有统计学意义(P<0.05)(见表1、图1)。
2.2 MAG 对照组大鼠皮质区MAG阳性表达,主要为少突胶质细胞及少量皮质纤维呈棕黄色,随再灌注时间点推移表达强度无明显变化(P>0.05)。模型组、药物组MAG再灌注3 d时明显增多,随后逐渐减少,差异具有统计学意义(P<0.05)。模型组、药物组MAG较对照组1 d时无统计学差异(P>0.05);3 d、5 d、7 d时增多(P<0.05)。药物组MAG比模型组5 d时减少,差异具有统计学意义(P<0.05)(见表2、图2)。
2.3 Lingo-1 对照组皮质区Lingo-1阳性表达,主要为神经元及少突胶质细胞棕黄色,表达强度随再灌注时间点推移无明显变化(P>0.05)。模型组、药物组皮质区Lingo-1再灌注1 d时明显增多,随后逐渐减少,差异具有统计学意义(P<0.05)。模型组、药物组皮质区Lingo-1较同时间点对照组均增多(P<0.05)。药物组Lingo-1较模型组无统计学差异(P>0.05)(见表3、图3)。

表1 各组大鼠皮质MBP阳性表达灰度值比较
与对照组比较*P<0.05;与模型组比较#P<0.05

表2 各组大鼠皮质MAG阳性表达灰度值比较
与对照组比较*P<0.05;与模型组比较#P<0.05

表3 各组大鼠皮质Lingo-1阳性表达灰度值比较
与对照组比较*P<0.05
3 讨 论
脑缺血再灌注损伤会引起神经的一系列炎性反应,破坏脑屏障完整性,最终导致神经细胞死亡[4]。髓鞘是包裹在有髓神经纤维轴突周围的管状外膜,由蛋白质和鞘磷脂构成,具有绝缘和提高神经传导速度的作用[5]。MBP定位于有髓神经的髓鞘浆膜面,是髓鞘中含量最高的蛋白,具有中枢神经系统特异性,与少突胶质细胞(oligodendrocytes,OLGs)分化、髓鞘形成关系密切,对维持髓鞘稳定性起着重要作用,是中枢神经系统受损的标志物[6~8]。本实验中,模型组较对照组MBP减少,提示MBP与缺血再灌注损伤相关,再灌注3 d时表达最少,则提示此时髓鞘损伤最严重,这与国内外学者的研究结果基本一致[9~11]。MBP表达下降原因可能是脑缺血再灌注过程中大量自由基释放,导致与膜结构相结合的蛋白质稳定性下降,同时钙离子内流进入髓鞘包绕的轴突,激活钙依赖性蛋白酶使MBP水解;其次,髓磷脂中的不饱和键易被自由基氧化,易使MBP与脂质脱失,造成MBP下降;此外大量炎性因子释放后损伤成熟OLGs,使MBP释放或漏出至胞外,进一步导致MBP表达减少。也有学者将MBP作为恢复少突胶质细胞分化和髓鞘形成的动态观察指标[12]。本实验中药物组较模型组的MBP表达有所增加,但用药5 d、7 d时差异才具有统计学意义,这提示丁苯酞对髓鞘损伤有一定缓解作用,且用药达到一定时长后作用比较明显。
MAG也是一种髓鞘特异蛋白,与MBP不同的是它定位于髓鞘最里层,与轴突直接接触,是组成髓鞘的重要成分之一,主要参与髓鞘的形成、调节髓鞘与轴突间的作用、维持髓鞘结构的完整性等[13,14]。在神经发育过程、髓鞘形成的早期阶段MAG具有促进作用,在成熟神经系统和髓鞘形成晚期则发挥着抑制作用[15]。本实验中,模型组、药物组MAG表达先升高,随后逐渐降低,这与国内学者观察到大鼠脑缺血再灌注损伤后脑组织中MAG表达情况相吻合[16]。早期MAG逐渐升高,可能与MAG在脑损伤早期阶段应激性发挥抵抗兴奋性氨基酸毒性相关。随后MAG表达降低可能是对缺血缺氧敏感,缺血再灌注后功能受损或凋亡使其数量下降。但与对照组相比,此时模型组MAG的表达仍然是增多的,可能与残留的受损髓鞘引发MAG作为髓鞘相关抑制因子在脑缺血后发挥轴突抑制功能相关。研究[17]显示MAG通过与髓鞘相关抑制因子的共同受体NgR相结合,并在P75NTR的参与下,激活RhoA即小鸟嘌呤核苷三磷酸酶,最终发挥抑制作用。有学者认为在脑缺血过程中,MAG介导了髓鞘的疏松、解离,致使少突胶质细胞和髓鞘的损伤早于神经元病变[18]。这与本实验同时观察到大鼠皮质区MBP表达降低相吻合。药物组大鼠MAG的表达比模型组降低,提示丁苯酞在脑缺血再灌注损伤过程中对脑皮质有保护作用,可能通过保护线粒体、改善脑组织能量代谢及局部微循环等[3]保护神经髓鞘。
Lingo-1是一种跨膜蛋白质,选择性表达于中枢神经系统的OLGs和神经元,具有中枢神经系统特异性,主要功能是负性调节OLGs的分化、髓鞘形成、神经元存活及轴突再生等过程[19]。成年大鼠Lingo-1的表达水平在大脑皮质最高[20]。本实验中,模型组Lingo-1表达1 d时显著升高,随时间推移有所下降,再灌注7 d时仍高于对照组。Lingo-1表达升高可能是机体在脑缺血再灌注后的一种应答反应,且Lingo-1对于强化轴突抑制因子的抑制功能有促进作用,这也可以解释MAG作为髓鞘抑制因子之一在本实验中的表达是升高的。药物组Lingo-1与模型组相比有所降低但差异无统计学意义,可能与本实验观察时间较短有关。研究证明[21]Lingo-1在不依赖LRRs的情况下能抑制髓鞘碱性蛋白MBP的表达,这与本实验同时观察到MBP表达降低也是相一致的。此外,有学者[22]曾对局灶性脑梗死大鼠的Lingo-1表达情况进行研究,发现Lingo-1 mRNA及Lingo-1在脑缺血后1 d时达到高峰,在21 d时仍然高于假手术组。这与本实验模型组1 d时Lingo-1的表达明显增多相吻合,不同的是本实验未能观察到7 d以后各组Lingo-1的表达程度和变化趋势,还有待于今后进一步研究。此外,药物组较模型组Lingo-1表达无统计学差异也可能是本实验观察时间较短。为了减轻Lingo-1的髓鞘抑制作用,有学者[23]使用Lingo-1抗体来拮抗Lingo-1的抑制性作用,发现Lingo-1拮抗剂可以改善小鼠髓鞘损伤和空间记忆缺陷。另有研究表明抑制Lingo-1可以促进脊髓脱髓鞘后的功能恢复[19]。目前Lingo-1拮抗剂在神经系统髓鞘相关疾病如多发性硬化的治疗中已有所应用。
综上所述,本实验对大鼠脑缺血再灌注损伤后髓鞘相关的3种蛋白进行了观察,结果显示MBP表达减少,MAG及Lingo-1表达增多,提示大鼠脑缺血再灌注过程诱发髓鞘损伤,丁苯酞对受损髓鞘有一定保护作用。但脑缺血再灌注损伤后MBP、MAG和Lingo-1更具体的表达规律、相互间的关联、丁苯酞对受损髓鞘的影响机制还需今后进一步的研究。

图1 大鼠局灶性脑缺血再灌注损伤后术侧皮质区MBP表达(SP 法,×200)(a、b、c-再灌注3 d对照组、模型组、药物组)

图2 大鼠局灶性脑缺血再灌注损伤后术侧皮质区MAG表达(SP 法,×200)(a、b、c-再灌注3 d对照组、模型组、药物组)
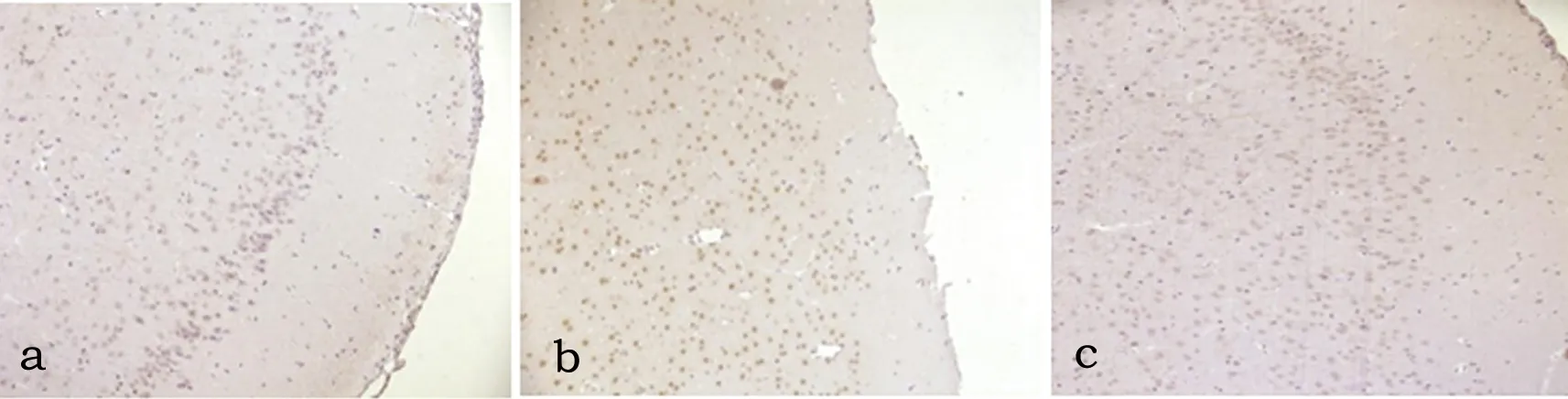
图3 大鼠局灶性脑缺血再灌注损伤后术侧皮质区Lingo-1表达(SP 法,×200)(a、b、c-再灌注1 d对照组、模型组、药物组)
