小檗碱对EAE小鼠星形胶质细胞S1PR1、3受体表达影响的研究
2019-11-09曾思玉余巨明秦新月罗家明
陈 蓉,曾思玉,张 微,李 艳,余巨明,秦新月,罗家明
多发性硬化(multiple sclerosis,MS)是一种中枢神经系统(central nervous system,CNS)自身免疫性疾病,临床呈慢性反复发作过程,中青年人群多见[1]。MS的病因复杂,发病机制尚待探明,可能在遗传因素与环境因素交互作用下,自身免疫系统紊乱而诱发的中枢神经脱髓鞘[2]。脱髓鞘造成轴索损伤,甚至神经元死亡,使患者神经退行性病变,引起患者神经功能障碍,所致的临床表现为残疾,伴发其他并发症时还会导致患者死亡[3]。MS主要病理改变是髓鞘脱失、胶质增生、轴索损伤等[4]。MS目前尚无治愈的方法,治疗手段亦有限[5]。因此,研究MS的病因和发病机制,探寻有效的治疗措施,成为MS亟待解决的问题[6]。
在MS及其动物模型实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)研究中发现,星形胶质细胞(astrocyte,AST)活化在其发生、发展过程中扮演重要角色[7,8]。MS及EAE小鼠中枢神经系统炎性反应主要由AST维持,AST活化后释放的一系列致炎性细胞因子和趋化因子,是中枢神经系统炎症维持和放大的重要因素[9,10]。AST还是构成血脑屏障的主要细胞,活化后的AST释放的致炎性细胞因子和趋化因子,可破坏血脑屏障,增加血脑屏障通透性,血脑屏障通透性增加也是MS发病的核心环节[10~12]。
1-磷酸鞘氨醇(sphingosine 1-phosphate,S1P)是细胞膜脂质代谢产物,系第二信号分子中的一种,在多种生理和病理过程中发挥重要作用[13]。Choi等[14]在对芬戈莫德(Fingolimod,FTY720)的中枢机制研究中发现,FTY720通过抑制AST上的S1PR1受体与S1P结合,从而缓解EAE小鼠临床症状。该研究团队进一步研究表明,AST上的S1PR1受体与S1P结合后,可导致EAE小鼠胶质增生、脱髓鞘、轴索损伤和致炎性细胞因子(如IL-1β、IL-6、IL-17等)的释放,故AST上S1PR1与S1P结合是AST介导EAE发病的关键。MS患者脑组织中AST上S1PR3受体表达量较正常高[13],在EAE小鼠离体实验研究中发现,S1P与其受体S1PR3结合后,通过S1P/S1PR3通路激活AST,是AST激活和引发胶质增生以及维持炎性反应的另一重要环节[15,16]。
小檗碱(Berberine,BBR)即黄连素,是从黄连、黄柏等中药中提取的结构明确的中药单体,有抗感染、驱虫、止泻等功效,且毒副作用小,使用安全,临床应用广泛。在阿尔茨海默病(Alzheimer disease,AD)和脑缺血性损伤等中枢神经系统疾病研究中发现,BBR能通过血脑屏障,直接作用于中枢神经系统,抑制致炎性细胞因子的释放、调控神经递质释放、抗氧化和自由基的清除等[17~20]。研究表明,BBR可缓解EAE小鼠神经缺损症状,保护血脑屏障,但其具体的作用机制并不清楚[22,23]。研究显示在小鼠糖尿病肾病模型中,BBR能抑制肾脏细胞鞘氨醇激酶1(sphingosine kinase 1,SPHK 1)表达,SPHK 1为生成鞘氨醇的限速酶,SPHK 1将鞘氨醇磷酸化为S1P。BBR抑制SPHK 1表达后,可减少S1P的产生,提示BBR能够影响S1P的生成[24]。
本研究通过构建EAE模型小鼠,用不同剂量的BBR干预,观察小鼠的临床表现,对各组小鼠进行神经功能缺损进行评分。检测小鼠AST上S1PR1、3受体表达情况,了解中枢神经炎细胞浸润、脱髓鞘程度和胶质增生情况。用BBR干预原代细胞培养的AST,检测BBR对离体AST的S1PR1、3受体表达的影响。
1 材料与方法
1.1 材料 实验小鼠:体重15~20 g、8~10周龄的健康雌性C57BL/6小鼠60只,在川北医学院实验动物中心SPF级环境饲养,自由摄食,室内温度25 ℃,保持自然昼夜节律光照。所有实验均获得川北医学院伦理委员会批准。MOG35-55多肽(sigma公司,美国)、完全弗氏佐剂(sigma公司,美国)、(sigma公司,美国)、BBR(sigma公司,美国)、卡介苗(中国药物研究所)、一抗(abcom公司,英国)、脂多糖(lipopolysaccharide,LPS)、二抗(abcom公司,英国)。
1.2 方 法
1.2.1 分组及造模方法 将实验动物随机分为5组,分别为CFA组(n=6):小鼠免疫建模时,用生理盐水代替MOG35-55多肽片段构建模型,免疫后10 d,为不含免疫抗原乳剂的空白对照组;EAE组(n=6):MOG35-55多肽片段构建模型,为疾病组;BBR干预组[BBR按照50 mg/(kg·d)剂量灌胃,n=6]:构建EAE模型,从建模后第10天开始,每日给予不同剂量[50、100、300 mg/(kg·d)]BBR灌胃,为疾病干预组。CFA组和EAE组在建模后第10天起给与等量生理盐水灌胃。采用经典造模方法,将MOG35-55多肽用pH值为7.2、浓度为0.01 mol/L的PBS液稀释后,与含卡介苗10 g/L的完全弗氏佐剂(complete Freund’s adjuvant,CFA)等体积混合,使其终浓度为300 μg /ml。使用注射器通过连接后低温环境反复推拉至油包水状态,即为抗原乳剂。抗原乳剂注射方法采用经典的多点足垫皮下注射法,每只小鼠分4点注射,共注射0.2 ml抗原乳剂[MOG35-55多肽片段含量为300 μg/(ml·只)]。在抗原乳剂免疫后的0 h和48 h,分别给予百日咳菌稀释液0.1 ml/只,腹腔注射(含百日咳杆菌活菌109个)作为增敏剂以提高模型发病率。每天观察各组小鼠神经功能状况、临床表现,参照Kono[25]方法,对各组小鼠进行神经功能缺损程度评价。具体评分办法如下:0分为正常,无发病;1分为动物尾部无力;2分为翻身不能;3分为双后肢瘫痪;4分为四肢瘫痪;5分为濒死状态或死亡。经培训的两位实验人员分别评分后取平均分作为最终得分。
1.2.2 LFB染色 LFB染色了解各组小鼠脑组织脱髓鞘情况。在各组小鼠干预后30 d,终止试验,处死小鼠,用多聚甲醛心脏灌注法取材。LFB染色观察脱髓鞘程度,评分标准如下:1分为轻微脱髓鞘;2分为显著脱髓鞘;3分为脱髓鞘斑块多处融合;4分为广泛中枢脱髓鞘并伴中枢神经系统实质内炎细胞浸润。每个组织计数方法取5个视野计算平均值。
1.2.3 免疫荧光双标 运用免疫荧光法检测各组小鼠脊髓和脑组织胶质增生情况,镜下观察并采集图像,随机挑选3个200倍视野拍照保存,Image-Pro Plus 6.0软件分析计算出累积光密度值(integrated optical density,IOD)。免疫荧光双标检测各组小鼠脊髓和脑组织AST上S1PR1、S1PR3表达情况,镜下观察并采集图像,分析方法同前述。
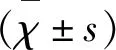
2 结 果
2.1 小鼠临床表现 CFA组小鼠无发病。EAE组小鼠呈亚急性发病,精神食欲差,活动少,毛色暗淡,体重下降。EAE组小鼠抗原免疫后第8天,部分小鼠陆续发病;免疫后16~20 d,大部分小鼠症状达到顶峰,随后症状逐渐好转,但部分小鼠症状持续到免疫后30 d。BBR干预组:该组小鼠总体发病比EAE组更轻微,尤其100、300 mg/(kg·d)剂量组症状减轻显著。BBR干预组小鼠体重下降程度和肢体瘫痪情况较EAE组轻,随着BBR剂量增加,小鼠体重下降程度、瘫痪情况减轻越明显(见图1)。
2.2 各组小鼠脑组织炎性浸润和脱髓鞘改变情况 CFA组小鼠脑组织切片检测发现炎细胞浸润较少。EAE组小鼠脑组织切片中,炎细胞浸润较多,主要聚集在小血管周围,脑实质内也有炎细胞浸润。BBR干预组脑实质中炎细胞浸润较EAE组少,100/300 mg/(kg·d)组减少更明显。炎性程度评分结果提示100 mg/(kg·d)和300 mg/(kg·d)剂量组较EAE组低(P<0.01)(见图2)。CFA组小鼠脑组织无明显脱髓鞘改变。EAE组小鼠脑组织可见明显髓鞘破坏,主要表现为LFB染色局部呈淡染,髓鞘纤维纤细,间距增宽,空泡区较多,部分切片出现髓鞘断裂或缺如。脑组织脱髓鞘评分结果显示,100 mg/(kg·d)和300 mg/(kg·d)剂量组较EAE组低(P<0.01)(见图2)。
2.3 荧光免疫检测各组小鼠脑和脊髓组织胶质增生情况 通过GFAP标记脑和脊髓组织胶质增生程度结果显示,EAE组小鼠脑组织胶质增生明显,小檗碱干预各组胶质增生受到抑制。通过IOD值分析显示,小檗碱干预各组小鼠脑和脊髓GFAP表达较EAE组小鼠低,差异有统计学意义(P<0.01),剂量越大,减轻程度越明显(见图3)。
2.4 各组小鼠脑和脊髓组织星形胶质细胞上S1PR1、3受体 各组小鼠进行GFAP和S1PR1、S1PR3受体荧光标记,结果显示:EAE组小鼠脑组织AST上S1PR1、3受体表达量较CFA组高,差异有统计学意义(P<0.01)。BBR各剂量干预组小鼠脑组织中,AST上SPR1、3受体表达量较EAE组减少显著,差异有统计学意义(P<0.01)。BBR各干预组间存在剂量梯度变化差异,剂量越大,AST上S1PR1、3受体表达量越少,差异有统计学意义(P<0.01),剂量越大,表达量越少(见图4)。

A:各组小鼠神经功能评分变化趋势;B:各组小鼠最大神经功能缺损评分比较;C:各组小鼠神经功能缺损累积评分比较
图1 各组小鼠神经功能评分变化趋势、最大评分和累积评分
3 讨 论
传统中药黄连在中国拥有长达千年的临床使用历史,黄连素是从中药黄连中提取的天然中药单体,具有广泛的生物活性[21]。研究发现BBR通过作用多条信号通路发挥重要的生物活性作用,使其用于多种疾病的治疗[18,24]。近年来,BBR因其易透过血脑屏障,调控神经递质、抑制炎细胞因子释放、清除自由基和抗氧化等功能,在中枢神经系统疾病中的治疗作用越来越受到重视[17,19,20]。
MS发病机制尚不清楚,胶质增生是其主要的病理改变。胶质增生即中枢神经系统中大量AST活化、增生,胶质增生后AST标记物GFAP显著升高,AST活化后释放10余种致炎性细胞因子,维持和放大中枢神经系统炎症[26,27]。MS胶质增生过程如下:少突胶质细胞上髓鞘病理性破坏后,使小胶质细胞极化,极化后的小胶质细胞释放的致炎性细胞因子作用于AST,进一步激活AST,AST是致炎性细胞因子的主要效应细胞[28]。胶质增生严重程度与MS和EAE的临床症状呈正相关,也与神经功能评分呈正比[8,13,29]。S1P与表达细胞表面的5种G蛋白藕联受体1-磷酸鞘氨醇受体1-5(sphingosine 1-phosphate receptor1-5,S1PR1-5)结合后,引发一系列生理效应,如调节细胞生存、增殖、迁移以及传递各种细胞信号等[13,27]。同时,S1P亦是导致中枢神经系统胶质增生的重要因素,研究发现脊髓损伤后,胶质增生与S1P含量呈正相关[14]。颅内注射外源性S1P能加重脑组织胶质增生,提示升高的S1P可导致中枢胶质增生[30]。S1P还参与缺血性脑损伤、MS等多种疾病的发病[14~16]。研究显示MS患者颅内病灶中,S1P含量较正常高,提示MS发病可能与S1P升高有关[13,17,30]。
Kim等[31]在MS的另一种动物模型双环已二酮草酰二腙(cuprizone,CPZ)诱导的脱髓鞘模型中(该模型仅用毒性的CPZ直接破坏中枢神经系统髓鞘,无外周免疫诱导机制参与),发现AST上S1PR1与S1P结合是导致胶质增生的重要环节。由于该研究使用的模型是非免疫诱导直接毒性作用造成的中枢脱髓鞘和胶质增生,由此说明S1P与S1PR1结合导致胶质增生,且不依赖外周免疫系统参与。S1P与其受体结合后的作用在MS和EAE的发病中发挥重要作用,该通路成为近年MS研究的热点[13~15]。
S1P信号通路在EAE小鼠或MS患者神经退行性病变中起重要作用[28]。S1P是导致中枢胶质增生的重要原因之一,脑组织是S1P含量最高的器官,病理情况下浓度更高[15]。颅内的S1P除来源于血液之外,还可内源性产生。Choi等[14]发现AST上的S1PR1受体与S1P 结合是导致EAE小鼠脱髓鞘、胶质增生、轴索损伤和致炎性细胞因子释放的关键。由此推测,AST上S1PR1受体与S1P结合可能是AST激活的关键环节,S1P亦是导致中枢胶质增生的重要原因之一。本研究首先证实EAE小鼠AST上S1PR1、3受体表达量增高,而BBR能抑制EAE小鼠模型AST上S1PR1、3受体表达。提示BBR通过抑制S1PR1、3受体表达,减少S1P与S1PR1和S1PR3两种受体结合,这可能是BBR抑制AST激活的原因之一。本研究还发现BBR缓解EAE小鼠临床症状、降低神经功能缺损评分,与剂量大小呈正相关,100 mg/(kg·d)和300 mg/(kg·d)剂量干预组较50 mg/(kg·d)效果更明显。
与以往研究相比,本研究有两个不同之处:第一,既往研究仅给予单一剂量的BBR干预,不清楚剂量大小对MS 发病是否有影响。本研究设置了3个剂量梯度,观察到临床疗效、胶质增生和炎细胞浸润和脱髓鞘程度等,剂量越大,临床症状和脱髓鞘程度越轻,胶质增生和炎细胞浸润、致炎性细胞因子释放越少。本研究进一步证实BBR对EAE小鼠有一定治疗效果,为以后的临床研究和治疗提供理论依据。第二,既往研究从BBR对EAE外周免疫反应以及其对血脑屏障的影响角度入手,未研究其在EAE发病的中枢损伤机制[20,22]。本研究针对EAE发病的关键环节,中枢神经系统AST上S1P受体入手,对其作用机制进行更深层次的探索。
本研究发现经BBR干预后,EAE小鼠AST特异标记物GFAP及致炎性细胞因子IL-1β、IL-6表达显著下降,提示BBR能抑制AST活化。BBR干预后的EAE小鼠胶质增生和炎细胞浸润减少,临床症状和脱髓鞘程度减轻,且与剂量呈正相关。本研究证实了BBR能缓解EAE小鼠临床症状。同时还发现BBR能抑制中枢胶质增生和脱髓鞘,可能与其抑制AST上S1PR1、3受体表达、致炎性细胞因子释放有关,为BBR在MS的基础研究与临床应用提供了一定的理论依据。

A:各组小鼠脑组织HE染色示炎性细胞浸润情况;B:各组小鼠脑组织炎性细胞浸润评分结果比较;C:各组小鼠脑组织LFB染色示脱髓鞘情况;D:各组小鼠脑组织脱髓鞘评分结果比较
图2 各组小鼠脑组织HE和LFB染色

A:各组小鼠脑组织胶质增生情况;B:各组小鼠胶质增生评分比较情况

A:各组小鼠小鼠脑组织星形胶质细胞S1PR1、3表达情况;B:各组小鼠脑组织星形胶质细胞S1PR1受体表达比较;C:各组小鼠脑组织S1PR3受体表达比较
图4 各组小鼠脑组织S1PR1、3表达情况
