燕麦β-葡聚糖对肌原纤维蛋白乳化和凝胶特性的影响
2019-11-06曹传爱孔保华
姜 帅, 曹传爱, 康 辉, 孔保华, 刘 骞,*
(1.东北农业大学 食品学院, 黑龙江 哈尔滨 150030;2.南京农业大学 食品科技学院/国家肉品质量安全控制工程技术研究中心, 江苏 南京 210095)
肌原纤维蛋白(myofibrillar protein, MP)具有特殊的功能特性和营养价值,如乳化性和凝胶性等对产品的质构、风味和营养起着重要的作用。在肉及肉制品加工过程中,由于不当的加工处理、运输及贮藏等,常需要添加食品胶来改善肌原纤维蛋白的乳化和凝胶特性,促使肌原纤维蛋白在加热后形成良好的三维凝胶网状结构,并充分乳化脂肪[1-2],从而提高产品营养价值和改善风味,同时还能显著提高产品产量[3]。
燕麦β-葡聚糖是由葡萄糖通过β-D-(1→3)糖苷键及β-D-(1→4)糖苷键形成的单一单糖线性大分子[4]。燕麦β-葡聚糖具有优良的生物活性,具有降血糖、降血脂、调节肠道菌群及提高免疫功能等功效;并且燕麦β-葡聚糖富含膳食纤维,不易被人体消化[5],作为食品配料添加不会造成机体负担。另外,燕麦β-葡聚糖还具有良好的凝胶性、持水性、增稠性、持油性等,在水中溶解后可以形成较强黏性的溶液,具有良好的黏弹性[6]。燕麦β-葡聚糖具有良好的乳化性,β-葡聚糖的质量分数越大,越能有效阻碍乳状液中液滴的聚集[7]。此外,燕麦β-葡聚糖具有一定的凝胶性,能显著降低乳浊液中油相和水相界面的表面张力[8]。
燕麦β-葡聚糖在香肠、肉丸及牛肉等肉制品中具有广泛应用前景,少量β-葡聚糖填入大量肉蛋白凝胶结构中,可以增强产品保水保油率,降低凝胶孔洞,提高切片性,同时,β-葡聚糖还可以增强肉蛋白凝胶结构的紧实感和细腻感[9-11]。Huang等[9]研究发现在香肠中添加燕麦纤维,香肠品质特性明显改善,表现出良好的保水性、保油性。目前,关于燕麦β-葡聚糖的提取方法、结构特性及理化特性等方面的研究较多[12-14],而对其在肉制品中应用机制方面的研究较少。本实验将燕麦β-葡聚糖添加到肌原纤维蛋白中形成复合体系,通过对复合乳状液的乳化特性、粒径分布、ζ-电位的测定,以及加热过程中对复合凝胶的持水性、凝胶强度、白度值、流变特性和微观结构的测定,研究燕麦β-葡聚糖的添加对肌原纤维蛋白乳化和凝胶特性的影响,阐述β-葡聚糖与肌原纤维蛋白的相互作用机制,为燕麦β-葡聚糖提高肉制品的加工品质和食用价值提供理论和应用指导。
1 材料与方法
1.1 材料与试剂
猪背部最长肌,市售;燕麦β-葡聚糖,江苏金河源生物工程有限公司;氯化钠、磷酸二氢钠、磷酸氢二钠、氯化镁、EGTA等,分析纯,上海国药集团化学试剂有限公司。
1.2 仪器与设备
T18型匀浆机,德国IKA公司;FE20K型pH计,上海梅特勒- 托利多仪器设备有限公司;Nano ZS型动态光散射仪、Malvern 2000型激光粒度散射仪,英国马尔文公司;722型可见光分光光度计,上海精科仪器设备有限公司;ZE- 6000型色差计,日本色电工业株式会社;TGL- 21M 型高速冷冻离心机,湖南长沙湘仪离心机仪器有限公司;AL- 104型精密电子天平,常州万泰天平仪器有限公司;MC- SH2115型电磁炉,广州美的生活电器制造有限公司;DK- 98- 1型电热恒温水浴锅,天津泰斯特仪器有限公司;TA- XT plus型质构分析仪,英国Stable Micro System公司;Discovery DHR- 1型流变仪,美国TA 仪器公司;S- 3400N型扫描电子显微镜,日本日立公司;PQ001型台式NMR分析仪,上海纽迈电子有限公司。
1.3 实验方法
1.3.1肌原纤维蛋白的提取
猪背部最长肌,首先去除血污、结缔组织和肌膜,具体操作参考Xiong等[15]的方法。采用双缩脲法测肌原纤维蛋白的含量,将提取好的肌原纤维蛋白放置在4 ℃的冰箱备用。
1.3.2肌原纤维蛋白-燕麦β-葡聚糖复合乳状液乳化能力测定
1.3.2.1 复合乳状液的制备
将肌原纤维蛋白溶于磷酸缓冲液(0.6 mol/L NaCl,50 mmol/L Na2HPO4/NaH2PO4,pH值 6.5)配置成10 mg/mL肌原纤维蛋白溶液,分别将质量分数0、0.2%、0.4%、0.6%、0.8%和1.0%的燕麦β-葡聚糖加入到等量的肌原纤维蛋白溶液中,搅拌混匀进行乳化能力相关指标的测定。
1.3.2.2 复合乳状液乳化活性及乳化稳定性测定
复合肌原纤维蛋白乳化活性(emulsifying activity index, EAI)和乳化稳定性(emulsifying stability index, ESI),计算见式(1)、式(2)[16]。
(1)
(2)
式(1)、式(2)中,EAI,m2/g;ρ为初始溶液中蛋白质量浓度,g/mL;φ为油相体积分数,0.2%;A500为500 nm波长处的吸光度;di为稀释倍数;A0、A10为乳状液在0、10 min的吸光度。
1.3.2.3 复合乳状液粒径大小及分布的测定
参照Diao等[17]的方法略作改动。不同燕麦β-葡聚糖添加量的复合乳状液,室温下(约25 ℃)使用Malvern 2000 型激光粒度散射仪测定粒径大小及分布情况,每个样品测量3次取平均值。
1.3.2.4 复合蛋白乳状液ζ-电位测定
样品在测定前用蒸馏水稀释,室温下(约25 ℃)采用Nano ZS型动态光散射仪测定,每个样品测量3次取平均值[18]。
1.3.3肌原纤维蛋白-燕麦β-葡聚糖复合凝胶凝胶能力测定
1.3.3.1 复合凝胶的制备
肌原纤维蛋白溶于磷酸缓冲液(0.6 mol/L NaCl,50 mmol/L Na2HPO4/NaH2PO4,pH值6.5),在40 mg/mL肌原纤维蛋白中,分别加入质量分数0、0.2%、0.4%、0.6%、0.8%和1.0%的燕麦β-葡聚糖。二者充分混合后,取出约5 g混合物放入核磁管中,同时取10 g混合物放入25 mm×40 mm凝胶瓶中,凝胶瓶和核磁管均于80 ℃水溶锅中加热20 min,取出冷却,4 ℃贮藏后进行凝胶指标测定。
1.3.3.2 复合凝胶持水性的测定
参照文献[19]进行实验,重复3次,根据式(3)计算凝胶持水性(water holding capacity, WHC)。
(3)
式(3)中,m为离心管质量,g;m1为离心前凝胶和离心管总质量,g;m2为离心后凝胶和离心管总质量,g。
1.3.3.3 复合凝胶强度的测定
参考Xue等[20]的方法并略作修改。物性分析仪测量参数如下:探头型号P/0.5,下压距离50%,触发力0.049 N,测试速率2 mm/s,测试前后速率均为5 mm/s。每个样品进行3次重复实验。
1.3.3.4 复合凝胶白度值的测定
测定凝胶的色差,即L*值、a*值、b*值。实验重复3次,按照Park[21]的方法计算白度值(whiteness,W),见式(4)。
W=100-[(100-L*)2+a*2+b*2]1/2。
(4)
1.3.3.5 复合凝胶内部水分的测定
参考Han等[22]的方法,将放有复合凝胶的核磁管置于LF- NMR分析仪中,质子共振频率为22.6 MHz,使用 Carr- Purcell- Meiboom- Gill (CPMG) 程序测定肉样中的横向弛豫时间(T2),τ-值(间隔时间为90脉冲到180脉冲)为200 μs,重复扫描32次,重复间隔时间为6.5 s,得到12 000个回波,得到的图形为指数衰减图形,实验重复3次。
1.3.3.6 动态流变学测定
采用TA流变仪进行测试,参数为上下板夹缝0.5 mm,频率0.1 Hz,应变2%,以1 ℃/min从20 ℃升温到80 ℃[23],实验重复3次。
1.3.3.7 复合凝胶微观结构的测定
采用扫描电子显微镜对凝胶的微观结构进行观察[23]。
1.4 数据分析
实验采用 SigmPlot 12.5软件绘图,用Statistix 8.1 软件包进行数据分析,每个实验样品重复3次。
2 结果与分析
2.1 燕麦β-葡聚糖对肌原纤维蛋白乳化能力的影响
2.1.1燕麦β-葡聚糖对复合乳状液乳化活性和稳定性的影响
燕麦β-葡聚糖对复合乳状液乳化能力的影响如图1,随着燕麦β-葡聚糖添加量的增加,肌原纤维蛋白乳化活性和乳化稳定性均呈现显著增加趋势(P<0.05),即乳化能力得到明显的改善。燕麦β-葡聚糖作为一种良好的乳化剂,与蛋白质在油水界面的扩散、吸附和排列存在一定的关系。当燕麦β-葡聚糖添加量为0.2%时,其乳化活性较对照组提高了18.90%,说明添加燕麦β-葡聚糖后复合乳状液的乳化活性明显增强;当燕麦β-葡聚糖添加量为1.0%时,复合乳状液的乳化活性是对照组的2.01倍。

不同小写字母表示差异显著(P<0.05)。图1 燕麦β-葡聚糖对MP乳状液乳化活性和稳定性的影响Fig.1 Effects of oat β-glucan on emulsifying activity and emulsifying stability of myofibrillar protein emulsions
当燕麦β-葡聚糖添加量为0.2%时,其乳化稳定性较对照组提高了15.36%,说明添加燕麦β-葡聚糖后复合乳状液的乳化稳定性增强;而燕麦β-葡聚糖添加量为1.0%时,复合乳状液的乳化稳定性是对照组的1.90倍。这可能是由于燕麦β-葡聚糖对疏水性物质有着良好的包容性,在肌原纤维蛋白乳状液油水界面上,增加了静电斥力的作用,进一步阻止脂肪滴的聚集,抑制蛋白质的沉淀,保持乳状液体系的稳定。李媛媛等[24]发现在肌原纤维蛋白中添加阿拉伯树胶后,能显著提高复合乳状液的乳化活性和稳定性。同样,费立天[25]研究表明添加高浓度的瓜尔胶和黄原胶后,复合乳状液的稳定性要高于肌原纤维蛋白乳状液组。
2.1.2燕麦β-葡聚糖对复合乳状液粒径的影响
燕麦β-葡聚糖对复合乳状液粒径大小和分布的影响如图2,对照组乳状液大粒径液滴分布广,小粒径液滴分布较小。随着燕麦β-葡聚糖添加量的增加,复合乳状液的粒径分布有向小粒径区域移动的趋势。可能由于燕麦β-葡聚糖对植物油有着良好的包容性,吸附在油脂分子表面,减少油脂分子间的聚集,进而降低乳状液的颗粒大小,对复合体系的乳化稳定性有着良好的提高作用。体积分布的变化和粒径大小的变化结果相似,肌原纤维蛋白的粒径分布为偏态分布,对照组乳状液中颗粒平均粒径最大,可能发生了蛋白质的絮凝和聚集;添加燕麦β-葡聚糖后,乳状液的粒径分布发生明显改变,导致乳状液体系向小粒径方向移动,稳定性增强。李媛媛等[24]研究表明添加阿拉伯树胶后,肌原纤维蛋白复合乳状液颗粒表面电荷量增加,由于静电斥力作用,颗粒之间彼此难以靠近,从而乳状液的物理稳定性明显增加。Piriyaprasarth等[26]发现,多糖- 蛋白复合物可用于改善水包油乳状液的物理稳定性,由于果胶- 蛋白复合物在油滴表面形成了一层厚而致密的界面层,从而使乳状液体系具有较强的物理稳定性,防止乳状液的聚集和聚结。
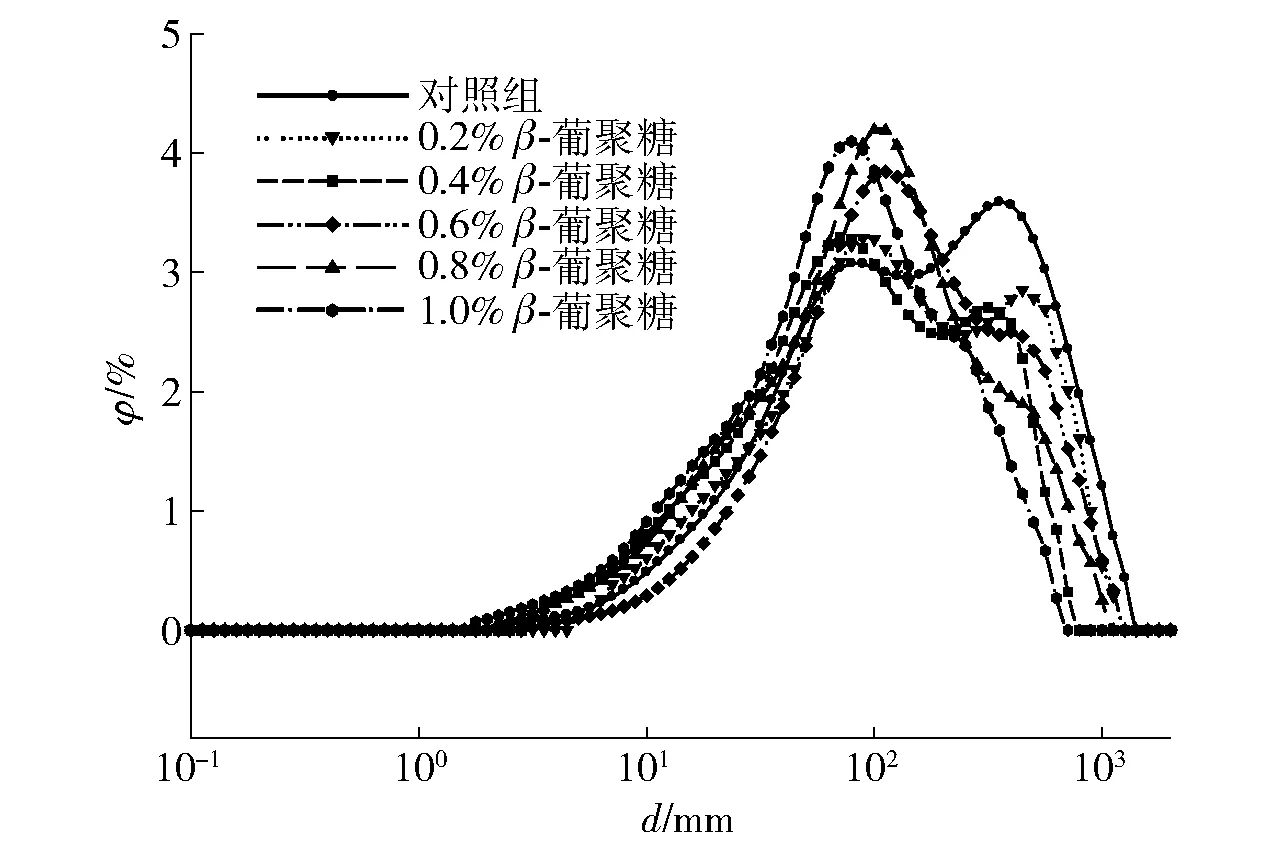
图2 燕麦β-葡聚糖对MP乳状液粒径分布的影响Fig.2 Effects of oat β-glucan on particle size distribution of myofibrillar protein emulsions
2.1.3燕麦β-葡聚糖对复合乳状液ζ-电位的影响
ζ-电位是评价乳状液稳定程度的一个重要指标,ζ-电位绝对值越大表明乳状液滴稳定性越好,液滴之间排斥力大于吸引力,分散体系稳定而不发生凝结,乳状液抵抗聚集和絮凝的能力越强。研究表明,在多糖和蛋白质复合体系中,多糖可以和蛋白质通过静电相互作用形成络合物或者发生共价交联形成永久性复合物,从而影响乳状液的物理稳定性。
肌原纤维蛋白- 燕麦β-葡聚糖复合乳状液显示高度的负ζ-电位,样品的ζ-电位均为负值,见图3。对照组的ζ-电位为-15.57 mV,添加燕麦β-葡聚糖组的ζ-电位绝对值均高于对照组,随着燕麦β-葡聚糖添加量的增加,ζ-电位的绝对值呈现显著增加的趋势。在添加量为0.8%时,ζ-电位的绝对值达到29.93 mV,与对照组相比增加了92.23%。燕麦β-葡聚糖增加肌原纤维蛋白乳状液的ζ-电位绝对值,可能是二者之间产生静电相互作用,导致电位变化。有研究表明,将多糖添加到蛋白质乳状液中,能够抑制液滴运动,增加乳状液的黏度,提高界面蛋白的吸附作用,从而增强乳状液的物理稳定性[27]。

不同小写字母表示差异显著(P<0.05)。图3 燕麦β-葡聚糖对MP乳状液ζ-电位的影响Fig.3 Effects of oat β-glucan on ζ-potential of myofibrillar protein emulsions
2.2 燕麦β-葡聚糖对肌原纤维蛋白凝胶能力的影响
2.2.1燕麦β-葡聚糖对复合凝胶凝胶特性的影响
表1显示,燕麦β-葡聚糖添加组的持水性显著高于未添加的对照组(P<0.05),随着燕麦β-葡聚糖添加量的增加,复合蛋白凝胶的持水性均呈显著增加趋势(P<0.05)。当燕麦β-葡聚糖添加量为0.2%时,其凝胶强度较对照组提高了5.60%,说明添加燕麦β-葡聚糖后凝胶的持水性增强,但燕麦β-葡聚糖添加量较少(0.2%)时差异不显著(P>0.05);而燕麦β-葡聚糖添加量从0.2%增加至1.0%时,复合凝胶强度增加了27.02%。燕麦β-葡聚糖结构类似于可得然胶,由于燕麦β-葡聚糖其晶体结构中含有大量氢键,在加热过程中,推测燕麦β-葡聚糖颗粒吸水膨胀填充进蛋白质三维空间网络结构中,从而减少蛋白质热诱导凝胶形成过程中的水分损失,提高凝胶持水性能,这也与左淑荣[28]的研究结果相一致。
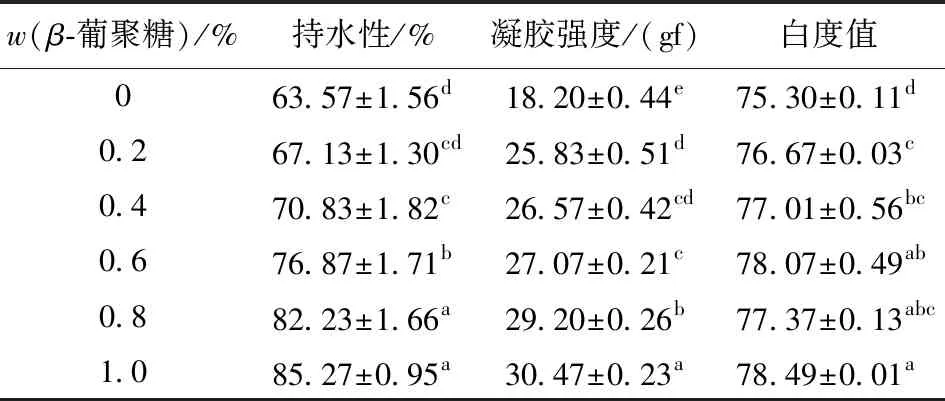
表1 燕麦β-葡聚糖对MP凝胶持水性、 凝胶强度和白度值的影响Tab.1 Effects of oat β-glucan on water holding capacity, gel strength and whiteness of myofibrillar protein gels
数据表示为平均值±标准差(n=3)。同一列中不同字母表示差异显著(P<0.05);1 gf表示0.009 8 N。
从表1可以看出,燕麦β-葡聚糖添加组的凝胶强度均显著高于未添加的对照组(P<0.05),并且,随着燕麦β-葡聚糖添加量的增加,复合蛋白凝胶强度呈现显著增加的趋势(P<0.05)。其中,添加1.0%的燕麦β-葡聚糖的复合凝胶变化最为显著(P<0.05)。当燕麦β-葡聚糖添加量为0.2%时,其凝胶强度较对照组提高了41.92%;而燕麦β-葡聚糖添加量从0.2%增加至1.0%时,凝胶强度增加了17.96%。推测燕麦β-葡聚糖加热吸水溶胀形成水溶胶,螺旋间距离较大作用力弱,可以与肌原纤维蛋白等大分子通过相互作用紧密结合,形成了更加致密稳定的三维网络结构,从而增强凝胶强度,这也与左淑荣[28]研究结果相一致。刘骞等[29]研究发现,添加可得然胶- 卡拉胶复配物也可以显著增强肌原纤维蛋白的凝胶强度。
由表1可知,添加燕麦β-葡聚糖的凝胶白度值均显著高于未添加的对照组,随着燕麦β-葡聚糖添加量的增加,凝胶白度值呈现显著增加的趋势(P<0.05)。可能由于凝胶内部水分含量多少与L*呈正相关,水分的增加增强了光的反射作用,其对白度值的影响较大[30]。然而Piero等[10]添加燕麦β-葡聚糖到低脂牛肉产品中,发现燕麦β-葡聚糖能显著提高产品的水分,而对产品的色泽无明显影响。
2.2.2燕麦β-葡聚糖对复合凝胶内部水分分布的影响
LF- NMR可以直观地反映蛋白凝胶内部水分的相对分布状态,间接推断蛋白质热变性过程中自由水、不易流动水和结合水的迁移规律,从而预测燕麦β-葡聚糖和肌原纤维蛋白在加热形成凝胶过程中二者的结合作用。不同添加量的燕麦β-葡聚糖与肌原纤维蛋白形成复合蛋白凝胶的过程变化如图4,蛋白凝胶的核磁衰减信号被拟合为3个峰,出现在5.20~6.93 ms、407.73~556.60 ms、1 342.62~1 622.69 ms之间,分别为存在的结合水(T2b)、不易流动水(T21)和自由水(T22) 的分布,即肌原纤维蛋白凝胶内部水分的结合情况和自由移动程度。

图4 燕麦β-葡聚糖对MP凝胶横向弛豫时间分布的影响Fig.4 Effects of oat β-glucan on relaxation time distribution of myofibrillar protein gels
低场核磁图像中弛豫时间(T)能显著地反映出这3种水分群在凝胶中的分布,而峰面积百分数(P)反映各种状态水分的相对比例,二者结合阐明蛋白凝胶不同状态水分间的迁移和变化情况。随着燕麦β-葡聚糖添加量的增加,T21和T22呈现逐渐降低的趋势(P<0.05),然而对T2b无显著影响(P>0.05)。同时,弛豫时间对应的P(T21)显著增加,P(T22)显著降低(P<0.05),而P(T2b)没有显著性变化(P>0.05)(见表2)。这表明随着燕麦β-葡聚糖的添加,凝胶中不易流动水和自由水均有向弛豫时间快的方向(即结合水方向)移动的趋势,使得这部分水分的移动性减弱,并且随着燕麦β-葡聚糖添加量的增加显著加快(P<0.05),同时由于结合水与肉蛋白紧密结合,添加燕麦β-葡聚糖后结合水不发生迁移变化。加热过程中肌球蛋白适度变性展开并形成随机线性结构,燕麦β-葡聚糖分散液发生吸水溶胀,参与肌球蛋白头部聚集过程,形成致密的凝胶网络结构,通过形成大量氢键来束缚更多的水分子[31],燕麦β-葡聚糖与大量的自由水通过氢键结合,使体系中自由水向不易流动水方向移动。Liu等[11]发现在猪肉丸中添加燕麦β-葡聚糖,能够使猪肉丸孔洞较少、表面光滑,肉丸持水性明显增加。
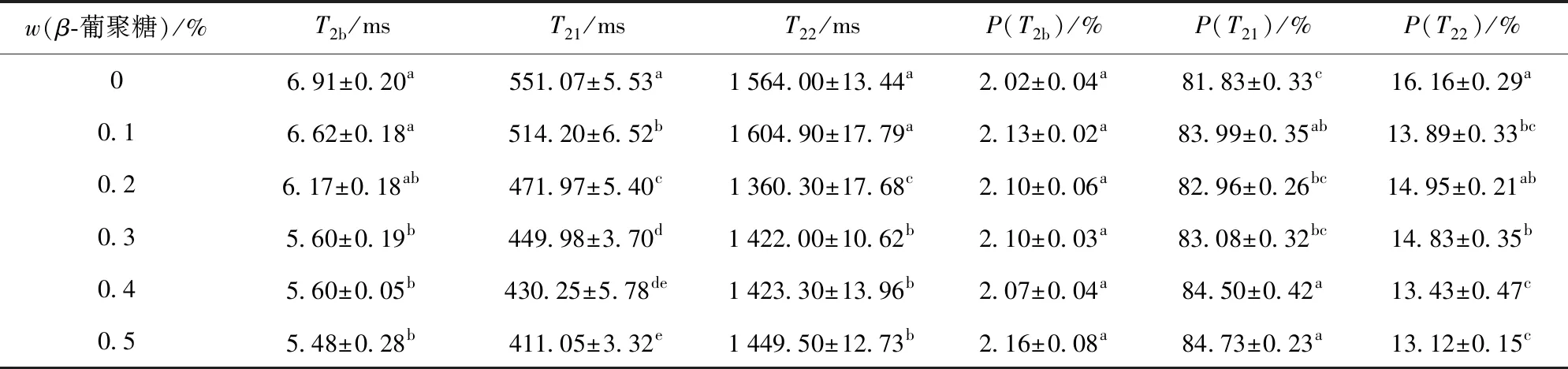
表2 燕麦β-葡聚糖对MP凝胶横向弛豫时间和峰面积百分数的影响Tab.2 Effects of oat β-glucan on relaxation time distribution and peak area fraction of myofibrillar protein gels
数据表示为平均值±标准差(n=3)。同一列中不同字母表示差异显著(P<0.05)。
2.2.3燕麦β-葡聚糖对复合凝胶流变特性的影响
动态流变学特性可以反映受热过程中肌原纤维蛋白热聚集变性过程,添加燕麦β-葡聚糖到肌原纤维蛋白中,检测其动态流变行为,见图5。从图5可知,肌原纤维蛋白的G′(储能模量)在加热初时呈逐渐升高的趋势,主要由于肌球蛋白头部的结合,凝胶初步形成;在50 ℃时达到最大,之后急剧下降;而随着温度的进一步升高,肌球蛋白尾部开始展开,头部的结合也逐渐松散,引起G′持续下降[23];在58 ℃时最低。随后的加热过程中G′又急剧上升,蛋白质完全变性,凝胶网络稳步形成。

图5 燕麦β-葡聚糖对MP凝胶G′和G″影响Fig.5 Effects of oat β-glucan on G′ and G″ of myofibrillar protein gels
G′代表蛋白凝胶的弹性部分,从图5(a)可以看出,加热至80 ℃时,MP对应的G′为130.799 0 Pa,不同添加量的燕麦β-葡聚糖的G′分别为148.716 0、171.383 0、210.314 0、250.041 0、290.345 0 Pa,燕麦β-葡聚糖的添加能显著提高肌原纤维蛋白的弹性模量(P<0.05),且随着添加量增加与弹性模量呈正相关。燕麦β-葡聚糖的添加使得形成热凝胶过程中分子间的交联结构趋于致密。大多数的肌球蛋白分子在适度变性过程中可能展开并形成随机线性结构,它可以增加蛋白质聚集体之间的聚集和交叉连接; 同时,在蛋白质网络中存在的一些变性蛋白的沉积也可以增强凝胶基质,因此形成空间稳固的网络结构[32]。由于在蛋白质加热形成凝胶过程中,燕麦β-葡聚糖分子受热吸水溶胀,结构发生变化,同时,肌球蛋白尾部的螺旋被打开向线圈结构转变,解开的蛋白质又再次聚集、交联,形成网络结构,在此过程中燕麦β-葡聚糖可能会与肌原纤维蛋白发生相互作用。
G″(损耗模量)代表蛋白凝胶的黏性部分,添加燕麦β-葡聚糖后G″与G′的变化趋势相似,能显著提高蛋白凝胶的黏性。加热可促使燕麦β-葡聚糖三螺旋的尾端松动,分子间的氢键相互作用减弱,结构疏松的水分子自由度增加,从而使凝胶黏性增加。Zhuang等[33]发现,添加亲水胶体和多糖可以使蛋白体系具有更高的表观黏度,在随后的加热过程中,肌原纤维蛋白由溶胶(黏性)状态逐渐发展为凝胶(弹性)状态,此外,在整个加热过程中,G′值始终高于G″值,这表明复合肌原纤维蛋白凝胶的类固相力学行为,即形成的凝胶是以弹性为主的高弹性凝胶,这也与前文中添加燕麦β-葡聚糖对凝胶强度的影响结果相一致。
2.2.4燕麦β-葡聚糖对复合凝胶微观结构的影响
凝胶的三维网络结构是决定凝胶强度和WHC的重要因素。图6为通过扫描电子显微镜观察到的复合凝胶微观结构,MP凝胶网络结构趋于松散,蛋白交联较稀疏,存在较大的孔洞。而添加燕麦β-葡聚糖后,凝胶网络结构趋于致密均匀,蛋白交联较紧密,孔洞较细小。肌原蛋白凝胶基质具有较完整的三维网络结构,而燕麦β-葡聚糖有着良好的吸水性,可通过毛细作用将游离的水分束缚进凝胶结构中,形成较致密的网络结构[28]。Liu等[11]在研究燕麦β-葡聚糖对猪肉丸的影响时,发现添加燕麦β-葡聚糖后的猪肉丸表面会变得更加的光滑、细腻,电镜观察凝胶孔洞减少,结构更加致密。Wu等[34]研究可得然胶的分子结构及其凝胶机制时,发现可得然胶分子绝大部分呈三螺旋构象,螺旋链与蛋白胶束缠绕构成凝胶网络。冯美琴等[35]研究发现,由于亚麻籽胶本身具有增稠填充的效果,通过电镜观察可知,亚麻籽胶的加入可以使蛋白凝胶结构更加紧密。
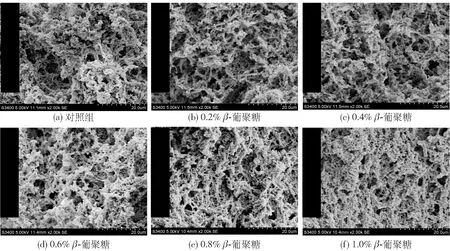
图6 燕麦β-葡聚糖对MP凝胶结构的影响Fig.6 Effects of oat β-glucan on structure of myofibrillar protein gels
2.2.5相关性分析
图7为采用R语言对肌原纤维蛋白的凝胶强度、白度值、持水性、G′、乳化稳定性(ESI和EAI)和水分的动态分布(T21和P(T21)) 进行的相关性分析。由图7可知,T21与ESI、EAI、持水性、凝胶强度和白度值呈显著的负相关,与电势呈显著的正相关。随着燕麦β-葡聚糖添加量的增加,肌原纤维蛋白复合乳状液的ESI、EAI显著增加,所以乳化活性和乳化稳定性提高;肌原纤维蛋白复合凝胶的持水性、凝胶强度、白度值、储能模量和T21显著增加,即蛋白凝胶网络结构中束缚的水分子相对增加,蛋白质结构趋于致密,从而使凝胶强度显著增大,这也与我们微观观察结果相一致。

图7 肌原纤维蛋白各理化指标间的相关性分析Fig.7 Correlation analysis of physical and chemical indexes of myofibrillar protein
3 结 论
在肌原纤维蛋白体系中添加燕麦β-葡聚糖,可显著提高肌原纤维蛋白的乳化活性和稳定性;同时,显著增加了凝胶保水性、凝胶强度和白度值,缩短凝胶的弛豫时间并束缚更多的水分,提高凝胶的储能模量和损失模量,凝胶结构也显著改善,趋于致密均匀。研究为燕麦β-葡聚糖在肉制品中的充分利用提供了一定的理论依据。
