Streptomyces alboflavus抗真菌物质对串珠镰刀菌的抑制机理研究
2019-11-06王志芳李贞景杨明冠路来风王昌禄张健飞巩继贤
王志芳, 李贞景, 杨明冠, 路来风, 王昌禄,*, 李 政,张健飞, 巩继贤
(1.天津工业大学 分析测试中心, 天津 300387;2.天津科技大学 食品工程与生物技术学院/食品营养与安全教育部重点实验室, 天津 300457;3.天津工业大学 纺织科学与工程学院, 天津 300387)
镰刀菌是世界性分布的一类真菌,可侵染达100余种植物,引起植物的根腐、茎腐、花腐和穗腐等多种病害[1-2]。镰刀菌侵染寄主植物维管束系统,破坏植物的输导组织维管束,并产生毒素,造成作物萎蔫死亡,属于生产上最难防治的重要病害之一。镰刀菌在世界范围内造成许多毁灭性的植物病害,如串珠镰刀菌(Fusariummoniliforme)、尖孢镰刀菌(Fusariumoxysporum)造成香蕉萎蔫病,禾谷镰刀菌(Fusariumgraminearum)造成颈腐病等[3-5]。串珠镰刀菌还会污染玉米、高粱、小麦、棉花及某些饲料等,为非专性、非宿主特异性病原菌,其水溶性代谢产物伏马菌素(fumonisin),还可以引起动物各种疾病,如马脑白质软化症、猪肺水肿或大鼠肝癌[6-7]。采用生物防治手段对有害霉菌及其毒素进行防控,对环境污染小,符合农业可持续发展战略方向,受到国内外科学家关注。
链霉菌是重要的生防菌株,利用链霉菌产生的次级代谢物开发抑菌剂具有天然、安全、抑菌效果好等特点,被广泛用于农业及医药领域[8-10]。随着现代生物技术的发展,研究者们在极端环境微生物、新菌种筛选、新物质分离等方面取得了一定的成果。链霉菌具有产生多种次级代谢物的能力,对寻找具有新颖化学结构及开发新作用机理的抗菌药物生物活性资源具有重要意义[11-14]。
Streptomycesalboflavus是从土壤中筛选到的一株拮抗菌,保藏于中国微生物菌种保藏管理委员会普通微生物中心(CGMCC No. 4666),16S rDNA在NCBI注册登录号为JX915780,鉴定为白黄链霉菌。对峙培养法研究发现,该菌对黄曲霉(Aspergillusflavus)、黑曲霉(Aspergillusniger)、米曲霉(Aspergillusoryzae)、赭曲霉(Aspergillusochraceus)、纯绿青霉(Penicilliumverrucosum)、串珠镰刀菌、尖孢镰刀菌、茄腐镰刀菌(Fusariumsolani)等常见重要植物病原菌具有广谱拮抗作用,尤其对串珠镰刀菌的抑制效果最好,且还会产生挥发性抑菌物质[15-16]。为进一步研究Streptomycesalboflavus产生的生物活性物质,本研究对其产生的胞内抗菌物质进行定性分析,并研究其活性物质对串珠镰刀菌的抑菌机理,希望为利用链霉菌开展镰刀菌的生物防治技术研究提供理论依据。
1 材料和方法
1.1 实验材料
1.1.1菌株和培养基
拮抗菌株:拮抗链霉菌菌株Streptomycesalboflavus,本实验室自天津市宝坻区饲料厂储粮仓周围的土壤中筛选分离获得并保藏。供试菌株:串珠镰刀菌(Fusariummoniliforme),由天津市畜牧兽医研究所提供。
供试培养基:高氏一号液体培养基,用于Streptomycesalboflavus发酵液的培养;PDA培养基,用于指示菌串珠镰刀菌的培养及拮抗活性的测定。
1)高氏一号合成培养基配方:可溶性淀粉,20.0 g;NaCl,0.5 g;FeSO4·7H2O,0.01 g;MgSO4·7H2O,0.5 g;KNO3,1 g;K2HPO4,0.5 g;琼脂,20 g;自来水,1 000 mL;调节pH值7.2~7.4。
2)高氏一号液体培养基配方:可溶性淀粉,20.0 g;黄豆粉,10.0 g;KNO3,1.0 g;K2HPO4,0.5 g;NaCl,0.5 g; MgSO4·7H2O,0.5 g;FeSO4·7H2O,0.01 g;自来水,1 000.0 mL;pH值7.2~7.4。
3)PDA培养基配方:称取去皮马铃薯200.0 g,切成小块,加入1 000.0 mL水,煮沸30 min,用双层纱布滤成清液。加水至1 000.0 mL,然后加入20.0 g葡萄糖至完全溶解,pH值自然。
4)查氏培养基配方:NaNO3,3.0 g; K2HPO4,1.0 g;MgSO4·7H2O,0.5 g;KCl,0.5 g;FeSO4·7H2O,0.01 g;蔗糖,30.0 g;蒸馏水,1 000 mL;pH值自然。
1.1.2原料和试剂
黄豆粉,食品级,天津市售黄豆粉;硫酸亚铁、硫酸镁,化学纯,天津市化学试剂一厂;可溶性淀粉、氯化钠、硝酸钾,分析纯,天津市北方天医化学试剂厂;胆固醇(质量比94%)、麦角甾醇(质量比大于75%),Sigma-aldrich公司;葡聚糖(质量比大于97%),百特纯大分子科技有限公司;壳聚糖(质量比大于85%),湖北圣天宇公司;硅胶G、硅胶H,青岛海洋化工厂;葡聚糖凝胶LH- 20,Pharmacia公司。
1.2 仪器和设备
LS- B50L型立式压力蒸汽灭菌锅,上海华线医用核子仪器有限公司;KCL2000型恒温恒湿培养箱,日本Eyela东京理化公司;AG22331型高速离心机,德国Eppendorf公司; CX41型生物显微镜、BX- 60型荧光显微镜,Olympus公司;SU- 1510型扫描电子显微镜,Hiachi公司。
1.3 实验方法
1.3.1Streptomycesalboflavus的发酵培养
将Streptomycesalboflavus菌株划线于高氏一号固体培养基斜面上进行活化, 28 ℃恒温培养箱中培养5~6 d,制备1×106CFU/mL孢子悬液,按体积分数10%添加量加入到液体发酵培养基中,28 ℃,180 r/min摇床培养6 d。
1.3.2Streptomycesalboflavus中抑菌活性物质的分离纯化
用8层纱布过滤发酵液,得到链霉菌菌丝体。甲醇浸提菌丝体,将浸提液减压浓缩,粗提物经萃取、硅胶吸附柱层析、葡聚糖凝胶LH- 20柱层析分离纯化,得到脂溶性抑菌组分。
1.3.3抑菌活性物质检测方法
采用牛津杯法测定抑菌物质的生物活性。将串珠镰刀菌的孢子悬浮液接种于PDA培养基中,然后放置3个牛津杯,将活性物质加入一个牛津杯,其余两个作为空白对照组,培养3 d。
1.3.4抑菌活性物质pH纸层析
以新华一号层析纸为固定相,用pH值为2.2~8.0的磷酸氢二钠- 柠檬酸缓冲液及pH值9~10的甘氨酸- 氢氧化钠溶液分别处理各滤纸条,晾干后备用。在每个pH值的滤纸条上一端标记起点,取抑菌物质20 μL进行点样,晾干后分别在水饱和的正丁醇、水饱和的乙酸乙酯、体积分数50%的乙醇中展层,用生物学显迹法测迁移率Rf值,具体方法见参考文献[17]。
1.3.5抑菌活性物质Doskochilova溶剂纸层析
溶剂系统:Ⅰ.水饱和的正丁醇;Ⅱ.水饱和的正丁醇,内含质量比2%的对甲苯磺酸;Ⅲ.V(正丁醇)∶V(乙酸)∶V(水)为2∶1∶1;Ⅳ.水饱和的正丁醇,内含质量比2%的六氢吡啶;Ⅴ.正丁醇饱和的0.5 mol/L、pH值为7的磷酸缓冲液;Ⅵ.正丁醇饱和的水,内含质量比2%的对甲苯磺酸;Ⅶ.V(苯)∶V(甲醇)为4∶1,滤纸先用磷酸缓冲液处理后晾干;Ⅷ.V(甲醇)∶V(水)为3∶1,水内含质量比3%的NaCl,滤纸先用质量比5%的Na2SO4处理后晾干。用生物学显迹法测迁移率Rf值,具体方法见参考文献[17]。
1.4 抑菌物质对菌丝形态影响的观察
1.4.1光学显微镜观察
采用牛津杯法检测抑菌物质的抑菌活性,挑取由抑菌物质作用产生的透明圈的边际菌丝,光学显微镜观察。挑取未受到抑制作用的菌丝作为对照。
1.4.2荧光显微镜观察
将1×106CFU/mL的串珠镰刀菌孢子悬浮液接种于察氏液体培养基中,28 ℃,180 r/min条件下培养48 h。将串珠镰刀菌的培养液以转速为4 000 r/min,离心10 min,弃上清液,用抑菌物质溶液轻轻悬浮菌丝15 min,去离子水清洗后,用碘化丙啶(PI)染色后,在荧光显微镜下进行观察。对照组菌丝用体积比为50%甲醇(配制抑菌物质的溶液)处理。激发光波长450~490 nm,发射光波长520 nm。
1.4.3扫描电子显微镜观察
采用牛津杯法检测抑菌物质的抑菌活性,并用双面刀片从抑菌物质作用产生的透明圈的边际取样(3~5 mm3),2.5%戊二醛固定2 h,磷酸缓冲液清洗,酒精梯度脱水(体积分数为50%、70%、80%、90%、100%乙醇各20 min),干燥,离子镀膜法镀膜,扫描电镜观察、照相。以未受到抑制作用的菌丝作为对照。
1.5 抑菌物质对菌丝细胞壁和细胞膜组成物质影响的检测
1.5.1抑菌物质对细胞壁和细胞膜组成物质的拮抗作用测试
参照文献[18]进行,配制含有不同浓度的胶状几丁质、壳聚糖、β-1,3葡聚糖的培养基,其终质量浓度分别为0.5、1.0、2.0、10.0 mg/mL,灭菌备用。卵磷脂、麦角甾醇、胆固醇分别配成质量浓度l mg/mL母液,过滤除菌后,加入培养基中,使其终质量浓度分别为0.5、1.0、2.0、10.0、50.0 μg/mL。通过牛津杯法检测加入的物质是否对抑菌物质的抑菌活性产生拮抗作用。
1.5.2抑菌物质对菌丝细胞膜中麦角甾醇合成的检测
1.5.2.1 菌株培养及难皂化脂的提取[19-20]
将抑菌物质加入到PDB培养液中,终质量浓度为10.21 μg/mL,同时接入串珠镰刀菌孢子悬浮液。以不加抑菌物质作为空白对照组,培养3 d后,分别离心收集菌体,PBS洗涤两次至上清液无色,去上清液。精确称取菌体2.5 g,置于250 mL回流瓶中,加碱醇溶液(20% NaOH与95%乙醇体积比为5∶3)32 mL,在90 ℃水浴中皂化1.5 h。再加95%乙醇4 mL继续皂化1 h,冷却后加20 mL 石油醚(沸程30~60 ℃),充分振荡20 min,静置2 h。提取2次,取上层液,用10 mL蒸馏水洗1次,取1 mL定容至10 mL,备用。
1.5.2.2 麦角甾醇HPLC检测[21]
色谱条件为: 流动相V(甲醇)∶V(水)为98∶2;柱温30 ℃,检测波长280 nm,流速1.0 mL/min,灵敏度0.01 AUFS,进样量10 μL。
配制麦角甾醇标准品质量浓度分别为0.062 5、0.125 0、0.250 0、0.500 0、1 .000 0 mg/mL,制作标准曲线,并对样品进行检测。
2 结果与分析
2.1 活性物质的抑菌作用分析
Streptomycesalboflavus中活性物质对串珠镰刀菌的抑制作用见图1。由图1可知,加入活性物质的牛津杯周围产生透明的抑菌圈,活性物质显示出很强的抑菌作用,在透明圈内没有串珠镰刀菌生长。
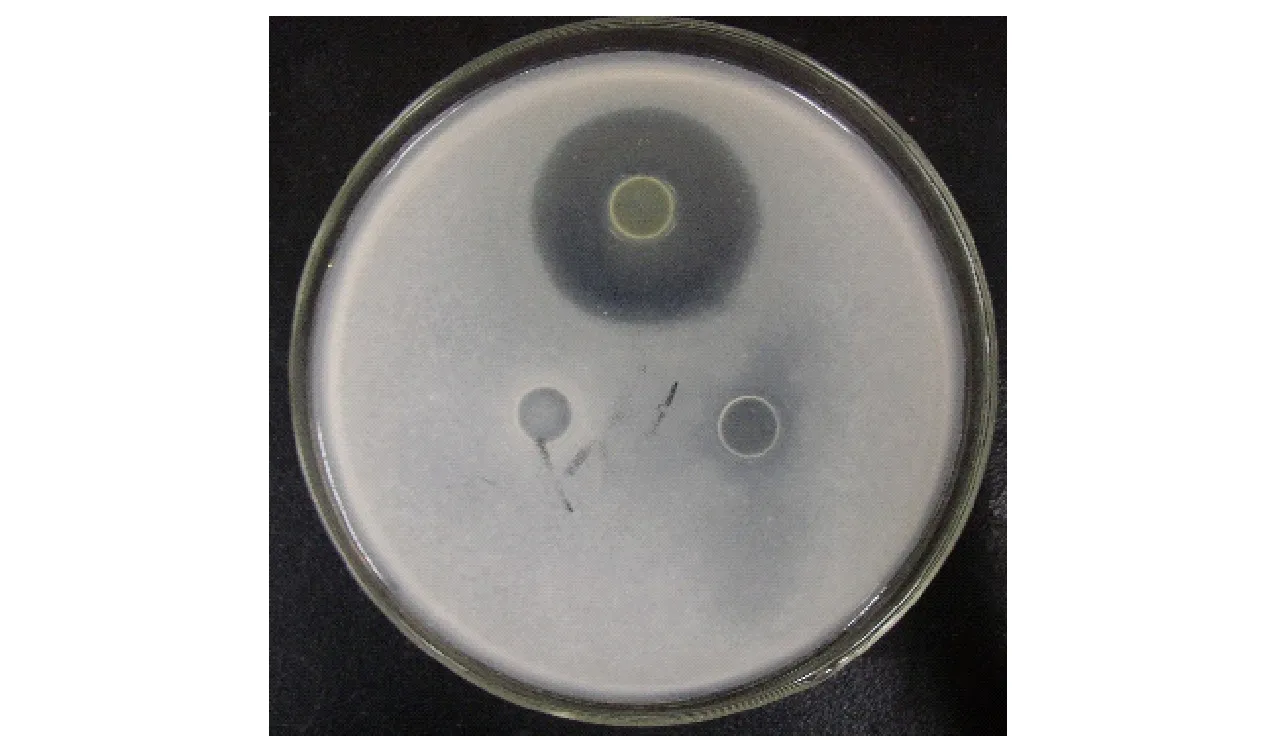
图1 抑菌物质对串珠镰刀菌的抑制作用Fig.1 Inhibit action of active antifungal substance against Fusarium moniliforme
2.2 pH纸层析结果
抑菌物质pH纸层析结果见图2(层析体系为50%乙醇)。由图2可以看出,该物质呈现中性抗生素的特征,不论pH值有何变化,Rf值几乎不变。
以不同pH值缓冲液处理的层析纸为固定相,用合适的溶剂系统为移动相,对不同类型的抗生素进行层析,pH纸层析的Rf值有一定变化规律。可将抗生素分为酸性抗生素、碱性抗生素、中性抗生素和两性抗生素。

图4 抑菌物质对菌丝形态影响的光学显微镜观察结果Fig.4 Effects of antifungal substance on morphological of Fusarium moniliforme by optical microscope

图2 抑菌物质的pH纸层析结果Fig.2 Results of paper chromatography of pH system
2.3 捷克八溶剂纸层析结果
抑菌物质捷克八纸层析结果见图3。由图3可知,活性物质在溶剂系统5和6中移动极小,而在其他溶剂系统中均移动较大,成为倒船帆形。与捷克学者提出的6类标准图谱比较,所得的活性物质的抗生素类别与非水溶性Ⅰ型抗生素层析图谱相似,推断该活性物质为非水溶性Ⅰ型抗生素。
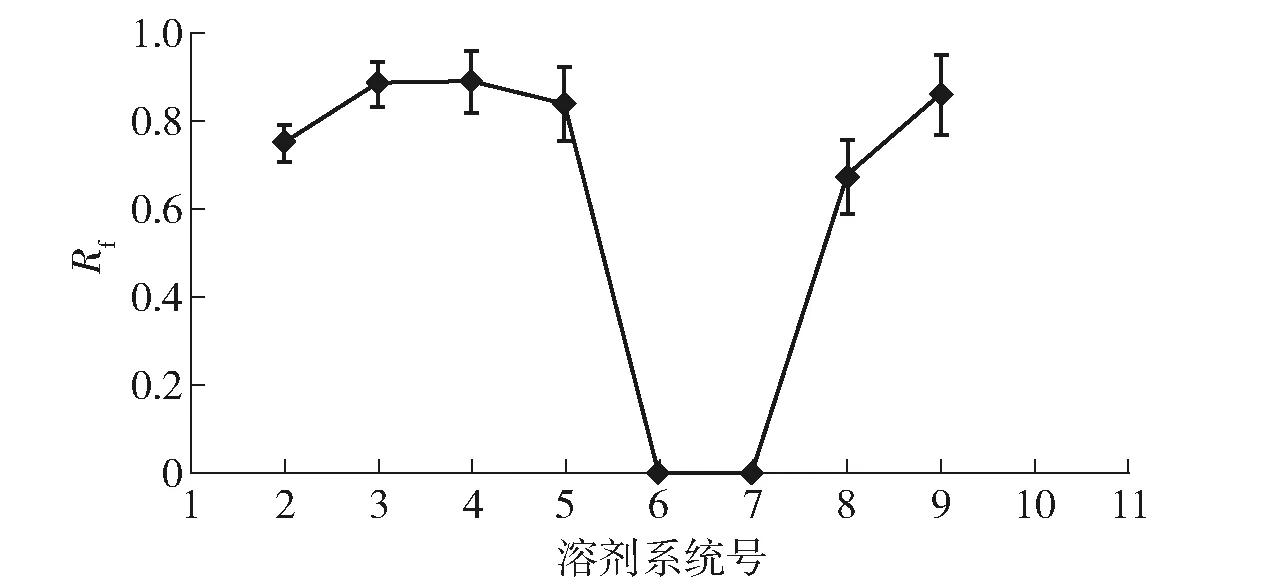
图3 抑菌物质在捷克八溶剂系统的纸层析结果Fig.3 Results of paper chromatography of Doskochilova system
2.4 抑菌物质对菌丝形态的影响
2.4.1光学显微镜观察结果
用光学显微镜观察抑菌物质对菌丝体形态的影响,结果如图4。由图4可知,空白对照组,菌丝形态结构完整、表面光滑,菌丝体圆润饱满、分布均匀,表现出良好的生长状态;抑菌物质作用48 h后的串珠镰刀菌菌丝生长畸形,变得粗细不均,尤其菌丝末端有膨大现象,整个菌丝上有“念珠状”空泡出现,并可见不完整菌丝,原生质体外泄。实验结果表明,抑菌物质可能会通过使菌丝末端膨大阻碍菌丝继续生长。
2.4.2荧光显微镜观察结果
经PI染色后的空白对照组和抑菌物质处理组菌丝,在荧光显微镜下观察结果如图5。图5中,抑菌物质处理15 min后,多数菌丝的细胞核被染成了红色,而空白对照组菌丝没有被染色,推测抑菌物可能破坏串珠镰刀菌菌丝细胞膜的结构,导致膜通透性改变,干扰了菌体正常生理代谢的功能,从而起到对串珠镰刀菌的抑制作用。
2.4.3扫描电子显微镜观察结果
采用扫描电子显微镜(SEM)观察抑菌物质对串珠镰刀菌的抑制作用,结果见图6。图6中,空白对照组菌丝生长繁茂,菌丝细长、均匀;活性物质处理组,大多数菌丝体变形、孢子萌发出畸形的菌芽,出现较大的囊泡。泡囊状菌丝表面凹凸不平,并残留有碎片,推测活性物质可能会抑制孢子的萌发,破坏串珠镰刀菌菌体的完整性,进而产生抑菌或杀菌作用。
2.5 抑菌物质对菌丝细胞壁和细胞膜组成物质的影响
2.5.1抑菌物质对细胞壁和细胞膜组成物质的拮抗效果
抑菌物质对细胞壁物质和细胞膜组成物质的拮抗作用见图7。图7中,含有胶状几丁质、壳聚糖、β-1,3葡聚糖、卵磷脂和胆固醇的培养皿中活性组分的抑菌作用没有变化;而含有麦角甾醇的平板中,抑菌物质的抑菌圈直径减小,并随着麦角甾醇浓度的增加,拮抗效果加强,提示抑菌物质对串珠镰刀菌的作用靶点可能与细胞膜中麦角甾醇有关。

1~6分别表示:胶状几丁质、壳聚糖、β-1,3葡聚糖、卵磷脂、麦角甾醇、胆固醇;不同小写字母表示经Duncan 新复极差法检验,在P<0.05水平差异显著。图7 细胞膜壁物质对抑菌物质的拮抗效果Fig.7 Antagonism of components of cell membrane and cell wall to antifungal substance
2.5.2抑菌物质对菌丝细胞膜中麦角甾醇合成的影响
2.5.2.1 麦角甾醇的标准曲线分析
对不同质量浓度的麦角甾醇标准品分别进行HPLC分析。以麦角甾醇的质量浓度为横坐标,以峰面积为纵坐标制作标准曲线。结果表明,麦角甾醇质量浓度为0.062 5~1.000 0 mg/mL时,标准曲线的线性良好,回归方程为Y=6 378.8X+87.864,R2=0.999 9。
2.5.2.2 串珠镰刀菌菌体细胞膜中麦角甾醇的检测结果
以标准品的保留时间和峰面积值分别作为定性、定量依据。结果表明,正常菌丝的细胞膜中麦角甾醇质量浓度为124.00 ng/mL,而用抑菌物质处理菌丝的细胞膜中麦角甾醇的质量浓度为0.81 ng/mL,表明抑菌物质处理后的串珠镰刀菌菌丝细胞膜中麦角甾醇的生物合成减小。
3 结 论
本实验结果表明,Streptomycesalboflavus产生的抗菌物质对串珠镰刀菌菌丝生长和孢子萌发都有很强的抑制作用。抗菌物质浓度高时,能造成菌丝生长畸形、短粗,膨大形成“念珠状”,菌丝不能向前生长,从而使其受到抑制;此外,抗菌物质处理后的病原菌菌丝尖端形成膨胀泡而破裂,引起原生质外泄,造成溶菌现象。荧光显微镜观察发现,活性物质还可能对串珠镰刀菌的菌体细胞膜造成损伤,导致大分子的PI染料进入细胞内与细胞核DNA结合生成红色荧光物,而正常组菌丝中未见红色荧光物。通过检测细胞壁物质和细胞膜组成物质与抑菌物质对串珠镰刀菌抑菌效果的拮抗作用的影响,发现培养基含有麦角甾醇的平皿中,抑菌物质的抑菌圈直径减小;进一步用HPLC法检测了经过抑菌物质处理的菌丝和空白对照组菌丝中难皂化脂类提取物中麦角甾醇的含量,结果表明,受抑菌物质作用的菌丝细胞膜中麦角甾醇的生物合成减少。
链霉菌是重要的天然抗生素来源菌群,自从抗生素问世以来,各国学者对抗生素如何作用于微生物和作用的具体靶标位点等抑菌机理进行了很多研究。结果表明,抗生素能通过作用于微生物细胞膜、细胞壁、蛋白质合成系统,抑制核酸或核苷酸的合成等多种方式产生抑菌效果;而有一些抗菌物质会通过几种抑制方式同时作用于病原菌,达到抑菌作用。Streptomycesalboflavus产生的抗菌物质对指示菌蛋白质合成系统、核酸或核苷酸的合成等其他作用方式值得进一步探究。随着分子生物学技术在抑菌机理方面的应用,也有报道发现一些新的特异性作用靶点和专化性靶标酶[22-23]。研究抑菌物质的抑菌机理及新的抑菌作用方式对探寻新型防霉保鲜剂具有重要意义。
