尖刀唇石斛化学成分研究
2019-11-04杨晓蓓胡江苗
杨晓蓓,颜 莎,胡江苗,周 俊*
1中国科学院昆明植物研究所 植物化学与西部资源持续利用国家重点实验室,昆明 650201;2中国科学院大学,北京 100049
石斛属(Dendrobium)是兰科(Orchidaceae)植物中第二大属,我国石斛属植物共有74种2变种,主要分布于秦岭、淮河以南,云南、两广、海南等地区[1]。石斛药材最早记录在《神农本草经》中,具有滋阴清热,生津益胃,润肺止咳,明目等功效。目前研究显示石斛中主要包括多糖、生物碱、黄酮、酚类、萜类等,现代药理学研究证明,石斛具有增强免疫、缓解糖尿病及其并发症、抗肿瘤、抗氧化和延缓衰老、护肝、抗炎和保护神经系统等功效[2,3]。
尖刀唇石斛(DendrobiumheterocarpumLindl.)生于海拔1 500~1 750米的山地疏林中树干上,分布于云南南部至西部(勐腊、潞西、腾冲、镇康)、斯里兰卡、印度、尼泊尔、锡金、不丹、缅甸、泰国、老挝、越南、菲律宾、马来西亚、印度尼西亚[1]。尖刀唇石斛茎呈细圆柱形,不分枝,常弯曲,表面金黄色或棕黄色,具细密的浅纵皱纹。质轻而脆,断面黄白色、平坦而疏松,味苦[4]。此花有栽培,具有较高的园艺价值。目前对尖刀唇石斛的研究主要集中于其离体快繁技术、观赏特性和鉴定评价等,对其化学成分及药理活性的研究还未见报道。为了发掘尖刀唇石斛的药用价值及为石斛资源合理的开发利用提供一定的依据,本课题组对其乙酸乙酯提取物的化学成分进行了研究,并从中分离得到15个化合物,分别鉴定为3,4′-二羟基-5-甲氧基联苄(1)、batatasin Ⅲ(2)、3-羟基-4′,5-二甲氧基联苄(3)、3-O-methylgigantol(4)、gigantol(5)、3,4-二羟基-4′,5-二甲氧基联苄(6)、moscatilin(7)、dendrocandin A(8)、(S)-3,4,α-三羟基-4′,5-二甲氧基联苄(9)、densiflorol A(10)、dendrocandin I(11)、dendrocandin F(12)、coelonin(13)、红花素(14)、4-羟基-2-甲氧基-3,6-二甲基苯甲酸(15)。以上化合物均为首次从该植物中分离得到,其中化合物14为首次从该属植物中分离得到,并筛选出部分化合物对小鼠RAW264.7巨噬细胞的一氧化氮生成抑制活性和自由基清除活性进行研究,为尖刀唇石斛深入的开发利用提供了一定的理论依据。
1 仪器与材料
Avance Ⅲ-400超导核磁共振仪(德国布鲁克拜厄斯宾有限公司)、Avance Ⅲ-500超导核磁共振仪(德国布鲁克拜厄斯宾有限公司)、Avance Ⅲ-600 型超导核磁共振仪(德国布鲁克拜厄斯宾有限公司),API QSTAR Pulsari 液相四级杆飞行时间质谱仪(MDS Scipaszex,Concord,Ontario,Canada),Auto Spec Premier P776 三扇型双聚焦质谱仪(Waters,USA),Agilent 1100半制备液相色谱仪(美国安捷伦公司),旋转蒸发仪(德国海道夫),FlexStation 多功能酶标仪(Bio-RAD 680,美国),薄层层析硅胶、柱层析硅胶(青岛美高集团有限公司,中国),Sephadex LH-20 ( Ameisham Biosciences,Uppsala,Sweden),MCI gel CHP-20P (Mitsubishi Chemical Corp.,Tokyo,Japan);用于半制备的试剂为色谱纯,其余均为分析纯。脂多糖、NG-单甲基-L-精氨酸(L-NMMA)、DPPH、ABTS(sigma公司),一氧化氮检测试剂盒(广州碧云天)。小鼠RAW264.7巨噬细胞购自美国典型培养物保藏中心。
尖刀唇石斛采自云南文山,经文山学院丁长春副教授鉴定为兰科石斛属植物尖刀唇石斛(DendrobiumheterocarpumLindl.),标本保存于中国科学院昆明植物研究所植物化学与西部资源持续利用国家重点实验室。
2 实验方法
2.1 提取分离
尖刀唇石斛全草鲜品13 kg干燥粉碎后用40 L丙酮浸泡三次,合并提取液减压浓缩得到丙酮部位浸膏320 g,先后用乙酸乙酯、正丁醇分别合并萃取,减压回收萃取液乙酸乙酯和正丁醇,最终得到乙酸乙酯部位浸膏95 g,正丁醇部位浸膏77 g。
其中乙酸乙酯部位,经硅胶柱色谱(石油醚-丙酮,100∶0、100∶1、50∶1、20∶1、10∶1、5∶1、3∶1、1∶1、0∶1)系统梯度洗脱,得到6个组分(Fr.1~Fr.6)。Fr.1(6.7g)经硅胶柱色谱(石油醚-乙酸乙酯,100∶0、100∶1、50∶1、20∶1、10∶1、5∶1、3∶1、1∶1、0∶1)系统梯度洗脱得到5个组分(Fr.1.1~Fr1.5),Fr.1.1经Sephadex LH-20凝胶柱层析(三氯甲烷-甲醇,1∶1)纯化得到化合物15(3 mg)。
Fr.2(2.0 g)经Sephadex LH-20凝胶柱层析(三氯甲烷-甲醇,1∶1)分离得到1个组份(Fr.2.1)和化合物3(128 mg)和10(2 mg)。
Fr.3(4.5 g)经Sephadex LH-20凝胶柱层析(三氯甲烷-甲醇,1∶1)分离得到3个组份(Fr.3.1~Fr.3.3)。Fr.3.1经正相硅胶柱(石油醚-丙酮,3∶1)得到2个组份(Fr.3.1.1~Fr.3.1.2),Fr.3.1.2依次通过凝胶柱层析(三氯甲烷-甲醇,1∶1)、半制备HPLC(甲醇-水,70%)分离得到化合物12(10 mg);Fr.3.1.1经过MCI柱(甲醇-水,20%~100%)、正相硅胶柱(石油醚-乙酸乙酯 3∶2)、Sephadex LH-20凝胶柱层析(三氯甲烷-甲醇,1∶1)分离得到化合物11(5 mg)、8(8 mg)和6(7 mg)。Fr.3.2经过正相硅胶柱(石油醚-乙酸乙酯 5∶1)、Sephadex LH-20凝胶柱层析(三氯甲烷-甲醇,1∶1)、半制备HPLC分离得到化合物4(3 mg)和9(3 mg)。
Fr.4(5.4 g)经Sephadex LH-20凝胶柱层析(三氯甲烷-甲醇,1∶1)分离得到5个组份(Fr.4.1~Fr.4.5)。Fr.4.5经过正相硅胶柱(三氯甲烷-甲醇,40∶1)、Sephadex LH-20凝胶柱层析(三氯甲烷-甲醇,1∶1)、半制备HPLC(甲醇-水,45%)分离得到化合物5(11 mg),半制备HPLC(甲醇-水,70%)分离得到化合物1(37 mg)和2(22 mg);Fr.3.5经过Sephadex LH-20凝胶柱层析(甲醇-水,90%)、半制备HPLC(甲醇-水,60%)分离得到化合物7(7 mg)。
Fr.5(4.3 g)经Sephadex LH-20凝胶柱层析(三氯甲烷-甲醇,1∶1)分离得到5个组份(Fr.5.1~Fr.5.5)。Fr.5.5经过正相硅胶柱(石油醚-丙酮,10∶1)、半制备HPLC(甲醇-水,65%)分离得到化合物13(5 mg)和14(6 mg)。
2.2 RAW264.7细胞NO生成抑制活性
以脂多糖(LPS)诱导的小鼠巨噬细胞RAW264.7为体外炎症反应模型,一氧化氮合酶抑制剂NG-单甲基-L-精氨酸(L-NMMA,IC50=34 μmol/L)为阳性对照(50 μmol/L),Griess试剂显色法检测NO的生成量,同时以MTS法检测细胞活力,考察石斛中酚类化合物的抗炎作用。
将RAW264.7细胞接种至96孔板,培养过夜,弃去上清液,用1mg/mL的LPS诱导,同时加入终浓度为25 μmol/L的化合物溶液,设置LPS对照组和L-NMMA阳性对照组,培养过夜,分别取各组50 μL上清液随后加入Griess试剂I和试剂II各50 μL,设置3个复孔,30 min内于540 nm处测定吸光度值,利用公式1计算NO生成抑制率。同时用MTS检测细胞活力,排除化合物的细胞毒性对NO生成的影响。
NO生成抑制器(%)=(LPS对照组OD540nm-样品组OD540nm)/LPS对照组OD540nm×100%
(1)
2.3 自由基清除实验
DPPH是1,1-二苯基-2-三硝基苯肼[1,1-diphenyl-2-picrylhydrazyl radical 2,2-diphenyl-1-(2,4,6-trinitrophenyl)hydrazyl ]的英文简称,ABTS是2,2′-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐[2,2′-azinobis-(3-ethylbenzthiazoline-6-sulphonate)]的英文简称,其测定自由基清除作用是基于电子转移的方法,通过分光光度计测定颜色的变化来反映抗氧化能力的强弱。
2.3.1 DPPH自由基清除实验
精密称取DPPH试剂4.0 mg,用无水乙醇定容至10 mL,待用。5倍稀释DPPH自由基溶液,在96孔板中加入25 μmol/L的化合物100 μL,每个样品设3个复孔,再加入稀释的DPPH自由基溶液100 μL,同时设置空白对照和化合物空白对照,以同浓度的水溶性维生素E(Trolox)为阳性对照,常温反应37 ℃避光静置反应30 min后于波长517 nm处测定OD值,记为DS,空白对照记为DC,化合物对照记为DSC,按公式2计算自由基清除率(SR)。
SR(%)=[1-(DS-DSC)]/DC×100% (2)
2.3.2 ABTS自由基清除实验
精密称取ABTS试剂40.0 mg,用蒸馏水定容至10 mL,再精密称取过硫酸钾7.0 mg,用蒸馏水定容至10 mL,摇匀后与ABTS水溶液混合,室温黑暗处反应12~16 h,产生ABTS自由基,避光保存,待用。15倍稀释ABTS自由基溶液,在96孔板中加入25 μmol/L的化合物100 μL,每个样品设3个复孔,再加入稀释的ABTS自由基溶液100 μL,同时设置空白对照和化合物对照,以同浓度的水溶性维生素E(Trolox)为阳性对照,常温反应5 min后于波长734 nm处测定OD值,记为DS,空白对照记为DC,化合物对照记为DSC,按公式2计算自由基清除率(SR)。
3 结果与讨论
3.1 结构鉴定
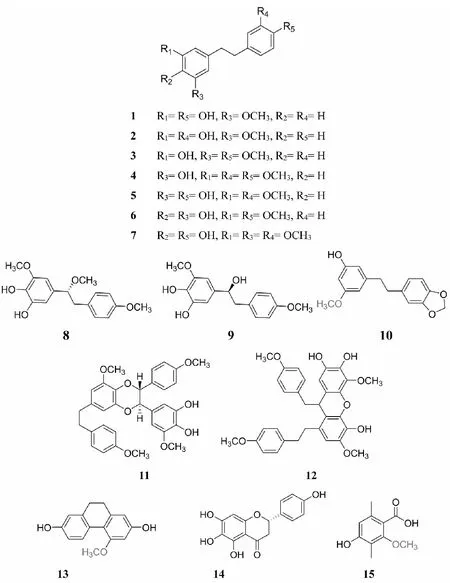
图1 化合物结构Fig.1 Structures of compounds
化合物1白色粉末(三氯甲烷);(+)-ESIMS:m/z267 [M+Na]+;C15H16O3;1H NMR(500 MHz,CDCl3)δH:6.96 (2H,d,J=8.5 Hz,H-2′,6′),6.66 (2H,d,J=8.5 Hz,H-3′,5′),6.20 (1H,d,J=1.9 Hz,H-2),6.19 (1H,d,J=1.9 Hz,H-6),6.16 (1H,brs,H-4),2.74 (4H,m,H-α,α′),3.69 (3H,s,OCH3-3);13C NMR(125 MHz,CDCl3)δC:162.2 (s,C-3),159.3 (s,C-5),156.4 (s,C-4′),145.6 (s,C-1),134.0 (s,C-1′),130.4 (d,C-2′,6′),116.0 (d,C-3′,5′),109.1 (d,C-6),106.6 (d,C-2),99.9 (d,C-4),39.7 (t,C-α),38.1 (t,C-α′),55.5 (q,OCH3-3); 。以上数据与文献[5]报道基本一致,故鉴定化合物1为3,4′-二羟基-5-甲氧基联苄。
化合物2红色油状物(三氯甲烷);(+)-ESIMS:m/z267 [M+Na]+;C15H16O3;1H NMR(500 MHz,CDCl3)δH:7.13(1H,t,J=7.6 Hz,H-5′),6.75(1H,dd,J=7.6,1.9 Hz,H-6′),6.65(1H,dd,J=7.6,1.9 Hz,H-4′),6.64(1H,d,J=1.9 Hz,H-2′),6.32(1H,d,J=2.0 Hz,H-4),6.25(2H,brs,H-2,6),2.81(4H,m,H-α,α′),3.74(3H,s,OCH3-3);13C NMR(125 MHz,CDCl3)δC:160.8(s,C-3),156.6(s,C-5),155.5(s,C-3′),144.4(s,C-1),143.6(s,C-1′),129.6(d,C-5′,6′),121.0(d,C-6′),115.4(d,C-2′),112.9(d,C-4′),108.0(d,C-6),106.8(d,C-2),99.1(d,C-4),37.7(t,C-α),37.3(t,C-α′),55.3(q,OCH3-3)。以上数据与文献[6]报道基本一致,故鉴定化合物2为batatasinⅢ。
化合物3黄色油状物(三氯甲烷);C16H18O3;1H NMR(400 MHz,CDCl3)δH:7.09(2H,d,J=8.6 Hz,H-2′,6′),6.83(2H,d,J=8.6 Hz,H-3′,5′),6.32(1H,t,J=1.8 Hz,H-6),6.26(1H,d,J=1.8 Hz,H-2),6.25(1H,d,J=1.8 Hz,H-4),2.82(4H,m,H-α,α′),3.79(3H,s,OCH3-4′),3.75(3H,s,OCH3-5);13C NMR(100 MHz,CDCl3)δC:160.8(s,C-4′),157.8(s,C-5),156.6(s,C-3),144.6(s,C-1),133.8(s,C-1′),129.4(d,C-2′,6′),113.8(d,C-3′,5′),108.0(d,C-2),106.8(d,C-6),99.0(d,C-4),38.2(t,C-α),36.7(t,C-α′),55.3(q,OCH3-3′),55.2(q,OCH3-5)。以上数据与文献[7]报道基本一致,故鉴定化合物3为3-羟基-4′,5-二甲氧基联苄。
化合物4白色无定形粉末(三氯甲烷);C17H20O4;1H NMR(400 MHz,CDCl3)δH:6.79(1H,d,J=8.1 Hz,H-5′),6.72(1H,dd,J=8.1,1.9 Hz,H-6′),6.66(1H,d,J=1.9 Hz,H-2′),6.32(1H,t,J=1.9 Hz,H-4),6.25(2H,d,J=1.9 Hz,H-2,6),2.82(4H,m,H-α,α′),3.86(3H,s,OCH3-3′),3.84(3H,s,OCH3-4′),3.75(3H,s,OCH3-3);13C NMR(100 MHz,CDCl3)δC:159.8(s,C-3),155.6(s,C-5),147.7(s,C-3′),146.2(s,C-1),143.5(s,C-4′),133.3(s,C-1′),119.2(d,C-6′),110.8(d,C-5′),110.2(d,C-2′),106.9(d,C-6),105.8(d,C-2),97.9(d,C-4),37.2(t,C-α),36.1(t,C-α′),54.9(q,OCH3-3),54.8(q,OCH3-3′),54.2(q,OCH3-4′)。以上数据与文献[8]报道基本一致,故鉴定化合物4为3-O-methylgigantol。
化合物5白色无定形粉末(三氯甲烷);(+)-ESIMS:m/z297 [M+ Na]+;C16H18O4;1H NMR(400 MHz,CDCl3)δH:6.84(1H,d,J=8.0 Hz,H-5′),6.68(1H,dd,J=8.0,1.9 Hz,H-6′),6.63(1H,d,J=1.9 Hz,H-2′),6.32(1H,t,J=1.9 Hz,H-4),6.25(2H,d,J=1.9 Hz,H-2,6),2.81(4H,m,H-α,α′),3.84(3H,s,OCH3-3′),3.75(3H,s,OCH3-3);13C NMR(100 MHz,CDCl3)δC:160.8(s,C-3),156.6(s,C-5),146.3(s,C-3′),144.6(s,C-1),143.7(s,C-4′),133.7(s,C-1′),121.0(d,C-6′),114.2(d,C-5′),111.2(d,C-2′),108.1(d,C-6),106.8(d,C-2),99.0(d,C-4),38.3(t,C-α),37.3(t,C-α′),55.9(q,OCH3-3′),55.3(q,OCH3-3)。以上数据与文献[9]报道基本一致,故鉴定化合物5为gigantol。
化合物6淡黄色油状物(三氯甲烷);C16H18O4;1H NMR(400 MHz,CDCl3)δH:7.09(2H,d,J=8.6 Hz,H-2′,6′),6.82(2H,d,J=8.6 Hz,H-3′,5′),6.45(1H,d,J=1.8 Hz,H-6),6.24(1H,d,J=1.8 Hz,H-2),2.79(4H,m,H-α,α′),3.82(3H,s,OCH3-5),3.79(3H,s,OCH3-4′);13C NMR(100 MHz,CDCl3)δC:157.8(s,C-4′),146.8(s,C-5),133.9(s,C-3),133.8(s,C-4),130.5(s,C-1),130.4(s,C-1′),129.4(d,C-2′,6′),113.7(d,C-3′,5′),108.7(d,C-6),103.6(d,C-2),38.1(s,C-α),37.2(t,C-α′),56.1(q,OCH3-5),55.3(q,OCH3-4′)。以上数据与文献[10]报道基本一致,故鉴定化合物6为3,4-二羟基-4′,5-二甲氧基联苄。
化合物7黄色油状物(三氯甲烷);(+)-ESIMS:m/z327 [M+ Na]+;C17H20O5;1H NMR(400 MHz,CDCl3)δH:6.83(1H,d,J=8.0 Hz,H-5′),6.68(1H,dd,J=8.0,1.9 Hz,H-6′),6.61(1H,d,J=1.9 Hz,H-2′),6.36(2H,s,H-2,6),2.81(4H,m,H-α,α′),3.85(6H,s,OCH3-3,5),3.84(3H,s,OCH3-3′);13C NMR(100 MHz,CDCl3)δC:146.8(s,C-3,5),146.2(s,C-3′),143.7(s,C-4′),133.7(s,C-1′),132.9(s,C-4),132.8(s,C-1),121.1(d,C-6′),114.2(d,C-5′),111.2(d,C-2′),105.2(d,C-2,6),38.5(t,C-α′),38.0(t,C-α),56.3(q,OCH3-3,5),55.9(q,OCH3-3′)。以上数据与文献[11]报道基本一致,故鉴定化合物7为moscatilin。
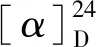
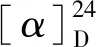
化合物10白色无定形粉末(三氯甲烷);(+)-ESIMS:m/z295 [M+ Na]+;C16H16O4;1H NMR(400 MHz,CDCl3)δH:6.72(1H,d,J=7.8 Hz,H-5′),6.68(1H,d,J=1.7 Hz,H-2′),6.62(1H,dd,J=7.8,1.7 Hz,H-6′),6.31(1H,s,H-4),6.25(2H,s,H-2,6),5.92(2H,s,H-7′),3.76(3H,s,OCH3-3),2.79(4H,m,H-α,α′);13C NMR(100 MHz,CDCl3)δC:159.7(s,C-12′),156.6(s,C-5),147.5(s,C-3′),145.7(s,C-4′),144.4(s,C-1),135.5(s,C-1′),121.2(d,C-6′),108.9(d,C-2′),108.1(d,C-5′),107.9(d,C-6),106.8(d,C-2),100.8(t,C-7′),99.0(d,C-4),55.3(q,OCH3-3),38.2(t,C-α),37.3(t,C-α′)。以上数据[14]与文献报道基本一致,故鉴定化合物10为densiflorol A。
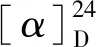
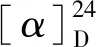
化合物13淡黄色油状物(甲醇);(+)-ESIMS:m/z265 [M+ Na]+;C15H16O3;1H NMR(500 MHz,CDCl3)δH:7.98(1H,d,J=8.2 Hz,H-5),6.61(1H,d,J=8.2,2.7 Hz,H-6),6.59(1H,d,J=2.7 Hz,H-8),6.38(1H,d,J=2.3 Hz,H-1),6.29(1H,d,J=2.3 Hz,H-3),2.62(4H,s,H-9,10),3.81(3H,s,OCH3-4);13C NMR(125 MHz,CDCl3)δC:159.1(s,C-4),157.5(s,C-2),156.1(s,C-7),141.8(s,C-8a),140.5(s,C-1a),130.0(d,C-5),126.2(s,C-5a),116.8(s,C-4a),115.0(d,C-6),113.6(d,C-8),108.3(d,C-1),99.2(d,C-3),31.8(t,C-9),31.2(t,C-10),55.8(q,OCH3-4)。以上数据与文献[17]报道基本一致,故鉴定化合物13为coelonin。
化合物14黄色粉末(甲醇);(+)-ESIMS:m/z289 [M+ H]+;C15H12O6;1H NMR(500 MHz,CDCl3)δH:7.30(2H,d,J=8.6 Hz,H-2′,6′),6.81(2H,d,J=8.6 Hz,H-3′,5′),5.87(1H,s,C-8),5.31(1H,dd,J=13.0,3.0 Hz,H-2),3.09(1H,dd,J=17.2,13.0 Hz,H-3a),2.67(1H,dd,J=17.2,3.0 Hz,H-3b);13C NMR(125 MHz,CDCl3)δC:197.6(s,C-4),168.8(s,C-4′),165.5(s,C-9),164.9(s,C-5),159.0(s,C-7),131.1(s,C-1′),129.0(d,C-2′,6′),116.3(d,C-3′,5′),103.3(d,C-10),96.3(d,C-8),80.4(d,C-2),44.0(t,C-3)。以上数据与文献[18]报道基本一致,故鉴定化合物14为红花素。
化合物15无色针晶(甲醇);1H NMR(500 MHz,CDCl3)δH:12.02(1H,s,-COOH),6.20(1H,s,H-5),3.91(3H,s,OCH3-2),2.45(3H,s,CH3-6),2.09(3H,s,CH3-3);13C NMR(125 MHz,CDCl3)δC:172.6(s,-COOH),163.2(s,C-4),158.0(s,C-2),140.2(s,C-6),110.5(d,C-6),108.5(s,C-5),105.3(s,C-1),51.8(q,OCH3-2),24.1(q,CH3-6),7.7(q,CH3-3)。以上数据与文献[19]报道基本一致,故鉴定化合物15为4-羟基-2-甲氧基-3,6-二甲基苯甲酸。
3.2 小鼠RAW264.7巨噬细胞NO生成抑制活性
对尖刀唇石斛中分离得到的7个化合物(2、3、4、5、10、11、14)在25 μmol/L浓度下对RAW264.7细胞的NO生成抑制作用进行筛选,其结果如表1所示:
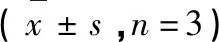

化合物Compound抑制率Inhibitionrate(%)L-NMMA∗57.91±1.50246.06±0.26351.15±0.27446.01±0.30551.57±0.361013.72±1.921158.54±0.161431.72±0.51
注:L-NMMA(50 μmol/L),一氧化氮合酶抑制剂,IC50=34 μmol/L。
Note:L-NMMA(50 μmol/L), an NO synthase inhibitor,was used as a positive control (IC50=34 μmol/L).
3.3 自由基清除实验
从尖刀唇石斛乙酸乙酯提取物中分离得到的化合物大多属于酚类化合物,多羟基的结构使其具有自由基清除能力。实验使用ABTS法和DPPH法对分离得到的6个化合物(1、2、5、6、9、12)在25 μmol/L浓度下自由基清除能力进行了检测,以水溶性维生素E(Trolox)为阳性对照,实验结果如表2所示。
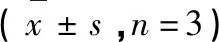
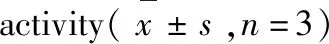

化合物CompoundABTS自由基清除率ABTS+radicalscavengingrate(%)DPPH自由基清除率DPPHradicalscavengingrate(%)Trolox∗50.71±7.5856.86±0.50131.13±3.190.68±1.45234.88±4.111.93±1.24540.97±6.555.36±1.09628.32±2.9433.13±2.20916.58±2.7521.79±1.011229.89±5.3821.08±1.19
注:Trolox (25 μmol/L),水溶性维生素E,自由基清除阳性对照。
Note:Positive control used for radical scavenging assay at the concentration of 25 μmol/L.
4 结论
本文对尖刀唇石斛的乙酸乙酯提取物进行了化学成分的研究,从中分离鉴定了15个化合物,均为首次从尖刀唇石斛中分离得到。对其中7个化合物的一氧化氮生成抑制活性进行了研究,发现化合物3、5、11在25 μmol/L浓度下,对小鼠RAW264.7巨噬细胞的NO生成抑制率均在50%以上,其中化合物11与50 μmol/L的阳性对照药L-NMMA抑制效果相当。近年来越来越多的研究表明,炎症与许多疾病息息相关。石斛作为传统中药材,具有滋阴清热的功效。现代科学研究表明,石斛中的菲类及联苄类化合物都表现出一定的抗炎活性[20,21]。在25 μmol/L浓度下化合物1、2、5和12均表现出一定的ABTS自由基清除能力,其中化合物5的结果最为显著,其半数清除浓度(IC50)为36.41± 1.99 μmol/L;而6、9、12三个化合物显示出DPPH自由基清除能力,其中效果最显著的为化合物6,其IC50为62.05± 3.40 μmol/L,化合物5和6具有较好的体外抗氧化能力。尖刀唇石斛多用于观赏,药用方向少有报道,本文首次揭示了尖刀唇石斛中体外抗炎和抗氧化的活性成分,为尖刀唇石斛的深入开发利用提供一定理论基础。
